
Термодинамика твердого состояния
Термодинамические свойства кристаллов представляют интерес с двух сторон. Во- первых это такие грубые свойства как химическая реакционная способность одних веществ по отношению к другим и оценка степени протекания той или иной реакции. Во-вторых, это такие свойства, как концентрация дефектов различных типов и их взаимодействие друг с другом. В качестве дефектов могут рассматриваться вакансии в решетках, электроны проводимости в полупроводниках, дислокации, атомные примеси, границы раздела зерен и т.д.
Эти два типа свойств не являются независимыми. Поскольку на концентрацию дефектов в веществе существенно можно влиять термообработкой.
Теплоемкость твердого тела
Теплоемкость вещества выражается как
функция температуры. При T=0
![]() .Для
многих элементов в твердом состоянии
.Для
многих элементов в твердом состоянии
![]() приближается к 25
приближается к 25![]() или 6
или 6![]() .
Это закон Дилонга-Пти. Для изучающего
свойства вещества важно знать теплоемкости,
так как температурная зависимость
теплоемкости дает информацию о механизме
поглощения энергии веществом.
.
Это закон Дилонга-Пти. Для изучающего
свойства вещества важно знать теплоемкости,
так как температурная зависимость
теплоемкости дает информацию о механизме
поглощения энергии веществом.
Для расчетов теплоемкость удобно
выражать в виде эмпирических функций
от температуры. Для широкого интервала
температурную зависимость теплоемкости
трудно выразить с помощью уравнений
простого вида. При низких температурах
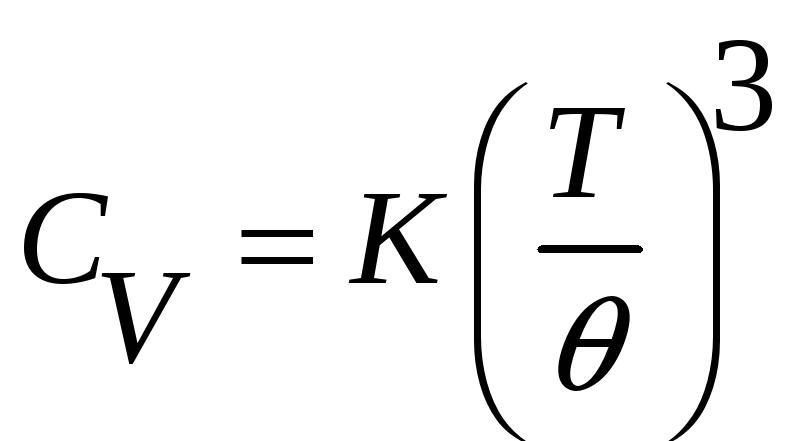 ,
где K – константа
равная 1944,5
,
где K – константа
равная 1944,5![]() ,
464,5
,
464,5![]() ,
а
,
а![]() - температура Дебая для данного вещества.
Это уравнение выведено теоретически
Дебаем и верно приблизительно до 0.1
- температура Дебая для данного вещества.
Это уравнение выведено теоретически
Дебаем и верно приблизительно до 0.1![]() ,
т.е.T<0.1
,
т.е.T<0.1![]() .
.
При повышенных температурах (обычно
выше комнатной температуры) теплоемкость
большинства веществ выражают эмпирическими
уравнениями типа
![]() ,
где a,b,c
–эмпирические константы. Для примера
эмпирические константы для серебра
Ag
,
где a,b,c
–эмпирические константы. Для примера
эмпирические константы для серебра
Ag
|
|
a |
b |
|
|
Ag тв. |
21,31 |
8,54 |
1,51 |
|
Ag ж |
39,56 |
- |
- |
Достаточно полные данные имеются во многих теплофизических справочниках.
Абсолютные значения термодинамических величин получить невозможно. Поэтому термодинамические величины могут быть представлены как разность между двумя состояниями, одно из которых принимается за стандартное. В большинстве случаев за стандартное состояние твердых веществ, жидкостей и газов принимаются наиболее устойчивые формы и состояние – под давлением в одну атмосферу и при определенной температуре.
Следовательно, стандартное состояние зависит от температуры. Например, олово имеет две аллотропные модификации серое олово устойчиво при температуре ниже 286 К, а белое между 286К и температурой плавления. Поэтому ниже 286К за стандартное состояние принимается серое, а выше 286К белая модификация. При составлении таблиц для углерода за стандартное состояние принимается алмаз, а не графит, готя модификация графита более устойчива. Поэтому при использовании данных из разных источников необходимо убедиться, что стандартные состояния в них совпадают. При составлении таблиц величины теплот образования (или энтальпии образования) веществ относят к стандартной температуре и давлению. В обычных условиях за стандартные состояния температуры принята комнатная температура 298К.
|
вещество |
|
|
|
|
|
|
|
Sn(серое) Sn(белое)
Графит Алмаз
AgCl (тв.) MoO2(тв.) |
-2.09 0
0 1.9
-126.8 -583.9 |
-0.5 0
0 0.454
-30.3 -139.5 |
Символом
![]() обозначена теплота(энтальрия) образования
вещества из элементов в их стандартных
состояниях при 298К. Значок «°» указывает
на стандартное состояние.
обозначена теплота(энтальрия) образования
вещества из элементов в их стандартных
состояниях при 298К. Значок «°» указывает
на стандартное состояние.
Например уравнение химической реакции
Mo(тв.,298К,1атм)+ O2(г.,298К,1атм)=MoO2(тв.,298К,1атм)
Обычно запись (1атм) для твердых и жидких фаз в круглых скобках опускается. При этом подразумевается, что такое ограничение существует по умолчанию.
Теплота образования элемента, который
находится в термодинамически устойчивом
состоянии при298К, будет, конечно, равна
нулю. Отрицательное значение для
![]() указывает
на экзотермический процесс, а положительное
на эндотермический.
указывает
на экзотермический процесс, а положительное
на эндотермический.
Так как термодинамические функции являются функциями состояния, то несущественно каким образом мы будем проводить реакцию. Важно только начальное и конечное состояние. В результате этого энтальпия определенной реакции может быть получена из алгебраической суммы теплот образования веществ, входящих в уравнение данной реакции.
Величины
![]() ,
приводимые в таблицах, это энтальпии
реакций между элементами при 298К. В
большинстве случаев , однако, интерес
представляют энтальпии реакций
,
приводимые в таблицах, это энтальпии
реакций между элементами при 298К. В
большинстве случаев , однако, интерес
представляют энтальпии реакций
![]() при температурах, отличных от 298К.
при температурах, отличных от 298К.
Энтальпия веществ данного состава является функцией T,P, и V. Эти переменные не являются независимыми, а связаны определенными отношениями в уравнении состояния.
Для кристалла необходимо оговорить дополнительные ограничения. Кристалл должен находиться в своем низшем энергетическом уровне, т.е. не иметь дефектов, таких как границы зерен, избыточные вакансии или дислокации. Если это ограничение не ввести, то по крайней мере объем кристалла не будет функцией состояния системы. Таким образом только две переменные могут рассматриваться как независимые.
![]() ,
,
![]() ,
,
![]()
Выбор функциональной связи зависит от конкретно рассматриваемого состояния.
Пример.
Найти теплоту реакции при температуре 298К и давлении равном 1атм. Для реакции
MnSiO3(тв.,298К)=MnO(тв.,298К)+SiO2(кварц,298К)
Продукт реагент
Чтобы найти
![]() для этой реакции, суммируем стандартные
теплоты образования MnO(тв.,298К)
и SiO2(кварц,298К) и
вычитаем из этой суммы теплоту образования
MnSiO3(тв.,298К)
для этой реакции, суммируем стандартные
теплоты образования MnO(тв.,298К)
и SiO2(кварц,298К) и
вычитаем из этой суммы теплоту образования
MnSiO3(тв.,298К)
Продукт реагент
-
Mn (тв.,298К)+1/2O2(г.,298К,1атм.)= MnO(тв.,298К)
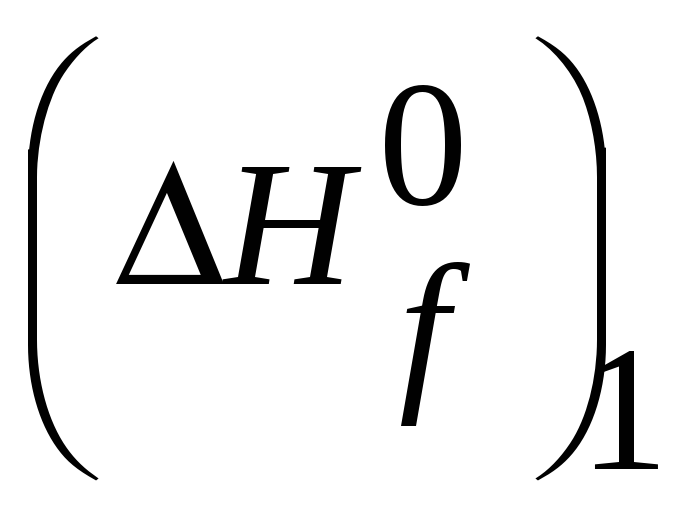 =-385,1
(кДж). Все величины берутся из таблиц.
Учтем, что для Mn
(тв.,298К)
=-385,1
(кДж). Все величины берутся из таблиц.
Учтем, что для Mn
(тв.,298К)
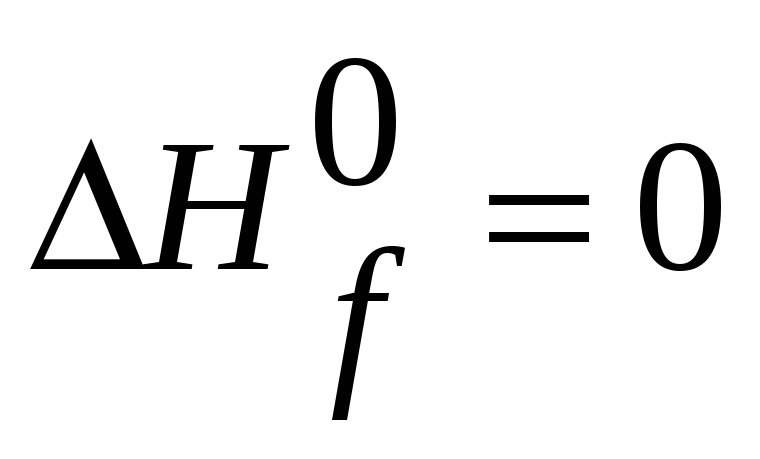 ,и
для O2(г.,298К,1атм.)
,и
для O2(г.,298К,1атм.)
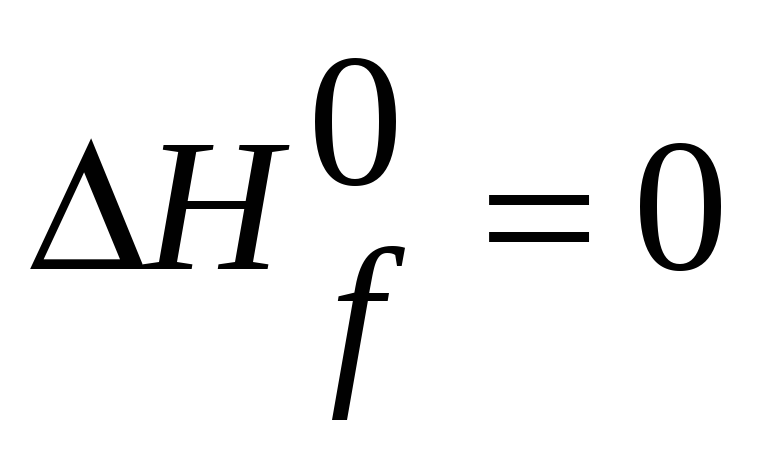 .
. -
Si(тв.,298К)+ O2(г.,298К,1атм.)= SiO2(кварц.,298К)
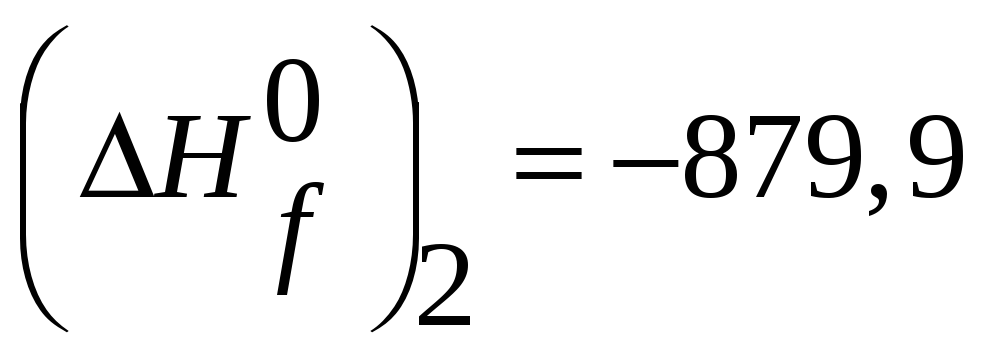 (кДж).
(кДж). -
MnSiO3(тв.,298К)= Mn (тв.,298К)+ Si(тв.,298К) +3/2O2(г.,298К,1атм.)
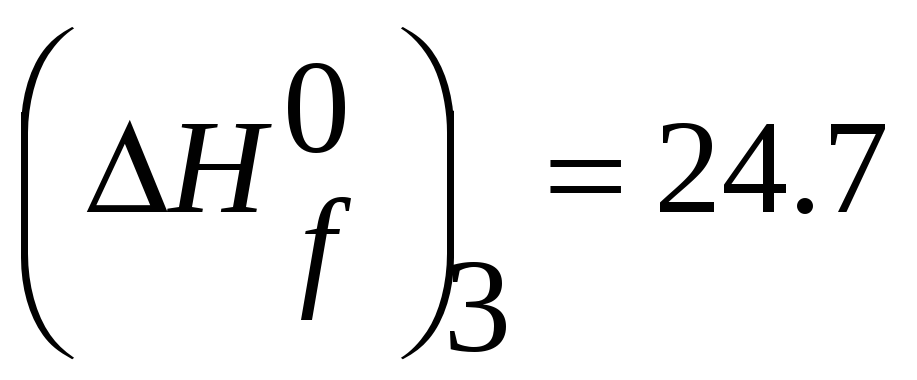 (кДж).
(кДж).
Алгебраическая сумма теплот образования
дает требуемую теплоту реакции
![]() (кДж).
(кДж).
Мы рассмотрели пример расчета теплоты реакции при стандартной температуре. Но на практике нас будут интересовать и другие температуры.
Полагая
![]() и используя основную теорему частного
дифференцирования запишем
и используя основную теорему частного
дифференцирования запишем
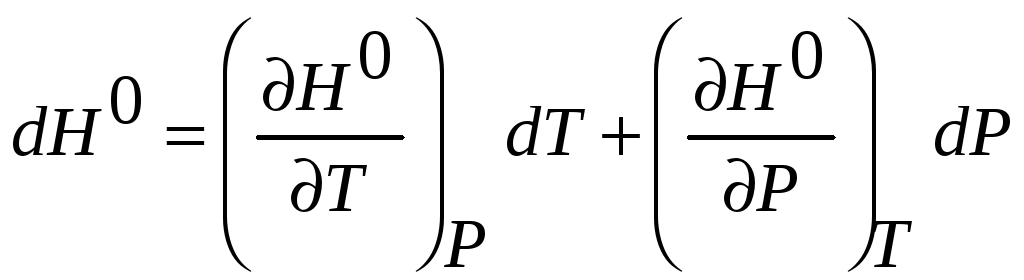 и
и
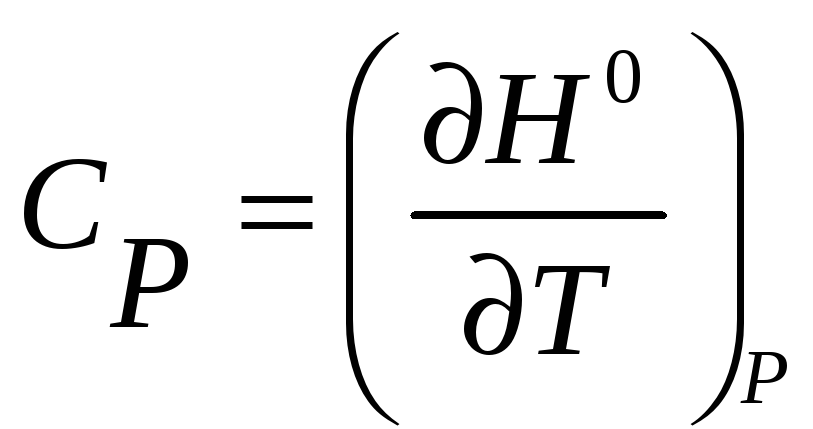 ,
при постоянном давлении
,
при постоянном давлении
![]()
Чтобы найти изменение энтальпии вещества
между 298К и T необходимо
проинтегрировать эту функцию в границах
от 298К до T . Тогда
получим
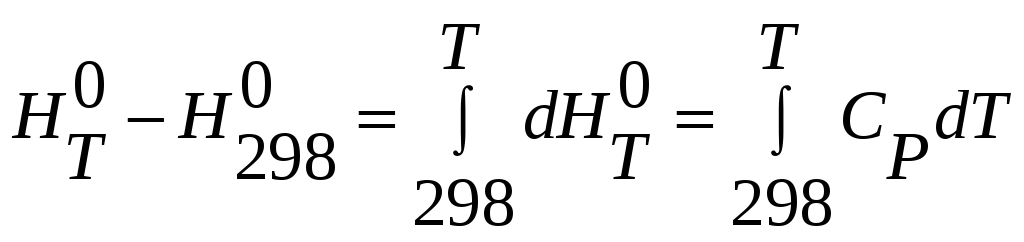
Задача
Найти изменение энтальпии реакции при 1000К для
MnSiO3(тв.,1000К)=MnO(тв.,1000К)+SiO2(кварц,1000К). Необходимо найти изменение энтальпии вызванное изменением температуры реагентов.
Решение
1) MnSiO3(тв.,298К)=MnO(тв.,298К)+SiO2(кварц,298К)
![]()
Находим изменение энтальпии реагентов
2) MnO(тв.,298) =
MnO(тв.,1000К)
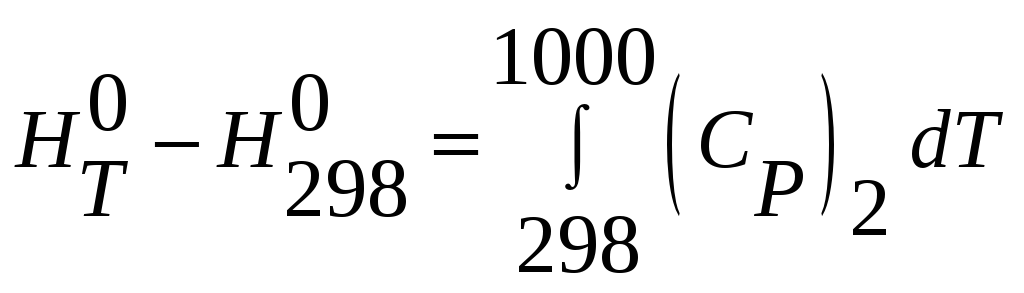 .
.
3) SiO2(кварц,298К) =
SiO2(кварц,1000К)
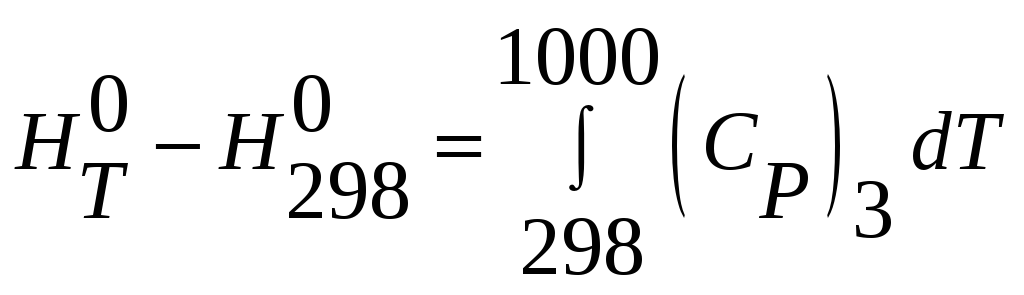
Находим изменение энтальпии продукта
4) MnSiO3(тв.,1000К)
= MnSiO3(тв.,298К)
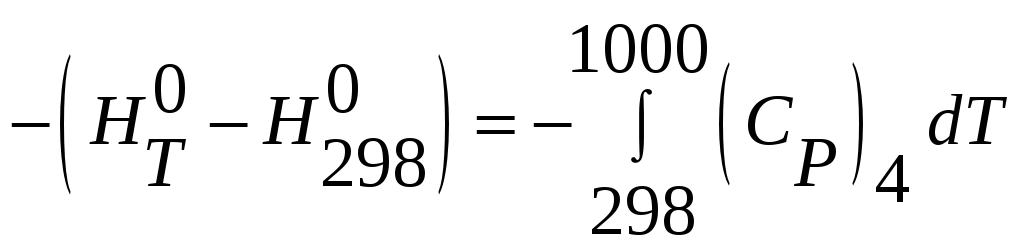
Алгебраически суммируя реакции, получим
температурную зависимость энтальпии
реакции
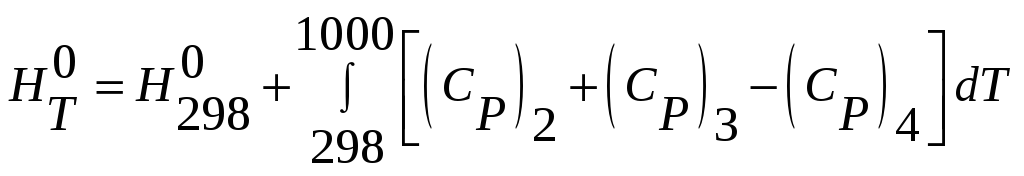
Или подставив эмпирическую зависимость
теплоемкости веществ от температуры
получим
![]() ,
,
где
![]()
Во многих случаях один или несколько компонентов реакции в интервале температур между 298К и температурой эксперимента претерпевают фазовые изменения. Если это имеет место, то для расчета между 298 и температурой превращения и более высокой температурой используется теплоемкость низкотемпературной фазы, а между температурой превращения и более высокой температурой используется теплоемкость высокотемпературной модификации. При вычислении энтальпии в этом случае необходимо не забыть и учесть изменение энтальпии фазового превращения при температуре превращения (скрытой теплоты превращения).
Пример
Вычислить изменение энтальпии для следующей реакции
Ag(ж,1200) +1/2Cl2(г,1200,1атм) =AgCl(ж,1200)
В таблицах теплофизических справочников находим теплоту образовании AgCl(ж,298) в при стандартных условиях
Продукт реагент
1) Ag (тв,298)
+1/2Cl2(г,298,1атм)
=AgCl(тв,298)
![]()
2) AgCl(тв,298)= AgCl(тв,Tпл)
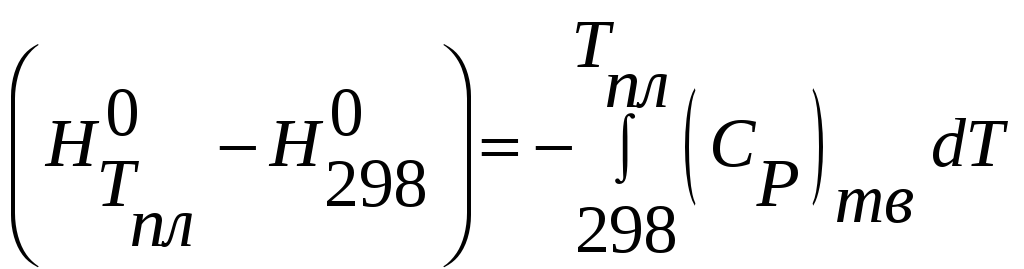
3) AgCl(тв,Tпл)=
AgCl(ж,Tпл)
![]()
4) AgCl(ж,Tпл)=
AgCl(ж,1200)

5) 1/2Cl2(г,1200,1атм)
=1/2Cl2(г,298,1атм)
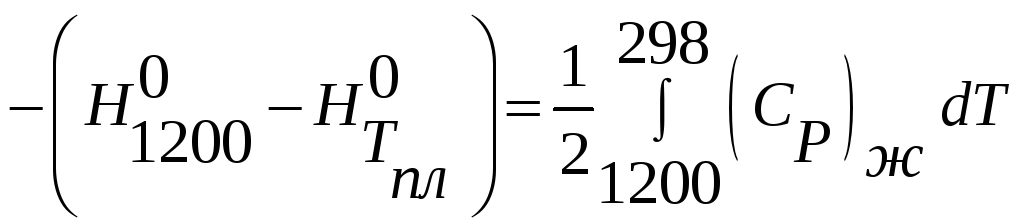
6) Ag (тв, Tпл)
= Ag (тв,298)

7) AgCl(ж,Tпл)
= AgCl(тв,Tпл)
![]()
8) AgCl(ж,1200) =
AgCl(тв,Tпл)
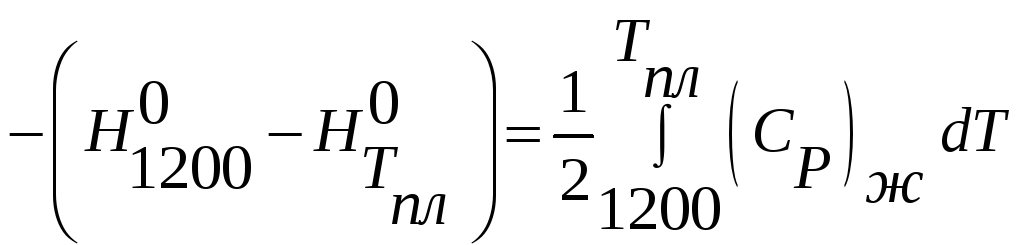
Суммируя (1-8) и соответствующие им тепловые изменения, получаем энтальпию требуемой реакции, указанную в условии задачи.
Второй закон термодинамики определяет направление химических реакций. Знак изменения энтальпии реакции для этого недостаточен.
Если рассмотреть реакции Sn(белое,298)=Sn(серое,298)
При этой реакции выделяется 2,09![]() .
Это означает, что в более низком
энергетическом состоянии находится
серое олово. Но найдено, что при T=298К
устойчиво белое олово.
.
Это означает, что в более низком
энергетическом состоянии находится
серое олово. Но найдено, что при T=298К
устойчиво белое олово.
Для предсказания устойчивости нужен
другой критерий. Таким критерием
оказывается функция называемая
энтропией.
![]() Для
обратимого процесса, в котором система
поглощает бесконечно малое количество
теплоты.
Для
обратимого процесса, в котором система
поглощает бесконечно малое количество
теплоты.
![]() - не является функцией состояния, но
- не является функцией состояния, но
![]() функция состояния. Это можно показать
для идеального газа, если использовать
первый закон термодинамики к нему.
функция состояния. Это можно показать
для идеального газа, если использовать
первый закон термодинамики к нему.
Уравнение состояния для идеального
газа
PV=RT
Первый
закон в дифференциальной форме
![]() выразим
выразим
![]()
![]()
Для идеального газа и уравнения состояния следует, что при постоянном T
![]() ,
,
![]() ,
,
![]()
![]() .
.
![]() - полный дифференциал. Поделим на T
обе части уравнения
- полный дифференциал. Поделим на T
обе части уравнения
![]() .
Правая часто уравнения представляет
собой полный дифференциал следовательно
и лева часть является полным дифференциалом
.
Правая часто уравнения представляет
собой полный дифференциал следовательно
и лева часть является полным дифференциалом
