
Неидеальный вклад в энтропию смешения
Если имеет место корреляция во взаимном
размещении атомов, то есть вероятность
нахождения атома данного компонента
зависит от того, атомы каких компонентов
располагаются в окрестных местах, то
количество возможных конфигураций
уменьшается. Некоторые из конфигураций
становятся, как бы запрещенными и должны
быть исключены из
![]() .
К “запрету” определенных конфигураций
приводит неравноценность мест, в
частности ближний и дальний порядок.
Введем формальноY–
число “запрещенных” конфигураций.
Тогда, вместо
.
К “запрету” определенных конфигураций
приводит неравноценность мест, в
частности ближний и дальний порядок.
Введем формальноY–
число “запрещенных” конфигураций.
Тогда, вместо![]() будем иметь
будем иметь![]() и далее
и далее![]() ,
где
,
где![]() - вклад в конфигурационную энтропию
обусловленный ближним и дальним порядком
или корреляцией.
- вклад в конфигурационную энтропию
обусловленный ближним и дальним порядком
или корреляцией.
При этом всегда
![]() ,
в то время как
,
в то время как![]()
Поэтому всякое отклонение от идеального
беспорядка дает в конфигурационную
энтропию раствора аддитивный отрицательный
вклад, Полная энтропия системы представится
как
![]() (20).
(20).
Соответственно и энтропию смешения
можно представить в виде суммы аналогичных
вкладов. Из (17) видно, что
![]() отTне зависит, но
существенно зависит от температуры
отTне зависит, но
существенно зависит от температуры![]() .
Меняется колебательный спектр и меняется
колебательный беспорядок. Таким образом,
неидеальный вклад в энтропию смешения
раствора представлен суммой
.
Меняется колебательный спектр и меняется
колебательный беспорядок. Таким образом,
неидеальный вклад в энтропию смешения
раствора представлен суммой![]() (21)
является температурно-зависимым
вкладом.
(21)
является температурно-зависимым
вкладом.
Тогда энтропию смешения можно записать
в виде
![]() (22)
(22)
Растворы с идеальной энтропией смешения
Опыт и модельные соображения показывают,
что при неограниченном повышении
температуры
![]() и
и![]() приближаются к нулю. Для ряда растворов
при достаточно высоких температурах
приближаются к нулю. Для ряда растворов
при достаточно высоких температурах![]() ,
,![]() экспериментально
неотличимы от нуля или же отличаются
незначительно. Это приводит к представлению
о растворах с идеальной энтропией
смешения
экспериментально
неотличимы от нуля или же отличаются
незначительно. Это приводит к представлению
о растворах с идеальной энтропией
смешения![]()
![]()
Для таких растворов
![]() (23)
(23)
![]() (24)
(24)
Растворы с идеальной энтропией обладают следующими свойствами.
Поскольку
 не зависит отT, то
не зависит отT, то
Из выражения, что у раствора с идеальной энтропией
 ,
т.е. энтальпия смешения не зависит от
температуры.
,
т.е. энтальпия смешения не зависит от
температуры.Поскольку
 не
зависит от давления, то
не
зависит от давления, то ,
и следовательно, объемный не зависит
от температуры.
,
и следовательно, объемный не зависит
от температуры.Соотношение типа правила Неймана-Коппа выполняются так же для изохорной теплоемкости
 .
Из этого следует
.
Из этого следует .
Следовательно энергия смешения при
изохорном смешении не зависит от
температуры.
.
Следовательно энергия смешения при
изохорном смешении не зависит от
температуры.
Докажем, что если энтропия смешения
одного из компонентов идеальна, то и
энтропия смешения любого другого
компонента идеальна, то есть
![]() и, следовательно, полная энтропия
смешения идеальна
и, следовательно, полная энтропия
смешения идеальна![]()
Для доказательства используем равенство
между производными первого типа вдоль
лучей, выходящих из вершин.
 (23)
(23)

Тогда , но из(23)
 (24)
(24)
Интегрируя (24) при фиксированных![]() ,
получим
,
получим![]() ,
где
,
где![]() -
постоянная интегрирования, которую
определяем при
-
постоянная интегрирования, которую
определяем при![]() .
.![]() .
Отсюда
.
Отсюда![]() и окончательно
и окончательно![]()
Идеальные растворы
Многие реальные растворы при достаточно
высокой температуре приближаются к
такому поведению, которое характеризуется
одновременным выполнением условий
![]() ,
,![]() ,
(25)
или
,
(25)
или![]() ,
,![]()
Растворы, для которых эти условия выполняются, называются идеальными. Для идеальных растворов
![]() ;
;![]()
Если раствор идеален в отношении одного из компонентов, то он идеален и в отношении любого другого компонента и идеален в целом.
Идеальные растворы обладают теми же
свойствами, что и атермические растворы
![]() ,
,![]() ,
, .
.
Предельные значения мольных парциальных функций.
Из
![]() следует
следует .
.
Из (23) следует

Такими свойствами обладают, однако, не
все мольные парциальные функции. Такие
функции
![]() ,
,![]() ,
,![]() при
при![]() сохраняют конечные значения. К такому
выводу приводят простые соображения.
Их удобно излагать в терминах атомных
парциальных функций
сохраняют конечные значения. К такому
выводу приводят простые соображения.
Их удобно излагать в терминах атомных
парциальных функций ,
, и т.д.
и т.д.
Например, изменение внутренней энергии
раствора u. При
добавлении к нему атомаi-го
компонента изменение внутренней энергии
равно .
Эта величина очевидно мала по сравнению
сu.
.
Эта величина очевидно мала по сравнению
сu. Поэтому
Поэтому![]() не может принимать бесконечно большое
знасение при предельном разбавлении
растворов
не может принимать бесконечно большое
знасение при предельном разбавлении
растворов![]() .
.
То же можно сказать и об изменении
объема .
.
При добавлении первых атомов i-го
компонента в раствор вероятность их
взаимодействия друг с другом пренебрежимо
мала. Поэтому при достаточно малых![]() величины
величины![]() ,
,![]() ,
,![]() должны
быть линейными функциями концентрации.
Линейная экстраполяция этих функций к
должны
быть линейными функциями концентрации.
Линейная экстраполяция этих функций к![]() дает
поэтому конечные значения
дает
поэтому конечные значения ,
, ,
, .
Однако по иному ведет себя идеальная
энтропия смешения. Рассмотрим наиболее
простой случай образования двухкомпонентного
раствора.
.
Однако по иному ведет себя идеальная
энтропия смешения. Рассмотрим наиболее
простой случай образования двухкомпонентного
раствора.
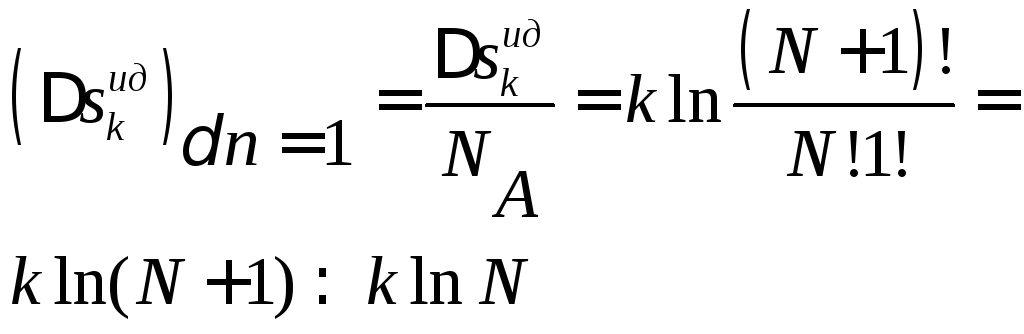
Хотя
![]() и мал по сравнению сN,
но при
и мал по сравнению сN,
но при![]() и
и![]() .
Поэтому для макроскопических систем
.
Поэтому для макроскопических систем оказывается большой величиной. При
добавлении двух атомов компонентаi
к чистому веществу
оказывается большой величиной. При
добавлении двух атомов компонентаi
к чистому веществу
Добавление каждого последующего атома
вызывает существенно меньшие изменения
![]()
