
veterenari 83
.pdfвмістом ГПЛ (ґ = 0,6659), СОД і ДК та МДА (ґ = 0,828 і 0,875 відповідно), а також між ГПО та ГПЛ (ґ = 0,696), ГПО і ДК та МДА (ґ = 0,855 і 0,837).
СПИСОК ЛІТЕРАТУРИ
1.Перекисное окисление липидов и эндогенная интоксикация у животных / С.С. Абрамов, А.А. Белко, А.А. Мацинович [и др.] – Витебск: УО ВГАВМ, 2006. – 208 с.
2.Кармолиев Р.Х. Свободнорадикальная патология в этиопатогенезе болезней животных / Р.Х. Кармолиев // Ветеринария. – 2006. – №7. – С. 36 – 40.
3.Борисевич В. Вільні радикали і перекисне окиснення ліпідів у патогенезі хвороб тварин / В. Борисевич, Б. Борисевич, В. Борисевич (молодший) // Вет. медицина України. – 2006. – №1. – С. 15–17.
4.The role of lipid peroxidation and antioxidants in oxidative modification of LDL / H. Esterbauer, J. Gebicki, H. Puhl, G. Jurgens // Free Radic. Biol. Med. – 1992. – Vol.13, №4. – P. 341–390.
5.Утворення активних форм кисню та система антиоксидантного захисту в організмі тварин / Г.Л. Антоняк, Н.О. Бабич, Л.І. Сологуб, В.В. Снітинський // Біологія тварин. – 2000. – Т.2, №2. – С. 34−43.
6.Beckman K.The free radical theory of aging matures / K. Beckman, B.N. Ames // Physiol. Rev. – 1998. – Vol. 78, № 2.
– P. 547–581.
7.Pre J. La lipoperoxidation / J. Pre // Patol. Biol. – 1991. – Vol. 39, №7. – P. 716 – 736.
8.Конторщикова К.Н. Перекисное окисление липидов в норме и патологии: Учеб. пособие. – Н.Новгород, 2000. −24 с.
9.Кармолиев Г.Х. Свободнорадикальная патология в этиопатогенезе болезней животных / Г.Х. Кармолиев // Ветеринария. − 2005.− № 4.− С. 42−47.
10.Droge W. Free radical in the physiological control of cell function / W. Droge // Phisiol.Rev. – 2002. – Vol. 82, № 1. – P. 47–95.
11.Ferritin: a cytophotective antioxidant strategy of endothelium / G. Balla, H.S. Jacob, J.M. Balla [et. al.] // J. Biol. Chem. – 1992. – V.25. – Р. 18048–18053.
12.Andrzejak R. Free radicals and their importance in medicine / R. Andrzejak, J.H. Goch, M. Jurga // Post. Hig. Med. Dosw. – 1995. – Vol.49, № 4. – P. 531–549.
13.Stocks J. The autoxidation of human red cell lipids induced by hydrogen peroxide / J. Stocks, T. Dormondy // Br. J. Haematol. – 1971. – V.20, № 1, – P. 95–111.
14.Корабейникова С.Н. Модификация определения ПОЛ в реакции с ТБК / С.Н. Корабейникова // Лаб. дело, 1989.
– №7. – С. 8–9.
15.Мирончик В.В. Способ определения гидроперекисей липидов в биологических тканях / В.В. Мирончик // Авторское свидетельство СССР №1084681А.
16.Стальная И.Д. В кн. “Современные методы в биохимии”; Под ред. В.И.Ореховича. – М.: Медицина, 1977. – С. 63–64.
17.Слипанюк О.В. Перекисне окиснення ліпідів і антиоксидантний статус у крові корів у останній місяць тільності / О.В. Слипанюк, Г.Л. Антоняк, Л.І. Сологуб // Біологія тварин. – Львів, 2000. – Т.2, №2. – С. 83–86.
18.Улько Л.Г. Антиоксидантний статус корів при кетозі / Л.Г. Улько // Вісник Сум. нац. аграр. ун-ту. – Серія “Вет. медицина”. – Вип. 7 (12). – Суми, 2004. – С. 151–153.
19.Улько Л.Г. Корегуюча дія вітаміну Е та селену на антиоксидантну систему організму корів при кетозі / Л.Г. Улько // Вісник Сум. нац. аграр. ун-ту. – Серія “Вет.медицина”. – Суми, 2005. – Вип. 1–2 (13–14). – С. 197–200.
Пероксидное окисление липидов и состояние антиоксидантной системы у коров при алиментарнодефицитной анемии
Л.Г. Сливинская, В.И. Левченко
У крови коров при алиментарно-дефицитной анемии обнаружено усиление процессов пероксидного окисления липидов, что характеризуется повышенным содержанием промежуточных и конечных продуктов (диеновых конъюгатов гидропероксидов липидов, малонового диальдегида). В процессе исследования установлено, что у коров при али- ментарно-дефицитной анемии в эритроцитах возрастает активность ферментов антиоксидантной системы СОД и ГПО. Определена прямая корелятивная зависимость между активностью СОД и содержанием ГПЛ, СОД, ДК и МДА, а также между ГПО и ГПЛ, ГПО ДК и МДА.
Ключевые слова: коровы, кровь, пероксидное окисление липидов, диеновые конъюгаты, гидропероксиды, малоновый диальдегид, глутатионпероксидаза эритроцитов, супероксиддисмутаза.
Lipid peroxidation and state of antioxidative system in cows with alimentary-deficientis anemia L. Slivinska, V. Levchenko
Was discovered intensification processes of lipid peroxidation in cow’s blood with alimentary-deficientic anemia, that characterizied increase content of spacing and final product (dienyc conjugates, lipid hydroperoxidantes, malonyc dialdehydes). Was determinate increasing activity of antioxidative enzymes (SOD and GPO) in erythrocyties of cows with alimentarydeficientic anemia during investigation. Was determinated direct correlation between SOD and GPO activity, SOD and DC for MDA, between GPO and GPL, DC and MDA.
Key words: cows, blood, lipid peroxidates, dialdehydes, erythrocitic’s glutation peroxidase, superoxide dismutase.
101
УДК 636.09:616.98:615.371:[57.063.8:579.852.1]
УШКАЛОВ В.О., д-р вет. наук; МАЧУСЬКИЙ О.В., аспірант;
РОМАНЬКО М.Є., пров. наук. співроб.
Державний науково-контрольний інститут біотехнології і штамів мікроорганізмів, м.Київ
ГРУЗІНА Т.Г., стар. наук. співроб.; РЄЗНІЧЕНКО Л.С., наук. співроб.
Інститут біоколоїдної хімії ім. Ф.Д. Овчаренка, м. Київ
КОШЕЛЬНИК В.Г., заст. д-ра з виробництва; ЯКОВЛЄВА Л.М., заст. нач. цеху
Херсонське державне підприємство – біологічна фабрика
РЕЗУЛЬТАТИ КОМІСІЙНИХ ДОСЛІДЖЕНЬ ВАКЦИН ПРОТИ СИБІРКИ ТВАРИН ІЗ ШТАМУ BACILLUS ANTHRACIS STERNE 34F2
Наведено результати комісійних досліджень варіантів вакцини проти сибірки тварин із штаму Bacillus anthracis Sterne 34F2, виготовлених з додаванням та без додавання наночастинок золота. Отримані результати свідчать про безпечність та ефективність застосування препаратів.
Ключові слова: вакцина, сибірка, поживні середовища, імуногенність.
Ідея створення препаратів, застосуванням яких можливо досягнути несприйнятливості організму до інфекційних захворювань, з’явилася у людства в сиву давнину, але втілити її у життя вдалося лише в кінці ΧVΙΙΙ ст. Це була вакцина проти віспи. Через 85 років видатному французькому вченому Луї Пастеру вдалося «перемогти» другу хворобу – сибірку. В 1881 році він зі своїми співробітниками виготовив вакцини проти цього захворювання. Перші спроби щеплень проти сибірки 1880 року зробили, окремо один від одного, Chauveau та Toussaint. Значний внесок у розвиток цього напряму в науці зробили також Ценковський, Ланге, Sobernheim, Вишелгський, Безредка, Mazzuchi [1]. Bail ще в 1915 році помітив, що коли збудника антраксу культивувати на сироватковому середовищі за умов підвищеної температури, то утворюються якісь особини без капсули. Після 25-кратного пасажу на цих середовищах такі особини втрачали здатність утворювати капсулу не лише на поживних середовищах, а й в організмі мишей. М.Sterne в 1937 році отримав на 50% сироватковому агарі, в атмосфері CO2 (65%), безкапсульний імуногенний варіант 34F2, який було запропоновано для виготовлення вакцини. Вакцина зі штаму 34F2 нині застосовується для профілактичних щеплень проти сибірки в багатьох країнах світу [1].
В умовах сьогодення необхідність вивчення сибірки зумовлена значним поширенням її ґрунтових резервуарів та високою небезпекою для людей і тварин. Пріоритетними напрямами у стримуванні захворювання є своєчасне виявлення, облік та постійний контроль за стаціонарно неблагополучними пунктами, проведення профілактичних щеплень з метою формування несприйнятливого поголів’я тварин, а також розробка та впровадження у виробництво нових засобів для діагностики, профілактики та лікування сибірки [2].
Нами було проведено роботу щодо отримання та депонування в Національному центрі штамів мікроорганізмів вакцинного штаму Bacillus anthracis Sterne 34F2, вивчено його імуногенні властивості в лабораторних умовах. Наступним кроком є вивчення дії препаратів, виготовлених з його використанням, що містять частинки нанозолота.
Мета роботи – виготовлення та проведення комісійних досліджень лабораторних зразків вакцини проти сибірки тварин із штаму Bacillus anthracis Sterne 34F2 з частинками та без частинок нанозолота.
Матеріал і методи досліджень. Лабораторні зразки вакцини проти сибірки тварин із штаму Bacillus anthracis Sterne 34F2 з частинками та без частинок нанозолота виготовляли в умовах Державного науково-контрольного інституту біотехнології і штамів мікроорганізмів (ДНКІБШМ) в декілька етапів. Першим етапом було виготовлення матрового розплоду вакцинного штаму Bacillus anthracis Sterne 34F2, перевірка його на відсутність інволюційних форм сибіркового мікроба та контамінації сторонньою бактеріальною і грибною мікрофлорою, другим – накопичення бактеріальної маси мікроорганізму, третім – формування серій вакцин з частками та без часток нанозолота.
Виготовлення матрового розплоду проводили в рідкому поживному середовищі – бульйоні Хоттінгера (амінний азот 100-120 мг%, рН 7,4±0,2) та інкубацією в термостаті при 37±1оС протягом 24 год, контамінацію сторонньою бактеріальною і грибною мікрофлорою визначали згідно з ДСТУ 4483:2005.
102
Накопичення бактеріальної маси Bacillus anthracis Sterne 34F2 проводили на щільному поживному середовищі – агарі Хоттінгера (амінний азот 100-120 мг%, рН 7,4±0,2) та інкубацією в термостаті при 37±1оС упродовж 4-х діб. Отриману бактеріальну масу змивали зі щільного середовища стерильним фосфатно-буферним розчином та перевіряли на відсутність контамінації сторонньою бактеріальною й грибною мікрофлорою згідно з ДСТУ 4483:2005.
Під час формування серій використовували стерильний гліцерин на фосфатно-буферному розчині – для вакцини без наночасточок золота та стерильний гліцерин на фосфатно-буферному розчині – з наночасточками золота у співвідношенні в кінцевому продукті 1:8.
Наночастинки золота було отримано шляхом відновлення золотохлористоводневої кислоти цитратом натрію у присутності карбонату калію. Середній розмір частинок визначали методами лазерно-кореляційної спектрометрії (ЛКС) та трансмісійної електронної мікроскопії. Вимірювання проводили на лазерно-кореляційному спектрометрі Zetasizer-3 (“Malvern Instruments Ltd”, Великобританія).
Уроботі були використані біобезпечні наночастинки золота розміром 30,4±0,5 нм з концентрацією 19±2,0 мкг/мл. Біобезпечність наночастинок золота оцінювали шляхом визначення їх генотоксичності методом «ДНК-комет» (лужного гель-електрофорезу ізольованих клітин), рекомендованим Європейською комісією з оцінки ризиків застосування наноматеріалів.
Наступною частиною роботи було проведення комісійних міжвідомчих досліджень лабораторних зразків в умовах Херсонського державного підприємства – біологічна фабрика. Дослідження проводили згідно з «Методикою міжвідомчих комісійних досліджень вакцин проти сибірки тварин із штаму Sterne 34F2 (ДНКІБШМ)», розглянутою і схваленою на засіданні Науково-методичної комісії ДНКІБШМ 28 травня 2010 р., протокол № 3. Згідно з названою вище методикою зразки досліджували за наступними показниками: безпечність (нешкідливість), імуногенність, капсулоутворення, кількість життєздатних спор та контамінація сторонньою бактеріальною і грибною мікрофлорою.
Нешкідливість перевіряли на вівцях та кролях. Для дослідження кожної серії використовували двох овець та п’ять кролів для кожної групи, які раніше не були вакциновані проти сибірки. Вівцям
вводили підшкірно в ділянці середньої третини шиї подвійну рекомендовану до вакцинації дозу (1 см3 суспензії, що містить 12 млн спор); кролям – підшкірно в ділянці зовнішньої поверхні стегна
подвійну, рекомендовану до вакцинації дозу. Як контроль використовували тварин, яким замість вакцини вводили 2 см3 стерильного ізотонічного розчину натрію хлориду. За тваринами проводили постійнеспостереження упродовж 14 діб. Щодня виконували термометрію тварин.
Утварин до початку, а також на 1, 2, 3, 5, 7, 14, 21, 28, 35 та 45-у доби дослідження відбирали кров за наступними показниками: кількість еритроцитів та лейкоцитів – меланжерним методом у камері з сіткою Горяєва, вміст гемоглобіну – колориметричним [3].
Вакцину вважали нешкідливою, якщо:
- протягом періоду спостереження у овець були відсутні системні реакції, допускалась тимчасова місцева реакція на місці введення вакцини;
- протягом періоду спостереження кролі залишалися живими, допускалося незначне (субфебрильне) підвищення температури тіла протягом перших трьох діб.
Імуногенність визначали на морських свинках. Для дослідження використовували три групи тварин по 15 голів, раніше не вакцинованих проти сибірки.
Відповідно до вимог Єврофармакопеї 5.0: тваринам дослідної групи №1 вводили підшкірно в ділянці черева 6 млн спор (0,5 см3) вакцини проти сибірки тварин із штаму Sterne 34F2 (ДНКІБШМ) з наночастками золота; групи №2 – за тією ж схемою вводили вакцину без наночас-
ток золота; тварин групи №3 використовували як контроль, їм вводили підшкірно в ділянці черева 0,5 см3 стерильного 0,9% розчину натрію хлориду.
Спостереження проводили протягом 21 доби. Потім тварин, вакцинованих дослідними вакцинами, заражали 100 мінімальними летальними дозами (МЛД) штамуBacillus anthracis M-71 підшкірно в ділянці черева, контрольних – 10 МЛД. Спостерігали за тваринами протягом 10 діб. Згідно з вимогами Єврофармакопеї 5.0 та «Керівництва з виготовлення вакцини проти сибірки та емфізематозного карбункула» ФАО вакцину вважають імуногенною, якщо протягом 10 діб спостереження 12 з 15 вакцинованих морських свинок виживали, а 12 з 15 контрольних – гинули від сибірки.
Для визначення відсутності у вакцині капсульних форм сибірки проводили дослідження in vitro та in vivo. Для проведення дослідження in vitro виготовляли середовище ГКІ за загально-
103
прийнятою методикою. Для визначення капсулоутворення в 5 пробірок з середовищем ГКІ вносили по 1 см3 дослідної серії вакцини проти сибірки тварин із штаму Sterne 34F2 (ДНКІБШМ) з наночастками золота та в 5 пробірок – по 1 см3 дослідної серії вакцини без наночасток золота. Пробірки щільно закривали гумовими пробками та інкубували в термостаті при 37±1,0 оС упродовж 18 – 24 год. Після інкубації з мікробних культур, що виросли в середовищі ГКІ, виготовляли мазки на знежирених предметних скельцях, фіксували їх та фарбували за Міхіним і Романовським-Гімза.
Для проведення дослідження in vivo використовували білих мишей. Для цього 5 білим мишам вводили внутрішньочеревинно 1 см3 дослідної серії вакцини проти сибірки тварин із штаму Sterne 34F2 (ДНКІБШМ) з наночастками золота, іншим 5 – за тією ж схемою вакцину без наночасток золота. Спостереження проводили протягом 5 діб. З черевного ексудату та органів (печінка, селезінка, серце) мишей, що загинули, виготовляли на знежирених предметних скельцях маз- ки-відбитки, фіксували і фарбували за Міхіним та Романовським-Гімза.
Для визначення кількості життєздатних спор з вакцини робили шість послідовних десятинних розведень (від 10-1 до 10-6) у стерильному ізотонічному розчині натрію хлориду. Для приготування кожного розведення використовували окрему піпетку. Після ретельного перемішування з двох розведень (10-5 та 10-6), починаючи з останнього, стерильною піпеткою висівали по 0,1 см3 зависі спор на чашки Петрі з МПА. Для кожного розведення використовували по 3 чашки. Після рівномірного розподілу посівного матеріалу по поверхні МПА чашки поміщали в термостат догори дном для інкубації при 37±1,0 оС протягом 24 год. Після інкубації підраховували колонії, що виросли в кожному з розведень та знаходили середнє арифметичне для кожного з них. Далі проводили підрахунок кількості життєздатних спор в 1 см3 вакцини за загальноприйнятою формулою.
Визначення контамінації сторонньою бактеріальною та грибною мікрофлорою проводили згі-
дно з ДСТУ 4483:2005.
Результати досліджень та їх обговорення. Визначення нешкідливості. Результати термо-
метрії овець та кролів наведено в таблицях 1 і 2 та рисунках 1 і 2.
Таблиця 1 – Моніторинг температури тіла овець, ОС
№ |
Доба |
Група № 1 |
Група № 2 |
Контроль |
|
п/п |
(вакцина з нанозолотом) |
(вакцина без нанозолота) |
|||
|
|
||||
1 |
0 |
39,4±0,25 |
39,7±0,06 |
39,4±0,31 |
|
2 |
1-ша |
39,2±0,18 |
39,8±0,12 |
39,3±0,12 |
|
3 |
2-га |
39,4±0,06 |
39,6±0,06 |
39,6±0,31 |
|
4 |
6-та |
39,8±0,12 |
39,9±0,06 |
39,8±0,12 |
|
5 |
7-ма |
39,5±0,12 |
39,7±0,12 |
39,8±0,12 |
|
6 |
8-ма |
39,6±0,06 |
39,7±0,06 |
39,7±0,12 |
|
7 |
9-та |
39,2±0,12 |
39,6±0,25 |
39,6±0,25 |
|
8 |
10-та |
39,2±0,31 |
39,3±0,18 |
39,4±0,12 |
|
9 |
14-та |
39,3±0,12 |
39,5±0,06 |
39,3±0,37 |
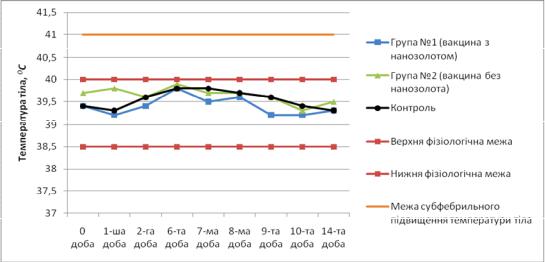
Рисунок 1 – Коливання температури тіла овець
104
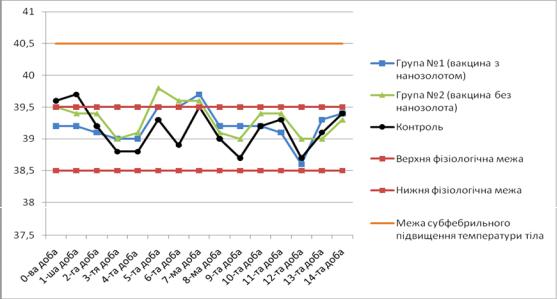
За результатами даних таблиць 1 і 2 було складено графіки температурних коливань – 1 і 2 відповідно.
Згідно з даними, наведеними у таблиці 1 та рисунку 1, спостерігали постійні коливання температури тіла дослідних тварин, але вони були в межах норми. Найвищі показники в дослідних групах виявляли на 5 – 7 добу, таку ж динаміку спостерігали і в контролі, що свідчить про можливість впливу на тварин екзогенних факторів (годівля, наявність води, режим мікроклімату). Протягом усього періоду спостереження тварини дослідних та контрольної груп були клінічно здоровими. Враховуючи вищевикладені дані, а також відсутність локальних реакцій на місцях введення зразків вакцин у дослідних тварин, можемо стверджувати, що препарати є безпечними.
Дані таблиці 2 та рисунка 2 вказують на підвищення температури тіла тварин груп 1 і 2 на 5 – 7 добу. При цьому у тварин групи № 2 гіпертермія почалася раніше на добу і тривала довше на 1 добу. У контрольних тварин протягом періоду спостереження коливання температури тіла знаходилося у фізіологічних межах, окрім перших двох діб, що ми пов’язуємо зі стресом від перегрупування тварин на початку проведення досліду.
Відхилення від норми, що спостерігалися в усіх групах, знаходилися в передбачуваних межах, регламентованих «Методикою міжвідомчих комісійних досліджень вакцин проти сибірки тварин із штаму Sterne 34F2 (ДНКІБШМ)».
Таблиця 2 – Моніторинг температури тіла кролів, ОС (n=15)
№ |
Доба |
Група № 1 |
Група № 2 |
Контроль |
|
п/п |
(вакцина з нанозолотом) |
(вакцина без нанозолота) |
|||
|
|
||||
1 |
0 |
39,2±0,23 |
39,5±0,12 |
39,6±0,25 |
|
2 |
1-ша |
39,2±0,28 |
39,4±0,15 |
39,7±0,12 |
|
3 |
2-га |
39,1±0,09 |
39,4±0,1 |
39,8±0,05 |
|
4 |
3-тя |
39,0±0,12 |
39,0±0,12 |
38,8±0,1 |
|
5 |
4-та |
39,0±0,18 |
39,1±0,18 |
38,8±0,07 |
|
6 |
5-та |
39,5±0,28 |
39,8±0,21 |
39,3±0,17 |
|
7 |
6-та |
39,5±0,47 |
39,6±0,25 |
38,9±0,08 |
|
8 |
7-ма |
39,7±0,34 |
39,6±0,15 |
39,5±0,11 |
|
9 |
8-ма |
39,2±0,25 |
39,1±0,12 |
39,0±0,07 |
|
10 |
9-та |
39,2±0,23 |
39,0±0,1 |
38,7±0,1 |
|
11 |
10-та |
39,2±0,05 |
39,4±0,07 |
39,2±0,11 |
|
12 |
11-та |
39,1±0,12 |
39,4±0,11 |
39,3±0,1 |
|
13 |
12-та |
38,6±0,28 |
39,0±0,05 |
38,7±0,23 |
|
14 |
13-та доба |
39,3±0,12 |
39,0±0,08 |
39,1±0,07 |
|
15 |
14-та доба |
39,4±0,05 |
39,3±0,15 |
39,4±0,12 |
Рисунок 2 – Коливання температури тіла у кролів
105
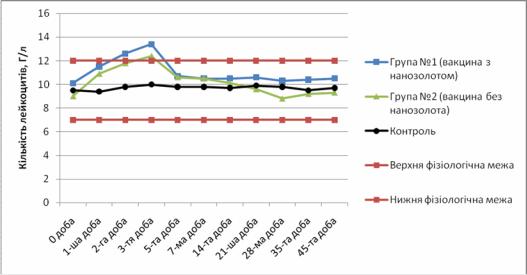
У таблиці 3 та на рисунку 3 відображено коливання кількості лейкоцитів у крові дослідних овець протягом періоду спостереження.
Таблиця 3 – Коливання кількості лейкоцитів у крові овець, Г/л
№ |
Доба |
Група № 1 |
Група № 2 |
Контроль |
|
п/п |
(вакцина з нанозолотом) |
(вакцина без нанозолота) |
|||
|
|
||||
1 |
0 |
10,1±0,2 |
9,0±0,06 |
9,5±0,1 |
|
2 |
1-ша |
11,5±0,2 |
10,9±0,06 |
9,4±0,2 |
|
3 |
2-га |
12,6±0,1 |
11,8±0,06 |
9,8±0,06 |
|
4 |
3-тя |
13,4±0,1 |
12,4±0,06 |
10,0±0,06 |
|
5 |
5-та |
10,7±0,06 |
10,6±0,1 |
9,8±0,06 |
|
6 |
7-ма |
10,5±0,06 |
10,5±0,2 |
9,8±0,05 |
|
7 |
14-та |
10,5±0,06 |
10,1±0,06 |
9,7±0,06 |
|
8 |
21-ша |
10,6±0,06 |
9,6±0,06 |
9,9±0,1 |
|
9 |
28-ма |
10,3±0,05 |
8,8±0,06 |
9,8±0,1 |
|
10 |
35-та |
10,4±0,06 |
9,2±0,06 |
9,5±0,1 |
|
11 |
45-та |
10,5±0,06 |
9,3±0,06 |
9,7±0,1 |
Рисунок 3 – Зміни кількості лейкоцитів у крові овець
У дослідних тварин групи № 1 спостерігали дводобове незначне підвищення кількості лейкоцитів на 2 та 3-у доби, у тварин групи № 2 незначний лейкоцитоз був лише на третю добу, у той час як у контрольних тварин коливання кількості лейкоцитів знаходилися у фізіологічних межах.
Таблиця 4 та рисунок 4 відображають коливання кількості еритроцитів у крові дослідних тварин протягом періоду спостереження.
Таблиця 4 – Коливання кількості еритроцитів у крові овець, Т/л
№ |
Доба |
Група № 1 |
Група № 2 |
Контроль |
|
п/п |
(вакцина з нанозолотом) |
(вакцина без нанозолота) |
|||
|
|
||||
1 |
0 доба |
12,1±0,06 |
12,9±0,2 |
11,4±0,1 |
|
2 |
1-ша доба |
11,4±0,3 |
12,3±0,3 |
11,2±0,1 |
|
3 |
2-га доба |
11,0±0,1 |
10,6±0,3 |
11,1±0,1 |
|
4 |
3-тя доба |
10,6±0,1 |
9,3±0,3 |
11,3±0,1 |
|
5 |
5-та доба |
10,7±0,06 |
9,6±0,2 |
11,3±0,1 |
|
6 |
7-ма доба |
11,4±0,1 |
10,1±0,2 |
11,4±0,1 |
|
7 |
14-та доба |
11,8±0,3 |
12,2±0,3 |
11,3±0,3 |
|
8 |
21-ша доба |
11,9±0,2 |
12,5±0,2 |
11,5±0,06 |
|
9 |
28-ма доба |
12,2±0,1 |
12,9±0,06 |
11,6±0,1 |
|
10 |
35-та доба |
11,9±0,06 |
12,9±0,2 |
11,4±0,1 |
|
11 |
45-та доба |
11,8±0,06 |
12,9±0,1 |
11,4±0,1 |
|
|
|
|
106 |
|
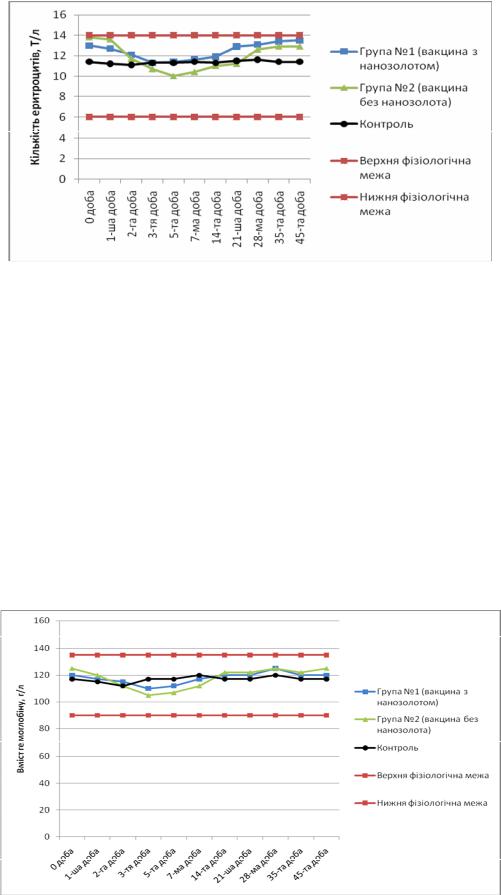
Рисунок 4 – Зміни кількості еритроцитів у крові овець
У тварин обох груп виявляли незначне зменшення кількості еритроцитів з першої до 14-ї доби, але ці зміни були у фізіологічних межах. У подальшому різниця була не вірогідною. У тварин контрольної групи спостерігали незначні коливання кількості еритроцитів у фізіологічних межах.
Дані, наведені в таблиці 5 та рисунку 5, відображають динаміку коливань вмісту гемоглобіну в крові овець.
Таблиця 5 – Коливання вмісту гемоглобіну в крові овець, г/л
№ |
Доба |
Група № 1 |
Група № 2 |
Контроль |
|
п/п |
(вакцина з нанозолотом) |
(вакцина без нанозолота) |
|||
|
|
||||
1 |
0 |
120±0,05 |
125±0,05 |
117±1,2 |
|
|
1-ша |
117±1,3 |
120±0,05 |
115±0,05 |
|
3 |
2-га |
115±0,05 |
112±1,3 |
112±1,2 |
|
4 |
3-тя |
110±0,05 |
105±3,1 |
117±1,2 |
|
5 |
5-та |
112±1,3 |
107±1,3 |
117±1,2 |
|
|
7-ма |
117±1,3 |
112±1,3 |
120±3,1 |
|
7 |
14-та |
120±3,1 |
122±1,3 |
117±4,3 |
|
8 |
21-ша |
120±0,05 |
122±1,3 |
117±1,2 |
|
9 |
28-ма |
125±0,05 |
125±0,05 |
120±3,1 |
|
10 |
35-та |
120±0,05 |
122±1,3 |
117±1,2 |
|
11 |
45-та |
120±0,05 |
125±0,05 |
117±1,2 |
Рисунок 5 – Коливання вмісту гемоглобіну в крові овець
107
Зменшення вмісту гемоглобіну у фізіологічних межах спостерігали у тварин обох дослідних груп на 3 – 7 доби, у той час як у тварин групи № 3 значних коливань протягом періоду спостереження не відмічено.
Результати визначення імуногенності зразків вакцин наведено в таблиці 6.
Таблиця 6 – Імуногенність лабораторних зразків вакцин (n=45)
№ |
Показник |
Група № 1 (вакцина |
Група № 2 (вакцина |
Група № 3 |
|
п/п |
з нанозолотом) |
без нанозолота) |
(контроль) |
||
|
|||||
|
|
|
|
|
|
1 |
Загальна кількість тварин, гол. |
15 |
15 |
15 |
|
2 |
Вакциновано тварин, гол. |
15 |
15 |
0 |
|
3 |
Заражено тварин, гол. |
10 |
13 |
15 |
|
4 |
Загинуло тварин, гол. |
1 |
2 |
15 |
|
5 |
Вижило після зараження тварин, гол. |
9 |
11 |
0 |
|
6 |
Відсоток захищеності |
90 |
84,6 |
0 |
Рівень захисту препарату з частинками нанозолота склав 90 %, без нанозолота – 84,6, що на 5,4 % нижче. Ці результати відповідають вимогам Методики та вказують на імуногенний ефект дослідних препаратів. Падіж п’яти тварин після вакцинації в групі №1, на нашу думку, пов'язаний з наявністю в ній великої кількості антигенного компонента. Очевидно, додавання наноаквахелатів у ветеринарні препарати має супроводжуватись зменшенням кількості діючої речовини.
Визначення капсулоутворення. Протягом першої доби білі миші в обох дослідних групах загинули. Проведено розтин тварин та виготовлено мазки-відбитки з черевного ексудату, печінки, селезінки та серця; мазки зафарбовано за Міхіним та Романовським-Гімза. Під час мікроскопії в зафарбованих мазках виявлено паличкоподібні безкапсульні мікроорганізми, розташовані поодиноко, попарно та короткими ланцюжками. У зафарбованих за Міхіним мазках, виготовлених з середовища ГКІ, спостерігали безкапсульні палички мікроорганізму Bac.anthracis Sterne 34F2, поєднані в довгі ланцюжки.
Визначення кількості життєздатних спор. Як видно з результатів, наведених у таблиці 7, кількість життєздатних спор в обох групах однакова.
Визначення контамінації сторонньою бактеріальною і грибною мікрофлорою. За результатами проведених досліджень встановлено, що зразки вакцин проти сибірки тварин із штаму Bac.anthracis Sterne 34F2 з частками нанозолота та без них, виготовлені в умовах ДНКІБШМ, не контаміновані сторонньою бактеріальною та грибною мікрофлорою.
Таблиця 7 – Кількість життєздатних спор, млн (n=5)
№ |
Група № 1 вакцина |
Група № 2 вакцина |
п/п |
з нанозолотом |
без нанозолота |
1 |
12,2 |
12,3 |
2 |
13,1 |
11,8 |
3 |
11,6 |
13,6 |
4 |
12,0 |
11,2 |
5 |
11,1 |
11,1 |
6 |
(M±m) 12±0,07 |
(M±m) 12±0,09 |
Висновки та перспективи подальших досліджень. 1. За результатами досліджень встановлено, що виготовлені препарати є нешкідливими, імуногенними та відповідають міжнародним вимогам.
2. Отримані результати дають підстави для проведення в подальшому масштабних польових досліджень виготовлених препаратів на цільових видах тварин.
СПИСОК ЛІТЕРАТУРИ
1.Колесов С.Г. Сибирская язва / С.Г. Колесов. – М.: Колос, 1976. – 287 с.
2.Ипатенко Н.Г. Сибирская язва / Н.Г. Ипатенко, В.А. Гарилов, В.С. Зелепукин. – М.: Колос, 1996 – 335 с.
3.Данилова Л.А. Справочник по лабораторным методам исследования // Л.А. Данилова. – М.: ПИТЕР, 2003 –
733 с.
108
Результаты комиссионных исследований вакцин против сибирской язвы из штамма Bacillus anthracis Sterne 34F2
В.А.Ушкалов, А.В.Мачуский,М.Е.Романько, Т.Г.Грузина,Л.С.Резниченко,В.Г.Кошельник, Л.М. Яковлева
Представлено результаты комиссионных исследований разных вариантов вакцины против сибирской язвы из штамма Bacillus anthracis Sterne 34F2, изготовленных с добавлением и без добавления наночастиц золота. Полученные результаты свидетельствуют о безопасности и эффективности использования данных препаратов.
Ключевые слова: вакцина, сибирская язва, питательные среды, иммуногенность.
The results of the commission research of anthrax spore vaccine, produced on Bacillus anthracis Sterne 34F2 strain V. Ushkalov, O. Machus’kyy, M. Roman’ko, T. Gruzina, L. Reznichenko, V. Koshelnik, L. Jakovleva
There are shown the results of the commition held research on the efficacy of different hinds of vaccines against Anthrax disease. The vaccines were made on the strain Bacillus anthracis Sterne 34F2 with and without adding the nonaparts of gold. The obtained results show the safety and efficacy of the tested products.
Key words: vaccine, anthrax, medium, potency.
УДК: 619:618:636.082.453
ХАРУТА Н.Г., аспірантка Науковий керівник – д-р с.-г. наук, професор ШЕРЕМЕТА В.І.
Національний університет біоресурсів і природокористування
ВИЖИВАНІСТЬ СПЕРМИ КНУРІВ ЗА ВИКОРИСТАННЯ ДИСТИЛЬОВАНОЇ ВОДИ З РІЗНИМИ РН ТА РОЗРІДЖУВАЧАМИ
Установлено, що у разі застосування дистильованої води з рН 6 для розрідження сперми виживаність сперміїв буде кращою, ніж за використання води з рН 5.
Ключові слова: дистильована вода, середовище, капацитація, акросома.
Штучне осіменіння свиней є одним з найпоширеніших методів розмноження та селекції [1]. Єфективність штучного осіменіння залежить від таких важливих складових, як якість сперми кнура, умови роботи зі спермою in vitro від її отримання до осіменіння та здоров’я свиноматки, яку осіменяють. Розрідження сперми, яка використовується в подальшому для осіменіння, застосовують не тільки для збільшення об’єму еякуляту, а й для створення середовища, що забезпечує тривалу виживаність та збереженість запліднювальної здатності сперміїв поза організмом. Збільшення виживаності сперміїв можливе за сповільнення швидкості руху сперміїв, зниження інтенсивності обмінних процесів та захисту від несприятливого впливу секретів додаткових статевих залоз і мікроорганізмів.
Вагомий вклад у розвиток цієї галузі біотехнології одним з перших зробив І.І. Іванов, який вже на початку ХХ ст. завдяки своїм численним дослідженням розробив основи розрідження і зберігання сперми поза організмом. Роботами І.В. Смирнова була обґрунтована можливість тривалого зберігання сперми in vitro шляхом кріоконсервації. Вже в 30-х роках минулого століття почався бурхливий розвиток штучного осіменіння, що пов’язано зі створенням приладів для отримання сперми від плідників, проведенням дослідів з розрідження сперми та розробленням рецептів середовищ. Одним з першим вчених, який запропонував рецепт розріджувача для різних видів тварин, був В.К. Милованов. Найкращими з них виявилися глюкозо-сульфатні та глюкозотартратні, що показали добрі результати особливо на тих тваринах, у спермі яких є багато додаткових статевих залоз – кнурі, жеребці, собаки, кролі [2].
До 1939 року існуючі середовища використовували головним чином для збільшення рідкої частини сперми, тому що спермії не мали великої виживаності. Відкриття в 1939 році П. Філіпсом цінності жовтка курячого яйця дозволило збільшити виживаність сперміїв бугая до 5 разів [3]. Багато науковців того часу підтвердили ефективність його дії. Подальші дослідження виявили, що сперма кнурів особливо чутлива до охолодження нижче 15°С [4], а тому в 1963 році М.Т. Плішком та А.П. Волосевичем були запропоновані розріджувачі з хелатоном. Потім на їх основі були розроблені та запропоновані: ГХЦ та ГХУЖ, ГБЛ, ГЦХЖ, ГХЦС-8, ГБУ-9 [5].
Головними компонентами для сучасних середовищ є такі:
-глюкоза, яка є енергетичним компонентом для сперміїв та попереджує втрату ними електричного заряду і аглютинації;
-цитрат натрію та хлорид калію, які попереджують проникність оболонок сперміїв [6];
109
-трилон Б використовується в середовищах для зберігання за охолодження, в основному впливає на проникнення через плазматичну мембрану продуктів обміну [7] та попереджує початок капацитації і зміни акросоми;
-антиоксиданти, які продовжують життя сперміїв зі збереженням запліднювальної здатності;
-речовини, які допомагають стабілізувати мембрану сперміїв під час охолодження та попереджують капацитацію [8];
-протимікробні препарати, які затримують розвиток мікроорганізмів у спермі, що можуть потрапити в неї за отримання, розрідження та зберігання.
За удосконалення виживаності та запліднювальної здатності розрідженої сперми звертають увагу не тільки на компоненти середовища, а й на якість дистильованої води, яка використовується при цьому, адже вона може мати різне рН середовища, яке потім впливає на сперміїв. Згідно з ГОСТом 6709 – 72 та зі змінами до нього від 1985 і 1990 років [9], дистильована вода повинна відповідати таким рН параметрам: 5,4-6,6.
Але, як показали попередні дослідження, рН води з різних дистиляторів може мати різні показники, які коливаються від 6,1 до 5,0 у перший день після отримання з дистилятора, і під впли-
вом різних компонентів води протягом певного часу змінюються. В ідеально чистій дистильованій воді іони [Н+] та [ОН+] будуть зрівноважувати один одного, і реакція буде нейтральною (рН=7). В умовах виробництва найчастіше використовується дистильована вода з різним рН, яке навіть може не відповідати ГОСТу.
Саме тому метою роботи було дослідити виживаність сперми кнура за розрідження різними середовищами та використання при цьому дистильованої води з неоднаковим водневим показником.
Матеріал і методи досліджень. Роботу виконували на базі ННДЦ Білоцерківського національного аграрного університету. Для дослідження була взята сперма кнура породи велика біла та 2 середовища („Біоконсан” та „BTS-TOP”) і дистильована вода з рН 5 і 6. Дистильовану воду отримували з дистиляторів 2-х кафедр факультету ветеринарної медицини. Відібрані проби води
уоб’ємі 50 см3 розміщували у стерильні лабораторні пластикові стаканчики з кришкою, об’ємом 100 см3. Стаканчики з герметично закритою дистильованою водою зберігали при 20°С у затемненій скляній шафі.
Дослідження проводили за вимогами ДСТУ ISO 3696:2003 [7], підігріваючи воду у біотермостаті для розморожування сперми. Контроль температури здійснювали автоматично рН-метром. Визначали рН у день отримання дистильованої води. Дослідження рН дистильованої води проводили на рН-метрі моделі НАNNA pH 211. Для визначення водневого показника здійснювали калібрування показників рН-метра, застосовуючи буферні розчини з різними значеннями рН, що покривають проміжок від 4,0 до 8,0. Після цього занурювали електроди у пластикові стаканчики з досліджуваною водою, перевіряли температуру та вимірювали показник рН. З кожного дистилятора досліджували три паралельні проби.
Сперму отримували мануальним методом за допомогою спермоприймача. Після отримання проводили її оцінку та розрідження. Попередньо відважили необхідну концентрацію середовищ. Розріджували отриману сперму у співвідношенні 1 : 3. Розрідження проводили за такою схемою: підігрівали дистильовану воду до температури 35-37 °С і змішували з середовищем. Перед розрідженням сперми температуру середовища доводили до температури отриманої сперми – вона повинна збігатися з температурою сперми. Перевіряли рухливість до і після розрідження сперми. Через 20 хв розріджену сперму ставили в кліматбокс, де вона зберігалася за температури 17°С. Рухливість перевіряли кожні 24 год, до припинення прямолінійно-поступального руху та загибелі сперміїв. Активність руху сперміїв з охолодженої сперми оцінювали за температури 40°С, причому нагрівали до такої температури тільки досліджувану краплю, а не всю пробірку зі спермою. Сперму розмішували похитуванням пробірки, потім чистою скляною паличкою наносили невелику краплю на предметне скло, яке поміщали на столик мікроскопа, що знаходиться в термостаті. За нагрівання спермії починали рухатись не відразу, тому спостереження проводили 1–2 хв, поки спермії не проявляли найбільшу активність. Всього було 12 проб.
Результати досліджень та їх обговорення. З даних таблиць 1 і 2 видно, що рухливість спер-
міїв кнура породи велика біла після отримання складала 9,0±0 балів. Після розрідження показник рухливості знизився на 1 бал.
110
