
- •Эффективные импульсно-периодические эксимерные лазеры
- •1. Введение
- •2. Кинетика
- •2.1 Эксимерные молекулы
- •2.2 Плазмо-химические реакции.
- •3.Упрощенная моделькинетики образования XeCl молекулы.
- •3. Система возбуждения.
- •3.1 Механизмы возбуждения эксимерных лазеров
- •3.2 Возбуждение эксимерного лазера элекронным пучком
- •3.3 Возбуждение зксимерного лазера разрядом
- •3.4 Общая характеристика систем предыонизации
- •3.5 Основные схемы возбуждения ээл
- •3.6 Использование lc-контура для возбужденияэлектроразрядных эксимерных лазеров
- •3.7 Описание схемы lc-инвертора
- •4. Системы прокачки рабочей смеси
- •5. Резонатор лазера
- •5.1 Формирование лазерного излучения
- •5.2 Формирование расходимости выходного излучения при использовании различных типов резонаторов
- •5.3 Формирование узкой спектральной линии излучения в селективных резонаторах, включающих в себя дифракционные решетки и эталоны Фабри-Перо
- •6. Экспериментальные приборы и методики измерений
- •6.1 Приборы и методы измерения
- •6.2 Погрешности измерений
- •6.3. Экспериментальные установки и их характеристики
- •7. Исследования формирования качественного излучения
- •7.1 Расходимость выходного излучения сформированного в плоско-параллельном резонаторе.
- •7.2 Формирование излучения с узкой спектральной линии в селективном резонаторе.
- •Литература
2. Кинетика
2.1 Эксимерные молекулы
Это молекулы, существующие только в возбужденном состоянии. Как известно, атомы благородных газов не образуют химических соединений. Это свойство объясняют тем, что атомы данного типа не имеют электрона на незаполненных оболочках, который мог бы составить пару электрону, принадлежащему другому атому, с противоположно направленным спином. Наличие подобной пары является одним из условий образования ковалентной химической связи, объясняющей существование стабильного химического соединения.
В случае, если атом благородного газа находится в возбужденном состоянии, данное препятствие снимается, поскольку при этом имеется электрон, занимающий одну из незаполненных оболочек атома. Этот электрон может, вообще говоря, составить пару своему собрату, имеющему противоположное направление спина и принадлежащему другому атому. В результате между атомами возникает взаимодействие, соответствующее притяжению, что открывает возможность образования молекулы, одним из атомов которой является атом благородного газа. Именно такая молекула и носит название эксимерной.
Эксимерная молекула, потенциальная энергия которой превышает энергию основного состояния, не может существовать бесконечно долго. Она распадается за времена порядка нескольких наносекунд, излучая световой квант. Под действием отталкивания атомы быстро разлетаются в противоположных направлениях.
Несмотря на непродолжительное время жизни, эксимерная молекула имеет все признаки химического соединения. Она обладает колебательными и вращательными степенями свободы, которые характеризуются соответствующими системами энергетических состояний. Она способна вступать в химические реакции. Однако главная особенность эксимерных молекул состоит в том, что они представляют собой готовую активную среду, которая может быть использована в качестве основы для создания мощного лазера. Лазеры такого типа, получившие название эксимерных, составляют группу наиболее интенсивных газовых лазеров ультрафиолетового диапазона.
Возможность создания лазеров на переходах эксимерных молекул основана на специфическом расположении кривых потенциальной энергии основного и возбужденного состояний молекулы, образующихся при сближении атомов.
Рис.
1. Характерные термы эксимерной
молекулы, благоприятные для
работы эксимерного лазера.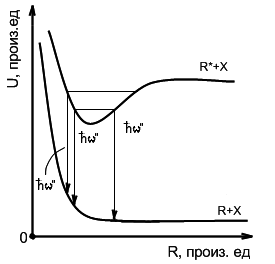

Рис. 2. Энергетические уровни молекулы XeCl*.
Верхний терм лазерных переходов соответствует возбужденной молекуле с ионным типом связи. Такая молекула образуется при сближении иона инертного газа и отрицательного иона галогена. На далеких расстояниях взаимодействие отвечает кулоновскому притяжению, которое при дальнейшем сближении сменяется обменным отталкиванием электронов и кулоновским отталкиванием ядер.
2.2 Плазмо-химические реакции.
Исследование кинетики реакций в газах на галогенидах инертных газов довольно сложно. В кинетических процессах участвует много частиц: атомы и молекулы в основном и возбужденном состоянии, несколько сортов ионов, а также большое число возбужденных атомов и молекул. С целью упрощения рассмотрения кинетики реакций происходящих в эсимерных лазерах, разделим все реакции, происходящие в плазме на 8 групп, рассмотрим лишь наиболее важные из них. При этом некоторые реакции могут принадлежать не только одной группе, а двум и более. Первыe три группы составляют:
I. Первичные реакции с электронами, например:
e + He → He+ +e +e (1)
e + Xe → Xe* + e (2)
e + HCl → HCl(v) +e (3)
II. Реакции между частицами буферного газа, например
He* + He + He → He2 * + He (4)
He+ + 2He → He2+ + He (5)
Ne* + Ne + Ne → Ne2* + Ne (6)
III. Реакции с HCl, например:
e + HCl → HCl(v) +e (7)
e + HCl → H + Cl- (8)
e + HCl → HCl+ +2e (9)
IV. Реакции с потерями электронов и положительно заряженных ионов:
а) диссоциативная рекомбинация:
HeXe+ +e → Xe* + He (10)
б) тройная рекомбинация, например:
He2+ + e + He → He* + 2He (11)
в) прилипание электрона к нейтральным частицам, например:
e + HCl → H + Cl- (12)
Cl +e + Ne → Cl- +e + Ne (13)
отрицательный и положительный ионы могут рекомбинировать как бинарно (перезарядка):
Cl- + Xe+ → Xe* + Cl (14)
так и в тройных соударениях:
Xe+ + Cl- + Ne → XeCl* + Ne (15)
Реакции (12) и (13) протекают достаточно быстро. Следует заметить необычайную зависимость скорости этих реакций от давления. При давлении ниже одной атмосферы константа скорости этих реакций имеет достаточно большое значение. Реакция типа (13) вносит существенный вклад в образование возбужденных молекул галогенидов инертных газов. Это предположение основано на высоких КПД лазеров, наблюдаемых на молекулах ХеСl. Теоретическим обоснаванием эффективности такого процесса является то, что кривая кулоновской потенциальной энергии вдоль которой происходит движение ионов, пересекает большую часть ковалентных кривых на довольно больших межьядерных расстояниях. Это затрудняет переход электрона от отрицательного к положительному иону, препятствуя образованию ковалентной связи.
V. Реакции, в результате которых образуются молекулы ХеСl* . Помимо реакции (14) наиболее важными являются реакции:
Xe* + HCl(v) → XeCl* + H (16)
NeXe* + Cl- → XeCl* + Nе (17)
Реакциия (13) наиболее существенна, и основной канал образования ХеСl* проходит именно через нее. Данная реакция аналогична взаимодействию между ионом щелочного металла и ионом галогена.
Реакция (15) протекает только в присутсвии неона либо при использование его как буферного газа. Посредством данной реакции образуется 30% молекул ХеСl* и неудивительно, что замена гелия на неон вкачестве буферного газа повышает энергию в импульсе реальных устройств почти вдвое.
VI. Реакции, обуславливающие процессы тушения, протекающие в плазме. К ним, например, относятся реакции:
XeCl* + He → Xe + He + Cl (18)
XeCl* + Xe → 2Xe + Cl (19)
XeCl* + HCl(v) → Xe + HCl + Cl (20)
Наиболее важной, по крайней мере, при низком давлении, является прямое тушение в столкновениях с галогеносодержащими молекулами (18). Константа скорости такой реакции достаточно высока, т. е. тушение происходит при каждом столкновении. Для типичной газовой смеси время тушения 10 нс. Столь быстрое тушение электронно-возбужденных молекул наблюдается давольно часто и связано с передачей энергии тушащей молекуле.
VII.Реакции с излучением. Вот некоторые из них:
XeCl* + hν → Xe + 2hν (21)
Cl- + hν → Cl +e (22)
He* + hν → He+ + e (23)
HeXe + hν → Xe+ + He (24)
VIII.Реакции с примесями, например:
HCl + O2 → 4ClO2 + 2H2O (25)
Xe* + O2 → XeO (26)
Xe* + H2O →XeO + H2 (27)
Они обусловлены тем, что несмотря на строгие требования к чистоте газов, газовая смесь может содержать до 1% О2,N2 H2,CO2,H2O. Вода является главной вредной примесью в газовых смесях эксимерных лазеров.
Кроме вышеприведенных реакций в плазме протекает еще значительное количество побочных, которые в основном уводят энергию из основного канала. Все полезные возбужденные состояния достаточно короткоживущие, дополнительно тушатся при взаимных столкновениях и столкновениях с другими образованиями в плазме. Тем не менее, можно считать, что основные реакции, приводящие к образованию возбужденных галогенидов инертных газов, протекают достаточно быстро и эффективно. Учитывая все эти процессы, а так же потери в схеме возбуждения, можно оценить, что в реальных устройствах в образованиe молекул ХеСl, в лучшем случае вкладывается только 8-10% энергии, запасенной первоначально в накопительных емкостях.
