
физиология
.pdf21
Работа № 7. Определение порогов обоняния
Цель: Определить пороги ощущения запаха различных веществ.
Вопросы для подготовки к работе:
1.Строение обонятельного анализатора.
2.Механизмы хеморецепции запахов.
3.Механизмы высокой чувствительности животных многих видов к запахам.
Материальное обеспечение: флаконы с 0,0001%, 0,001%, 0,01% и 1% растворами камфары; 0,0001%, 0,001%, 01%, 1%, 2% и 3% растворами этилового спирта; 0,0001%, 0,001%, 0,01%, 0,1% и 1% растворами, испытуемый.
Ход работы:
1.Открыть пробку флакончика с пахучим веществом, поднести флакончик к ноздрям и сделают несколько «нюхательных» вдохов.
2.Указанную манипуляцию проделать для всех растворов, начиная с наименьших концентраций.
3.Установить наименьшую концентрацию раствора каждого вещества, вызывающего ощущение запаха.
4.Записать наблюдения, сделать вывод.
22
РАЗДЕЛ IV. СИСТЕМА КРОВИ*
Работа № 1. Взятие крови у животных, получение плазмы и сыворотки крови
Цель: освоить методики получения крови у животных для лабораторных исследований.
Вопросы для подготовки к работе:
1.Состав крови.
2.Отличия плазмы крови от сыворотки.
3.Правила асептики и антисептики при выполнении пункции крупных кровеносных сосудов.
4.Величины общего количества крови в организме и допустимые объемы взятия крови.
Материальное обеспечение: ножницы, спиртовые тампоны, иглы, шприцы, пробирки, гепарин или раствор цитрата натрия, гемостатический жгут, стерильные одноразовые вакуумные пробирки нужного с держателями и двусторонними иглами для них.
Ход работы:
Получение больших количеств крови у лошадей, крупного и мелкого рогатого скота:
1.Зафиксировать животное
2.Выбрить или выстричь небольшой участок шерстного покрова на границе верхней и средней трети шеи над яремным желобом.
3.Обработать место пункции спиртовым тампоном.
4.Большим пальцем одной руки сдавить яремную вену ниже точки прокола кожи. Ту же манипуляцию может проводить помощник с использованием резинового гемостатического жгута. Сдавливание сосудов при этом производится только с одной стороны во избежание полного прекращения кровоснабжения головного мозга.
5.Ввести иглу в вену под углом 45º к коже против тока крови. Скос иглы при этом должен быть направлен вверх.
6.Кровь набрать в стерильную пробирку. При этом она должна аккуратно сбегать по стенке сосуда во избежание механического гемолиза.
7.Отпустить вену в месте ее пережатия и только вслед за этим извлечь иглу из вены. В противном случае кровь будет выливаться из иглы на пол помещения.
8.Обработать место введения спиртовым тампоном.
__________________________________________________________________
* при подготовке к работам этого раздела можно воспользоваться иллюстрированным фото- и видео руководством по методам лабораторного анализа крови – авторы Берестов Д.С., Мерзлякова Е.А., Васильев Ю.Г.
23
В случае использования для взятия крови вакуумных пробирок (это более удобный, безопасный и современный вариант) необходимо:
1.Порядок наложения жгута и правила асептики/антисептики те же.
2.После подготовки точки прокола кожи необходимо свинтить защитный чехол с двусторонней иглы со стороны резинового колпачка.
3.Ввинтить двустороннюю иглу в держатель.
4.Снять колпачок с той части двусторонней иглы, которая предназначена для венепункции.
5.Произвести венепункцию.
6.Быстрым движением ввести в держатель вакуумную пробирку. Колпачок пробирки при этом прокалывается, а за счет вакуума кровь начинает поступать в пробирку.
7.После взятия необходимого количества крови ослабить гемостатический жгут, извлечь пробирку, извлечь иглу из вены, место прокола обработать.
8.Подписать полученную пробу. Использованную иглу и держатель утилизировать.
Получение больших количеств крови у свиней:
В крупных животноводческих комплексах на сегодняшний день широко практикуется процедура купирования хвоста, в связи с чем взятие крови путем отрезания его кончика не актуально. Можно получить нужное количество крови из большой ушной вены, но удобнее всего с точки зрения количества крови и чистоты пробы набирать необходимое количество крови из орбитального венозного синуса. Для этого:
1.Зафиксировать животное. Поросенка при этом можно взять на руки, а взрослое животное удобнее фиксировать петлей за верхнюю челюсть.
2.Раздвинуть веки животного пальцами.
3.Иглу срезом слегка прижать к глазному яблоку и двигая к переднему углу глаза завести ее под третье веко.
4.Продолжая двигаться вдоль глазного яблока, углублять иглу в глазницу до тех пор, пока игла не окажется направленной слегка вниз и назад.
5.В тот момент, когда игла будет находиться в переднем углу глаза и окажется направлена практически перпендикулярно к поверхности головы, необходимо сделать глубокий прокол. В случае попадания в глазничный синус из иглы пойдет кровь.
6.Если игла упирается в кость и из нее не идет кровь, ее необходимо перенаправить и сделать повторный прокол.
7.Набрав нужное количество крови, извлечь иглу.
Получение больших количеств крови у собак:
1.Животное фиксировать в горизонтальном положении.
2.Кровь берется из подкожной вены предплечья (v. cephalica antebrachii) примерно на середине предплечья или из подкожной вены голени (v. saphena).
24
3.Порядок подготовки венепункции, наложения жгута и введения иглы такой же как при пункции яремной вены крупных животных.
Получение больших количеств крови у морских свинок:
В зависимости от целей и опыта человека, проводящего манипуляцию, практикуется взятие крови из сердца, подкожной вены предплечья и орбитального венозного сплетения.
Для получения крови из сердца необходимо:
1.Подготовить поверхность кожи в точке пункции – у левого края грудной кости в области наилучшей пальпации сердечного толчка.
2.Произвести прокол кожи и всех тканей, направляя иглу к середине грудной полости на глубину 1,5-2 см.
3.Набрать необходимое количество крови, извлечь иглу, обработать место прокола.
Получение крови у крыс:
Производится способом отрезания кончика хвоста. Имеются сведения о получении крови из сердца, но по сравнению с морскими свинками для крыс этот способ взятия крови является небезопасным, требует надежной фиксации, седации или даже наркотизации животного, что делает его неудобным.
Получение крови у мышей:
Производится из кончика хвоста после его отрезания или из орбитального венозного сплетения.
Получение крови у птиц:
1.Производится из подкожной локтевой вены. Для этого:
2.Вблизи локтевого сустава выщипать перья.
3.Нажать пальцами выше локтя, найти вену.
4.Обработать кожу в месте вкола иглы, произвести пункцию.
Получение небольшого количества крови для морфологического анализа у млекопитающих:
1.После фиксации животного выстричь и обработать спиртом кожу в области прохождения краевой вены уха.
2.Проколоть вену иглой или надрезать острым скальпелем.
3.В случае приготовления мазка для диагностики кровепаразитарных заболеваний использовать первую выступившую каплю крови. Во всех остальных случаях удалить первую каплю, остальные использовать в работе (собирать на часовое стекло, набирать в пипетку, меланжер и т.д.)
4.Обработать кожу спиртовым тампоном.
25
Получение небольшого количества крови у птиц:
Небольшое количество крови у птиц берут чаще всего путем надреза или прокола иглой гребешка (сережек), а у гусей, уток – при прокалывании мягких тканей межпальцевых перепонок.
Получение плазмы крови:
1.Предварительно в емкость для отбора образца крови поместить небольшое количество антикоагулянта (гепарин – 2 капли на 10 мл крови, 20-30 мг лимоннокислого натрия на 10 мл крови и др.)
2.После набора крови осторожно перемешать ее с антикоагулянтом путем неоднократного переворачивания пробирки.
3.Центрифугировать полученную смесь при 3000 об/мин в течение 20 мин. В случае отсутствия центрифуги допускается отстаивание крови в термостате при 37ºС в течение суток (у лошадей в силу очень высокой СОЭ – в течение 1 ч).
4.Содержимое пробирки расслоится на эритроциты (внизу), тонкий мутный слой лейкоцитов (лейковзвесь над слоем эритроцитов) и прозрачную жидкость – плазму (вверху), которую можно использовать для исследований.
Получение сыворотки крови:
1.Набрать кровь в пробирку без антикоагулянта.
2.Дать отстоятся в термостате в течение суток.
3.В пробирке образуется сгусток крови, вокруг которого образуется прозрачная, желтоватая, слегка опалесцирующая жидкость – сыворотка, которую можно слить или отсосать пипеткой и использовать для исследований.
Работа № 2. Определение количества эритроцитов в крови
Цель: освоить метод ручного определения количества эритроцитов с помощью счетной камеры Горяева.
Вопросы для подготовки к работе:
1.Строение и функции эритроцитов. Видовые особенности.
2.Значение определения количества эритроцитов для клинической практики.
3.Количество эритроцитов у здоровых животных разных видов.
Материальное обеспечение: микроскоп, камера Горяева, покровные стекла, смеситель (эритроцитарный меланжер), скарификатор, спиртовые тампоны, 0,9 % раствор натрия хлорида, емкости для утилизации тампонов и использованных инструментов с дезинфицирующим раствором.
26
Ход работы:
1.Проверить наличие и работоспособность необходимого оборудования и реактивов.
2.Сфокусировать микроскоп на сетке камеры Горяева, при этом в зависимости от индивидуальных предпочтений можно использовать окуляры с увеличением х7 или х10 и объективы х20 или х40. Найти большие квадраты сетки, разделенные на 16 малых квадратов.
3.Проверив чистоту поверхностей стекла камеры Горяева, притереть к ней покровное стекло до появления Колец Ньютона.
4.Если для работы используется кровь животного, уже набранная в пробирку, то ее необходимо аккуратно перемешать и вылить небольшое ее количество на чистое часовое стекло.
5.Если для работы используется свежая кровь человека, то ее необходимо взять из пальца с соблюдением правил асептики и антисептики. Работа проводится строго в перчатках. Необходимо взять чистое часовое стекло, протереть его спиртовым тампоном. Палец донора обрабатывается спиртовым тампоном, после чего открывается упаковка со стерильным одноразовым скарификатором. Открывание производится со стороны ручки, а не со стороны острия. Уверенным твердым движением прокалывается кожа кончика пальца, использованный скарификатор сразу выкидывается в емкость с дез. раствором. Первая капля крови удаляется спиртовым тампоном. Последующие капли выдавливаются на стерильное часовое стекло. В работе используются нестерильные многоразовые меланжеры, поэтому категорически запрещено прикасаться ими к ранке, отбор крови ведется только строго с часового стекла. После получения необходимого количества крови на ранку накладывается спиртовый тампон.
6.Взять эритроцитарный смеситель (меланжер). Он имеет красную бусинку в резервуаре и три отметки: «0,5», «1», «101». Со стороны отметки «101» надеть на него грушу или резиновую трубку, соединенную с грушей.
7.Набрать в меланжер кровь с часового стекла до отметки «0,5».
8.Удалить излишек крови с кончика меланжера ватным тампоном.
9.После удаления излишка крови, ее столбик должен находится точно
напротив отметки «0,5»*.
10.В этот же меланжер набрать физиологический раствор до отметки 101. Если раствор находится в большой емкости, желательно заранее перелить необходимое его количества в малый сосуд, удобный для работы. При таком наборе кровь получается разбавленной в 200 раз.
11.Большим пальцем свободной руки зажать кончик меланжера, а другой рукой снять грушу.
________________________________________________________________
* отметка «1» используется для набора крови в случае анемии и(или) эритропении, для разбавления крови в меньшее количество раз и получения более достоверного результата.
27
12.Зажать второй кончик меланжера средним пальцем (он окажется зажатым между большим и указательным пальцами) и интенсивными встряхиваниями перемешать его содержимое.
13.Выпустить первые 3 капли содержимого меланжера на ватный тампон. 14.Следующую каплю нанести встык камеры Горяева и покровного стекла
таким образом, чтобы щелевидное пространство между стеклами оказалось полностью заполненным смесью.
15.Поместить меланжер в емкость с дез. раствором, а камеру Горяева под объектив подготовленного микроскопа.
16.Через 3 минуты* подсчитать количество эритроцитов** в 5 больших квадратах сетки камеры Горяева, разделенных на 16 малых и расположенных по большой диагонали сетки.
17.Найденное количество клеток умножить на 104. Полученное число – это количество эритроцитов в одном микролитре (1мкл = 1мм3) исследуемой крови***.
Работа № 3. Определение количества гемоглобина методом Сали
Цель: научиться определять количества гемоглобина в крови вручную методом Сали.
Вопросы для подготовки к работе:
1.Функции гемоглобина в организме.
2.Строение молекулы гемоглобина.
3.Значение определения количества гемоглобина для клинической практики.
4.Количество гемоглобина в крови здоровых животных разных видов.
Материальное обеспечение: спиртовые тампоны, кровь или приборы для ее получения (скарификатор), часовое стекло, 0,1 н. раствор соляной кислоты, дистиллированная вода, стеклянные пипетки, тонкая стеклянная палочка, гемометр Сали, капилляр на 20 мкл или механический дозатор с диапазоном дозирования, захватывающим объем в 20 мкл, емкости с дез. раствором для утилизации использованных тампонов, капилляров, часовых стекол и наконечников дозатора.
__________________________________________________________________
*это необходимо для того, чтобы эритроциты успели осесть на сетку камеры, и находились в одной плоскости. В противном случае они не будут находиться в одном фокусе объектива микроскопа, и подсчет будет вести неудобно.
**для точности подсчета и для того, чтобы не сосчитать одну и ту же клетку дважды, в случае, если эритроцит лежит непосредственно на краю квадрата, то считают только те эритроциты, которые касаются (неважно внутри или снаружи) верхнего или правого края квадрата, а те которые касаются левого и нижнего края квадрата не считают.
***для того чтобы рассчитать количество эритроцитов в литре исследуемой крови, необходимо количество клеток, найденное в 5 больших квадратах, умножить на 1010.
28
Ход работы:
1.В пробирку гемометра* до первой нижней метки (или кольцевой отметки, если таковая имеется) набрать пипеткой децинормальный раствор соляной кислоты.
2.Налить небольшое количество анализируемой крови на часовое стекло (отбор крови из пальца проводится как при определении количества эритроцитов).
3.Капилляром на 20 мкл или дозатором набрать 20 мкл (0,02 мл) крови.
4.Кровь аккуратно выдуть на дно пробирки с соляной кислотой. Чистой надосадочной жидкостью 2-3 раза промыть капилляр или наконечник дозатора.
5.Встряхнуть пробирку, перемешав ее содержимое.
6.Подождать 3 минуты для образования в пробирке солянокислого гематина, имеющего интенсивный коричневый цвет.
7.Пипеткой понемногу разбавлять содержимое пробирки дистиллированной водой до тех пор, пока цвет раствора не выровняется с цветом эталонных растворов гемометра. В процессе разбавления периодически перемешивать содержимое пробирки тонкой стеклянной палочкой.
8.Отметить, какое значение шкалы гемометра находится на уровне нижнего мениска уровня жидкости пробирки. Полученное значение – количество гемоглобина в исследуемой крови в гр% (если максимальные числа шкалы двузначные) или единицах Сали (если максимальные числа шкалы трехзначные).
Работа № 4 . Определение количества гемоглобина в крови унифицированным цианметгемоглобиновым методом
Цель: освоить один из точных инструментальных методов определения количества гемоглобина.
Вопросы для подготовки к работе:
1.Строение и свойства молекулы гемоглобина.
2.Синтез и распад гемоглобина в организме.
3.Принципы колориметрического анализа.
Материальное обеспечение: фотоэлектроколориметр (ФЭК), кюветы для ФЭКа с толщиной поглощающего слоя 1 см., дозатор механический одноканальный переменного объема с диапазоном дозирования 5-50 мкл или капилляр на 20 мкл, часовое стекло, кровь или оборудования для ее взятия (скарификатор), спиртовые тампоны, пробирки объемом не менее 10 мл, стеклянные пипетки объемом 1 и 10 мл, стеклянная палочка, набор реагентов
__________________________________________________________________
* в зависимости от модели гемометра шкала пробирки может быть отградуирована как в гр%, так и в единицах Сали. 1 ед. Сали = 6 гр%.
29
для определения количества гемоглобина цианметгемоглобиновым методом, дистиллированная вода, емкости с дез. раствором для утилизации использованных тампонов, капилляров, часовых стекол и наконечников дозатора.
Ход работы*:
1.Подготовить ФЭК. Для этого ручки «грубо» и «точно» вывернуть максимально против часовой стрелки, после чего включить прибор в сеть. С момента включения до начала анализа должно пройти не менее 20 минут.
2.Пипеткой набрать в пробирку 1 мл монореагента из набора реактивов.
3.Другой пипеткой добавить 9 мл дистиллированной воды. Перемешать.
4.Взять две** одинаково промаркированные кюветы для колориметрии с толщиной поглощающего слоя 1 см.
5.В каждую кювету чистой пипеткой набрать по 5 мл полученного рабочего раствора из пробирки. В ходе работы допускается держать кюветы только за боковые поверхности.
6.Набрать 20 мкл крови и выпустить ее в одну из кювет. Перемешать.
7.Подождать не менее 5 минут.
8.Перевести ручку переключателя положения кювет в положение «1».
9.Открыть крышку ФЭКа и в дальний ряд кюветодержателя поместить кювету с чистым рабочим раствором (контроль).
10.В ближний ряд кюветодержателя поместить кювету с пробой крови и закрыть крышку.
11.Установить ручку переключения светофильтров в положение «540 нм». 12.Установить переключатель чувствительности в положение «2» по черной
шкале.
13.Ручками «грубо» и «точно» установить стрелку прибора в положение «0» нижней шкалы.
14.Перевести переключатель кювет в положение «2».
15.Отметить показания стрелки прибора по нижней шкале. ВНИМАНИЕ отсчет ведется справа налево.
16.Найденное значение умножить на 39,2. Полученное число – количество гемоглобина в гр% в образце исследуемой крови.
17.В случае анализа нескольких проб крови, заменить кювету с пробой крови на следующую. Контрольную кювету оставить ту же, проверить положение нуля относительно контроля и повторить определение.
________________________________________________________________
*в данной методике описан макрометод определения количества гемоглобина в одной пробе крови с использованием 20 мкл крови для анализа и 1-сантиметровых кювет.
**количество используемых в работе кювет равно количеству проб крови плюс одна кювета для контроля. Рабочий раствор при этом должен готовиться единовременно для всех проб. Например, если необходимо определить количество гемоглобина в 10 пробах крови, понадобиться 11 кювет и 55 мл рабочего раствора реагента (в случае макроварианта метода).
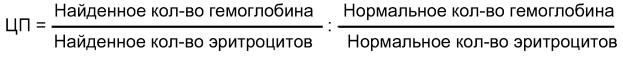
30
Работа № 5. Расчет цветного показателя
Цель: научиться рассчитывать цветной показатель, усвоить его значение для клинической практики.
Вопросы для подготовки к работе:
1.Значение расчета цветного показателя для клинической практики.
2.Величины нормальных значений цветного показателя.
Материальное обеспечение: необходимы данные о содержании в крови эритроцитов и гемоглобина.
Ход работы:
По цветному показателю судят о степени насыщенности гемоглобином каждого эритроцита. Цветной показатель (ЦП) вычисляется по формуле:
Работа № 6. Определение скорости оседания эритроцитов (СОЭ)
Цель: освоить методику определения скорости оседания эритроцитов методом Панченкова, уяснить значение этого показателя для клинической практики.
Вопросы для подготовки к работе:
1.Значение определения СОЭ для клинической практики.
2.Факторы, определяющие величину СОЭ.
3.Нормативные значения СОЭ у животных разных видов.
Материальное обеспечение: аппарат Панченкова, 5% раствор цитрата натрия, часовые стекла, кровь или приборы для ее взятия (скарификатор), спиртовые тампоны, часы, емкости с дез. раствором для утилизации использованных тампонов, скарификаторов и капилляров.
Ход работы:
1.Промыть пипетку прибора Панченкова 5% раствором цитрата натрия.
2.В промытую пипетку набрать 5% раствор цитрата натрия до метки «Р» (50) и выдуть его на часовое стекло.
3.Дважды набрать свежей крови в ту же пипетку до метки «К» и выдуть, ее на то же часовое стекло.
4.Перемешать полученную смесь крови и цитрата натрия и набрать смесь в пипетку до метки «0».
