
физиология
.pdf31
5.Установить пипетку вертикально в штатив прибора. Для этого большим пальцем заткнуть кончик пипетки, снять грушу, указательным пальцем другой руки закрыть верхний конец пипетки, а нижний ее конец поставить на резиновую прокладку прибора и зафиксировать пипетку в вертикальном положении.
6.Засечь время и отмечать по шкале пипетки положение столбика отстоявшихся эритроцитов каждые 15 минут. Через час записать окончательный результат.
Работа № 7. Определение количества лейкоцитов в крови
Цель: освоить метод ручного определения количества лейкоцитов с помощью счетной камеры Горяева.
Вопросы для подготовки к работе:
1.Виды и функции лейкоцитов в организме.
2.Значение определения количества эритроцитов для клинической практики.
3.Факторы, определяющие количество лейкоцитов.
4.Количество эритроцитов в крови здоровых животных разных видов.
Материальное обеспечение: микроскоп, камера Горяева, покровные стекла, смеситель (лейкоцитарный меланжер), скарификатор, спиртовые тампоны, жидкость Тюрка, емкости для утилизации тампонов и использованных инструментов с дезинфицирующим раствором.
Ход работы:
1.Проверить наличие и работоспособность необходимого оборудования и реактивов.
2.Сфокусировать микроскоп на сетке камеры Горяева, при этом в зависимости от индивидуальных предпочтений можно использовать окуляры с увеличением х7 или х10 и объективы х20 или х40. Найти большие квадраты сетки, не разделенные на 16 малых квадратов. Они расположены группами по 4. Подсчет количества лейкоцитов удобнее вести с объективом х20.
3.Проверив чистоту поверхностей стекла камеры Горяева, притереть к ней покровное стекло до появления Колец Ньютона.
4.Налить небольшое количество анализируемой крови на часовое стекло (отбор крови из пальца проводится как при определении количества эритроцитов).
5.Взять лейкоцитарный меланжер. Он имеет белую или прозрачную бусинку в резервуаре и отметки «0,5», «1» и «11».
6.Набрать в меланжер кровь с часового стекла до отметки «0,5».
7.Удалить излишек крови с кончика меланжера ватным тампоном.
32
8.После удаления излишка крови, ее столбик должен находится точно напротив отметки «0,5»*.
9.В этот же меланжер набрать жидкость Тюрка** до отметки 20. Если раствор находится в большой емкости, желательно заранее перелить
необходимое его количества в малый сосуд, удобный для работы. При таком наборе кровь получается разбавленной в 20 раз.
10.Большим пальцем свободной руки зажать кончик меланжера, а другой рукой снять грушу.
11.Зажать второй кончик меланжера средним пальцем (он окажется зажатым между большим и указательным пальцами) и интенсивными встряхиваниями перемешать его содержимое.
12.Выпустить первые 3 капли содержимого меланжера на ватный тампон. 13.Следующую каплю нанести встык камеры Горяева и покровного стекла
таким образом, чтобы щелевидное пространство между стеклами оказалось полностью заполненным смесью.
14.Поместить меланжер в емкость с дез. раствором, а камеру Горяева под объектив подготовленного микроскопа.
15.Через 3 минуты подсчитать количество лейкоцитов в 100 больших квадратах сетки камеры Горяева, не расчерченных на малые квадраты. Они расположены группами по 4. В сетке камеры Горяева их всего 100, таким образом необходимо произвести подсчет во всех нерасчерченных больших квадратах.
16.Найденное количество клеток умножить на 50. Полученное число – это количество лейкоцитов в одном микролитре (1мкл = 1мм3) крови.
Работа № 8. Методика определения лейкоформулы
Цель: освоить ручную методику дифференцированного подсчета лимфоцитов и уяснить ее значение для клинической практики.
Вопросы для подготовки к работе:
1.Факторы, определяющие лейкоцитарный состав крови.
2.Значение определения лейкоформулы для клинической практики.
3.Нормальные показатели лейкоформулы у животных разных видов.
Материальное обеспечение: обезжиренные предметные стекла, шпатели для растяжки мазков крови, кровь или приборы необходимые для ее взятия (скарификатор), спиртовые тампоны, абсолютный этиловый спирт, рабочий раствор красителя Романовского-Гимза, емкости для окраски , микроскоп с иммерсионным объективом, иммерсионное масло, атлас клеток крови.
__________________________________________________________________
*отметка «1» используется для анализа в случае лейкопении.
**жидкость Тюрка – это 3% раствор уксусной кислоты, подкрашенный метиленовым синим.
33
Ход работы:
1.На край хорошо обезжиренного предметного стекла нанести небольшую каплю крови.
2.Положить стекло на стол. Зажать шпатель для растяжки мазков крови между большим и указательным пальцами.
3.Держа шпатель под углом 45° к предметному стеклу, прикоснуться его краем к капле крови, дать ей растечься по краю.
4.Быстрым, но не резким движением провести краем шпателя по поверхности предметного стекла. Капля крови при этом должна тянуться за шпателем, а не перед ним.
5.Высушить на воздухе полученный мазок крови.
6.Зафиксировать мазок, поместив на 15 минут в абсолютный этиловый спирт.
7.Окрасить мазок, поместив его в емкость с рабочим раствором красителя Романовского-Гимза в течение 15-20 минут, контролируя интенсивность окраски периодическим микроскопированием.
8.После получения требуемой интенсивности окраски ополоснуть мазок водой, высушить на воздухе.
9.Под иммерсионной системой произвести дифференцированный подсчет минимум 100 лейкоцитов. В случае затруднения в идентификации лейкоцита, воспользоваться атласом крови. При этом необходимо учесть, что при растягивании мазка разные виды лейкоцитов в силу различий их массы и плотности распределяются по стеклу неравномерно, поэтому при подсчете необходимо передвигать мазок таким образом, чтобы захватить как центральные области мазка, так и его края в разных участках стекла. При подсчете ста клеток одна клетка будет представлять 1% лейкоцитов
своего вида.
10.Записать в тетрадь результат в виде: ЭхБхЮхПяхСяхЛихМх, где «х» - процент клеток каждого вида, «Э» - эозинофилы, «Б» - базофилы, «Ю» - юные нейтрофилы (метамиелоциты), «Пя» - палочкоядерные нейтрофилы, «Ся» - сегментоядерные нейтрофилы, «Ли» - лимфоциты, «М» - моноциты.
11.Умножив долю клеток каждого вида на общее количество лейкоцитов в той же пробе крови, установить абсолютное содержание лейкоцитов каждого вида в единице объема крови. Записать результат.
Примечания:
-расчет лейкоформулы всегда должен сопровождаться данными об общем количестве лейкоцитов в единице объема крови. В противном случае полученная лейкоформула может оказаться просто бесполезной в оценке состояния животного.
-удалить масло с объектива, а также с поверхности мазка после проведения расчета можно однократным движением мягким спиртовым тампоном без сильного нажима.
34
Работа № 8. Определение групп крови человека
Цель: изучить принцип деления крови на группы, пронаблюдать явление агглютинации эритроцитов в ходе определения групп крови человека.
Вопросы для подготовки к работе:
1.Понятие об агглютининах и агглютиногенах.
2.Системы групп крови животных и человека.
3.Значение определения групп крови для клинической практики.
Материальное обеспечение: скарификаторы, предметные стекла, карандаш дли отметок на стекле, две стеклянные палочки, 3 глазные пипетки, стандартные сыворотки (цоликлоны) 1, 2 и 3 групп, спиртовые тампоны, емкости с дез. раствором для утилизации использованных тампонов, скарификаторов и стеклянных инструментов.
Ход работы:
1.На чистое предметное стекло нанести три маленьких капли исследуемой крови.
2.Рядом (ни в коем случае не непосредственно в кровь) с первой каплей крови нанести каплю сыворотки первой группы крови (она содержит агглютинины α и β), рядом со второй – каплю сыворотки второй группы (с агглютинином β), рядом с третьей – каплю сыворотки третьей группы (с агглютинином α). Объем капли сыворотки должен быть в несколько раз больше объема капли крови.
3.Тремя разными стеклянными палочками смешать кровь с сыворотками (цоликлонами).
4.Добавить по капле физиологического раствора в каждую каплю и в течение 3-5 минут покачивать стекло и наблюдать за реакцией.
5.В случае возникновения агглютинации в смеси появляются конгломераты эритроцитов, сливающиеся в хлопья, легко видимые невооруженным глазом и выпадающие в осадок. Скорость наступления агглютинации может зависеть от температуры воздуха в лаборатории.
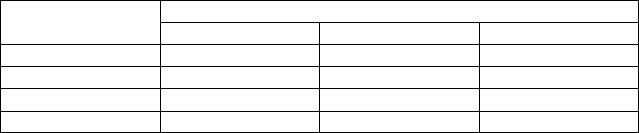
6.Определить групповую принадлежность исходя из следующей таблицы:
Группа крови |
|
Наличие агглютинации |
|
|
Первая капля |
Вторая капля |
Третья капля |
I (0) |
- |
- |
- |
II(А) |
+ |
- |
+ |
III(В) |
+ |
+ |
- |
IV(АВ) |
+ |
+ |
+ |
7. Записать полученный результат в рабочую тетрадь.
35
РАЗДЕЛ V. ФИЗИОЛОГИЯ КРОВООБРАЩЕНИЯ. СЕРДЕЧНОСОСУДИСТАЯ СИСТЕМА
Работа № 1. Выслушивание тонов сердца
Цель: Выслушать и запомнить звучание звуков (тонов), возникающих при нормальной деятельности сердца, изучить механизм их возникновения.
Вопросы для подготовки к работе:
1.Сердечный цикл.
2.Механизм возникновения сердечного толчка и тонов сердца.
3.Частота сердцебиения в покое у здоровых животных разных видов.
Материальное обеспечение: фонендоскоп или стетоскоп, спиртовые тампоны, исследуемый.
Ход работы:
1.Выслушать сердечные тоны животного, имеющего на занятии или человека в случае отсутствия животного.
2.Если одним фонендоскопом пользуется несколько человек, то необходимо протирать его ушные оливы спиртовым тампоном после каждого использования.
3.Записать в тетрадь слышимые характеристики тонов, возникающих при работе сердца и места их наилучшей слышимости. Отметить громкость, продолжительность, ритмичность, высоту тонов. Соотнести точки наилучшей слышимости с топографией сердца и расположением области сердечного толчка.
Улошади систолический тон лучше слышен в пятом межреберье слева на середине нижней третьей грудной клетки, диастолический тон – в четвертом межреберье слева на 2-3 см ниже горизонтальной линии от лопатко-плечевого сустава.
Укоровы систолический тон – в четвертом межреберье на уровне нижней третьей грудной клетки животного, диастолический тон – на 2-3 см ниже лопатко-плечевого сустава.
36
Работа № 2. Измерение артериального давления
Цель: Научиться измерять артериальное давление у животных и человека бескровным методом. Изучить зависимость артериального давления от физической нагрузки.
Вопросы для подготовки к работе:
1.Определение давления крови. Систолическое и диастолическое артериальное давление. Пульсовое давление.
2.Факторы, определяющие величину артериального давления.
3.Факторы, способствующие венозному возврату крови к сердцу.
Материальное обеспечение: ручной механический тонометр*, фонендоскоп или стетоскоп, спирт, вата, исследуемый.
Ход работы:
1.Измерить у испытуемого человека систолическое и диастолическое давление крови в плечевой артерии бескровным методом. Вычислить пульсовое давление как разницу между систолическим и диастолическим.
2.Выполнить приседания и отжимания.
3.Повторно измерить давления.
4.Занести результаты измерений в таблицу:
Давление крови в плечевой артерии до и после физической нагрузки.
Показатель |
Систолическое |
Диастолическое |
Пульсовое |
|
давление, |
давление, |
давление, |
|
мм.рт.ст. |
мм.рт.ст |
мм.рт.ст. |
|
|
|
|
До нагрузки |
|
|
|
|
|
|
|
После нагрузки |
|
|
|
|
|
|
|
5.Объяснить результат, записав заключение и вывод.
6.В случае наличие на занятии животного, произвести измерение артериального давления в разных сосудах, результаты записать в рабочую тетрадь.
__________________________________________________________________
* механический тонометр является более точным прибором по сравнению с автоматическими электронными тонометрами, но менее удобен в работе. Самым точным является ртутный сфигмоманометр Рива-Роччи (в настоящий момент в практике не применяется).

37
Методика измерения артериального давления:
Существует два способа измерения артериального давления: кровавый и бескровный.
Кровавый метод: в просвет сосуда вводится канюля, трубкой соединенная с манометром. Величина давления и его колебания регистрируются фактически напрямую. Способ более точный, чем бескровный но менее удобный и безопасный. Применяется на сегодняшний день только в научных целях.
Бескровный метод: |
|
|
|||
Существует |
|
в |
нескольких |
|
|
разновидностях, |
но |
|
автором |
|
|
современной |
|
повсеместно |
|
||
применяемой |
методики |
является |
|
||
хирург Военно-медицинской академии |
|
||||
Санкт-Петербурга Н.С. Коротков (рис. |
|
||||
1). Метод изобретен в 1905 г. |
|
|
|||
На часть тела, содержащую артерию, в |
|
||||
которой производится |
измерение |
|
|||
давления, |
накладывается |
манжета |
|
||
тонометра. В нее с помощью груши |
|
||||
нагнетается |
воздух. |
Как |
только |
|
|
давление |
воздуха |
в |
манжете |
|
|
становится |
больше систолического |
|
|||
давления |
в |
артерии, |
сосуд |
|
|
сдавливается и кровоток в нем не |
|
||||
осуществляется. |
После |
этого |
|
||
медленно |
выпускают |
воздух из |
|
||
манжеты, |
|
одновременно |
|
||
аускультируют |
артерию |
с |
помощью |
|
|
фонендоскопа ниже места пережатия и |
Рис. 1. Н.С. Коротков. |
||||
параллельно |
пальпируют пульс. Как |
|
|||
только давление в манжете выровняется с систолическим давлением крови в артерии, в момент каждой систолы кровь станет толчками «протискиваться» по сосуду под манжетой. В этот момент с помощью фонендоскопа начинают выслушиваться ритмичные звуки, называемые тонами Короткова. Одновременно начинает пальпироваться пульс. Показания манометра прибора в данный момент времени будут равны систолическому давлению крови в исследуемой артерии.
После этого продолжают выпускать воздух из манжеты. Как только давление воздуха в манжете выровняется с диастолическим давлением крови в артерии, кровь начнет проходить по сосуду не только в систолу, но и в диастолу. Тоны Короткова в этот момент времени исчезают (пульс естественно остается), а показания манометра будут равны диастолическому артериальному давлению.
38
Особенности измерения артериального давления у животных.
Лучшим местом для определения артериального давления у лошадей
икрупного рогатого скота является хвостовая артерия. Животное при этом фиксируют в станке. На корень хвоста накладывают манжету. Нащупывают пульс в дистальном отделе хвостовой артерии. Нагнетают воздух в манжету, при этом пульсация в артерии прекращается. Постепенно снижают давление манжеты. Момент появления пульса соответствует систолическому давлению в хвостовой артерии. Пальпаторный метод Рива-Роччи (по пульсу) позволяет определить только систолическое давление.
Усобак и кошек определение давления произвести труднее в силу размеров животного. У крупных собак можно производить определение давления в крупных артериях конечностей пальпаторно (по пульсу), для удобства можно использовать тонометр с педиатрической манжетой.
В настоящий момент для измерения артериального давления у собак
икошек используют специальные приборы. Основной принцип их работы тот же – на конечность накладывается манжета. Главной особенностью является регистрация пульсовой волны ниже места пережатия с помощью осциллографии, доплерографии или фотоплетизмографии, так как в большинстве случаев сделать это пальпаторно или с помощью аускультации затруднительно или невозможно.
При определении артериального давления следует иметь в виду, что у животных оно имеет не настолько жесткие нормативные величины как у человека, к тому же нельзя забывать, что давление в разных артериях сильно различается, что нужно обязательно иметь в виду при сравнении с нормальными значениями.
Работа № 3. Наблюдение движения крови
Цель: Визуально пронаблюдать движение крови в сосуде живого организма.
Вопросы для подготовки к работе:
1.Функциональные типы сосудов.
2.Особенности движения крови по сосудам. Понятие осевого цилиндра.
3.Объемная и линейная скорости кровотока. Факторы, обуславливающие их величину.
Материальное обеспечение: пробковая пластинка, микроскоп, капилляроскоп, осветитель, булавки, марлевая салфетка, 3% раствор эфира, лягушка.
Ход работы:
1.Наркотизировать лягушку погружением ее в 3% раствор эфира на 10 мин.
2.Укрепить лягушку на пробковой пластинке так, чтобы перепонка лапки была против отверстия в пластинке.
39
3.При малом увеличении микроскопа найти артериальные и венозные сосуды, ориентируясь по направлению течения крови в них. Для наблюдения кровообращения в сосудах языка пинцетом захватить язык лягушки и растянуть его булавками над отверстием в дощечке.
4.Наблюдают течение крови в артериолах, капиллярах, венулах.
5.Зарисовать видимую картину в рабочую тетрадь. Описать характер движения крови в сосудах разного калибра. Сделать вывод.
6.Провести капилляроскопию у человека. Для этого нанести капельку иммерсионного масла на ногтевое ложе и поместить палец под тубус капилляроскопа. Установить освещение и фокус на самый край ногтевого ложа, найти капилляры и обратить внимание на их форму. При внимательном рассмотрении в отдельных, более широких капиллярах, видно движение крови (эритроцитов) по изгибу концевого капилляра. Зарисовать в тетради несколько капилляров. Отметить артериальную и венозную части концевого капилляра и направление движения крови в нем.
Работа № 4. Исследование сердечно-сосудистых рефлексов
Цель: Изучить некоторые механизмы регуляции деятельности сердечнососудистой системы, исследовать сердечные рефлексы, выяснить их значение для диагностической и терапевтической практики.
Вопросы для подготовки к работе:
1.Внутриклеточные и межклеточные механизмы регуляции работы миокарда.
2.Внутрисердечная нервная регуляция.
3.Экстракардиальные механизмы регуляции деятельности сердца.
Материальное обеспечение: секундомер, испытуемый с отсутствием заболеваний сердечно-сосудистой системы.
Ход работы:
1.Измерить частоту и характеристики пульса испытуемого за 1 минуту.
2.Исследовать глазосердечный рефлекс Данини-Ашнера. Для этого в течение 5 секунд сквозь верхние веки давить на глазные яблоки. Сразу после этого повторно исследовать частоту пульса.
3.Исследовать влияние пробы Вальсалвы на сердечную дятельность. Для этого подсчитать частоту и исследовать характеристики пульсовой волны до и после сильного натуживания при крытой голосовой щели.
4.Записать в рабочую тетрадь наблюдения, сделать вывод и дать заключение, объяснив полученные данные.
40
Работа № 5. Запись и анализ нормальной электрокардиограммы собаки
Цель: Освоить методику записи и анализа электрокардиограммы. Усвоить механизм ее формирования.
Вопросы для подготовки к работе:
1.Механизм автоматии миокарда. Определение понятия пейсмекер.
2.Строение, механизмы работы и значение проводящей системы сердца.
3.Механизм возникновения разности потенциалов на поверхности миокарда при его работе.
4.Топографическая анатомия сердца собаки.
5.Нормативные показатели ЭКГ собак.
Материальное обеспечение: электрокардиограф, 96 %-ный этиловый спирт, калькулятор, собака.
Ход работы:
1.Записать электрокардиограмму. Для этого заземлить электрокардиограф, включить его в сеть. Собаку уложить на стол на правый бок. Закрепить на конечностях электроды: красный – на правой грудной, желтый – на левой грудной, зеленый – на левой тазовой, черный – на правой тазовой конечностях. Места контактов электродов с кожей увлажнить этиловым спиртом. Установить переключатель амплитуды стандартного милливольта в положение «10» или (в зависимости от модели аппарата) поворотом колеса регулировки установить амплитуду 10 мм/мВ. Установить скорость движения бумаги 50 мм/с, кнопку успокоителя в положение «вкл». Одновременно включить подачу бумаги и перевести кнопку успокоителя в положение «выкл», затем несколько раз нажать кнопку «1», записав тем самым амплитуду стандартного милливольта. Выключить подачу бумаги и включить успокоитель. Последовательно записать 3 стандартных и 3 усиленных отведения, переключая соответствующую ручку электрокардиографа. Все переключения производить только при включенном успокоителе. По мере записи каждого отведения проводить их маркировку (если модель кардиографа не позволяет сделать это автоматически). Записать 4 грудных отведения, переключив ручку переключателя отведений в положение «V» и последовательно закрепляя белый электрод в следующих точках грудной
стенки животного: для отведения V4 – в шестом межреберье слева на уровне реберно-хрящевой линии, V2L – в шестом межреберье слева у края грудины, V2r – в пятом межреберье справа у края грудины, V10 – над остистым отростком седьмого грудного позвонка. Места контактов электродов с кожей увлажнять спиртом.
2.Выключить кардиограф, отсоединить электроды. На полученной электрокардиограмме отметить дату записи, вид животного, породу, пол, возраст, кличку, скорость движения бумаги.
