
- •Техника лабораторных работ
- •Техника работы и калибрование мерной посуды
- •Ход выполнения работы при проверке объема пипетки.
- •Работа с мерными колбами.
- •Ход выполнения работы при проверке объема мерной колбы.
- •Работа с бюретками.
- •Ход выполнения работы при проверке объема бюретки.
- •Зависимость плотности воды от температуры
- •Калибрование бюретки вместимостью 25 м3.
- •Проверка точки 100оС
- •Проверка точки 150оС
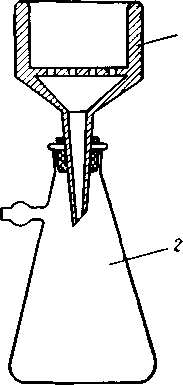
- •Эрленмейера колбы – конические колбы находят широкое применение при аналитических работах. Бывают с носиком или без, с узким или широким горлом под резиновые или притертые пробки.
- •Список использованной литературы
Проверка точки 100оС
1. Термометр вставляют в пробку и помещают в колбу Вюрца с водой так,
чтобы он не касался воды, а был лишь в ее парах (верхний обрез ртутного
шарика должен быть на 0,5 см ниже отводной трубки колбы Вюрца).
-
Довести воду до кипения с помощью нагревательного прибора. Нагрев должен обеспечивать спокойное кипение. Для этого на пламя горелки устанавливают асбестовую сетку или используют колбонагреватель. В колбу помещают «кипелки» (запянные с одного конца капилляры или кусочки битого фарфора).
-
При установлении постоянной температуры, равной кипению воды при данном атмосферном давлении, отмечают показания термометра.
-
По таблице находят значения температуры кипения воды при данном атмосферном давлении (если оно отличается от нормального 760 мм рт.ст.).
|
При выявлении отклонений при измерении температуры вводят поправку на его показания, которую учитывают при дальнейших работах. |
Проверка точки 150оС
Если термометр будет использоваться при замерах высоких температур, желательно провести проверку при более высокой температуре.
1. Для проверки взять сосуд с вазелиновым маслом и нагреть его до температуры 150оС, зафиксировав показания паспортизированным нормальным термометром.
2. Снять показания проверяемого термометра.
3. Составить паспорт проверяемого термометра, подобный приведенному ниже.
|
Термометр |
Показания, оС |
||
|
Тающий лед |
Кипящая вода |
Вазелиновое масло |
|
|
Нормальный |
0 |
+100 |
+150 |
|
Проверяемый |
+1 |
+105 |
+149 |
|
Отклонение |
+1 |
+5 |
-1 |
|
Нельзя нагревать термометры выше максимальной температуры, указанной на шкале. После работы нужно дать термометру постепенно остыть до комнатной температуры, очистить его и положить в футляр или убрать на место. |
Для особо точных измерений вносится поправка на выступающий из колбы столбик термометра, так как он нагрет менее, чем та часть, которая обогревается парами.
∆t = K*n (t1-t2) где,
n –длина выступающего столбика термометра, отсчитанная по числу градусов шкалы,
t1 - наблюдаемая температура, оС,
t2 - средняя температура ( оС) выступающего столбика, определяемая вспомогательным термометром (шарик термометра помещают сбоку на середине выступающей части столбика),
К – коэффициент видимого расширения ртути в стекле.
В интервале температур 0-150 оС К= 0,000158.
Зависимость температуры кипения воды от атмосферного давления
|
Давление, мм.рт.ст. |
Температура воды, о С |
|
730 |
98,9 |
|
735 |
99,1 |
|
740 |
99,3 |
|
745 |
99,5 |
|
750 |
99,6 |
|
755 |
99,8 |
|
760 |
100,0 |
|
765 |
100,2 |
|
770 |
100,4 |
Практическая работа № 3
ИЗУЧЕНИЕ ИЗМЕНЕНИЯ СОСТАВА ВОДЫ В РЕЗУЛЬТАТЕ ДИСТИЛЛЯЦИИ
Отрабатываемые операции:
Дистилляция
Работа с мерной посудой
Титрование
Определение карбонатной жесткости воды
Для проведения работы необходимы:
-
колба Вюрца (1),
-
прямой холодильник (2),
-
2 конические колбы (4) объемом 200-250 мл,
-
резиновые пробки,
-
термометр,
-
аллонж (3),
-
спиртовка или колбонагреватель,
-
мерная колба на 100 мл,
-
индикатор – метиловый оранжевый,
-
бюретка,
-
соляная кислота концентрации 0,1 моль/л.
Ход выполнения работы.
1. Собрать установку для дистилляции воды в соответствии с рисунком.

2. Отогнать чуть больше 100 мл дистиллированной воды.
-
Мерную колбу 100 мл наполняют точно до метки. Капли до метки удаляют жгутиком из фильтровальной бумаги.
-
Отмеренную воду полностью (количественно) переносят в коническую колбу объемом 200-250 мл.
-
Прибавляют 3 капли метилового оранжевого, тщательно перемешивают.
-
Заполняют бюретку соляной кислотой точной концентрации –
0,1 моль/л.
-
Титрование ведут сидя, правой рукой держат и вращают колбу с титруемым раствором, а левой рукой управляют зажимом или краном бюретки. Сначала раствор из бюретки приливают быстро, а по мере титрования его добавляют по каплям до резкого изменения окраски раствора (появление оранжевого цвета). Под колбу положить белую бумагу для того, чтобы легче заметить переход цвета. Находят объем израсходованной кислоты.
-
Титрование проводят не менее 3 раз. Результаты титрования не должны отличаться более чем на 0,05 мл (1-2 капли).
-
Количество (милимолей) израсходованной на титрование кислоты равно количеству (милимолей) солей, обуславливающих карбонатную жесткость. За единицу жесткости принят 1 милимоль солей магния, кальция, железа, содержащихся в 1 л воды.
-
Для сравнения проводим титрование 100 мл водопроводной воды.
Карбонатная жесткость определяется по формуле:
Ж = С HCl* V HCl*1000/VH2O, где
С HCl – концентрация кислоты, 0,1 м/л,
V HCl – объем израсходованной кислоты, мл,
1000- 1л воды, в котором определяют жесткость.
VH2O – объем воды, взятый на титрование.
Например
С HCl= 0,1 м/л, V HCl=3,5 мл,
VH2O = 100 мл.
Ж = 0,1х3,5х1000/100 х10-3= 3,5 х10-3 ммоль/л.
Полученные данные оформляем в виде таблицы.
|
Величина |
Значение |
Примечание |
|
Номер пробы воды |
|
|
|
Объем мерной колбы, см3 (мл) |
|
|
|
Объем HCl, израсходованный на титрование, см3 1-е титрование 2 –е титрование 3-е титрование |
|
|
|
Средний объем раствора HCl, см3 |
|
|
|
Молярная концентрация, моль/л |
|
|
|
Карбонатная жесткость воды, ммоль/л |
|
|
Уравнения реакций
Расчет результатов анализов
Приготовление раствора соляной кислоты HCl 0,1 н (0,1 м/литр).
Раствор готовят с помощью фиксанала. Фиксанал – заранее приготовленное и запаянное в стеклянную ампулу точно отвешенное количество реактива, для приготовления 0,1 н раствора. В 1 л мерную колбу вставляем воронку, куда помещаем специальный боек острым концом вверх. Разбивают о боек дно ампулы, затем остроконечной палочкой пробивают углубление сверху или сбоку. Дают содержимому вытечь. Обмывают ампулу шестикратным количеством дистиллированной воды из промывалки. Удаляют воронку с ампулой и доливают воду до метки.
Практическая работа №4
ПРОВЕРКА ВЫЩЕЛАЧИВАНИЯ ХИМИЧЕСКОГО СТЕКЛА ВОДОЙ
Отрабатываемые операции:
Работа с фарфоровой посудой
Измельчение
Для проведения работы необходимы:
-
фарфоровая ступка,
-
фарфоровый пест,
-
молотое стекло,
-
стакан с водой,
-
индикатор кислотности (фенолфталеин, лакмусовая бумага),
Ход выполнения работы.
-
Насыпать в ступку молотого стекла не более 1/6 вмещаемого объема.
-
Добавить в ступку воду, чтобы стекло было полностью закрыто водой.
|
При заполнении ступки общий объем измельчаемого материала не должен превышать 1/3 объема ступки. |
-
Круговыми движения растереть в ступке стекло с водой.
-
Проверить кислотность воды в ступке с помощью индикатора.
-
Проверить кислотность воды в стакане с водой.
-
Сравнить результаты.
|
Наличие щелочной реакции свидетельствует о выщелачивании катионов натрия, кальция, т.е. о присутствии в воде гидроксидов натрия NaOН, кальция Са(ОН)2 и др. |
Практическая работа №5
ОПРЕДЕЛЕНИЕ КОНЦЕНТРАЦИИ РАСТВОРОВ ПО ИХ ПЛОТНОСТИ И ПРИГОТОВЛЕНИЕ РАСТВОРОВ РАЗБАВЛЕНИЕМ
Отрабатываемые операции:
Измерение плотности жидкостей
Работа с мерной посудой
Приготовление растворов разбавлением
Для проведения работы необходимы:
-
ареометры,
-
цилиндрический сосуд,
-
мерная посуда (цилиндр, пипетка),
-
испытуемая жидкость – серная кислота неизвестной концентрации,
-
дистиллированная вода.
Ход выполнения работы.
Проверка концентрации раствора по плотности.
В цилиндр наливают испытуемую жидкость. В нее осторожно опускают ареометр так, чтобы он не касался стенок цилиндра. Шкала ареометра должна быть погружена в жидкость. Если уровень жидкости выше или ниже шкалы, то выбирают ареометр с другим диапазоном шкалы.
Показания ареометра соответствуют плотности г/см3. По табличным данным находим концентрацию раствора.
Например, показания ареометра составляют 1,18 г/см3, что соответствует концентрации серной кислоты (Н2SО4)-30%.
Разбавление раствора до нужной концентрации.
Нам необходимо приготовить 100 мл раствора с концентрацией Н2SО4 -10%. Для расчета необходимого количества воды воспользуемся правилом «креста»: С1- концентрация (большая) одного раствора, С2- концентрация второго раствора, в случае использования воды -0. С – требуемая концентрация раствора.
Отнимаем от С1-С= М1 –масса раствора с концентрацией С1.
Отнимаем от С-С2 = М2 – масса раствора с концентрацией С2.
С1 М1 30 10
\ / \ /
С 10
/ \ / \
С2 М2 0 20
Для получения 10% раствора надо взять 10 массовых частей раствора кислоты и 20 массовых частей дистиллированной воды.
10 г исходной кислоты будет составлять 10/1,18= 8,47 мл.
20 г воды будут составлять 20 мл.
Общий объем при таком соотношении составит 28,47 мл.
Нам необходимо приготовить 100 мл раствора, тогда находим по пропорции необходимые объемы кислоты и воды.
Объем кислоты составит х=100х8,47/28,47= 29,75 мл.
100 - 28,47,
х - 8,47.
Объем воды составит х=100х20,0/28,47= 70,25 или 100-29,75=70,25 мл.
100 - 28,47,
х - 20,0.
Требуемые объемы отмеряем цилиндром или пипеткой.
|
Разбавление кислот проводят медленным добавлением малых порций кислоты к воде. |
Проверить плотность раствора, 10% раствор должен иметь плотность 1,054 г/см3 (расчет значения смотри дальше)
Задания к самостоятельной работе. Приготовить раствор требуемой концентрации из раствора кислоты неизвестной концентрации:
-
75 мл 9% раствора Н2SО4. 2. 30 мл 8% раствора Н2SО4.
-
50 мл 10% раствора Н2SО4. 4. 80 мл 12% раствора Н2SО4.
5. 90 мл 5% раствора Н2SО4. 6. 60 мл 13% раствора Н2SО4
7. 70 мл 11% раствора Н2SО4. 8. 40 мл 14% раствора Н2SО4
ПЛОТНОСТИ И КОНЦЕНТРАЦИИ (С) РАСТВОРОВ СЕРНОЙ КИСЛОТЫ ПРИ 20оС
|
Плот-ность, г/см3 |
С, г/100 г раствора (%) |
С, моль/л |
Плот-ность, г/см3 |
С, г/100 г раствора (%) |
С, моль/л |
Плот-ность, г/см3 |
С, г/100 г раствора (%) |
С, моль/л |
|
1,000 |
0,3296 |
0,05231 |
1,180 |
30,00 |
5,618 |
1,360 |
58,95 |
12,20 |
|
1,005 |
1.255 |
0,2001 |
1,185 |
30,74 |
5,780 |
1,365 |
59,69 |
12,93 |
|
1,010 |
2,164 |
0,3468 |
1,190 |
31,47 |
5,943 |
1,370 |
60,67 |
13,19 |
|
1,015 |
3,073 |
0,4950 |
1,195 |
32,21 |
6,107 |
1,375 |
61,69 |
13,46 |
|
1,020 |
3,982 |
0,6445 |
1,200 |
32,94 |
6,273 |
1,380 |
62,70 |
13,73 |
|
1,025 |
4,883 |
0,7943 |
1,205 |
33,68 |
6,440 |
1,385 |
63,72 |
14,01 |
|
1,030 |
5,784 |
0,9454 |
1,210 |
34,41 |
6,607 |
1,390 |
64,74 |
14,29 |
|
1,035 |
6,661 |
1,094 |
1,215 |
35,16 |
6,778 |
1,395 |
65,84 |
14,57 |
|
1,040 |
7,530 |
1,243 |
1,220 |
35,93 |
6,956 |
1,400 |
66,97 |
14,88 |
|
1,045 |
8,398 |
1,393 |
1,225 |
36,70 |
7,135 |
1,405 |
68,10 |
15,18 |
|
1,050 |
9,259 |
1,543 |
1,230 |
37,48 |
7,315 |
1,410 |
69,23 |
15,49 |
|
1,055 |
10,12 |
1,694 |
1,235 |
38,25 |
7,497 |
1,415 |
70,39 |
15,81 |
|
1,060 |
10,97 |
1,845 |
1,240 |
39,02 |
7,679 |
1,420 |
71,63 |
16,14 |
|
1,065 |
11,81 |
1,997 |
1,245 |
39,80 |
7,863 |
1,425 |
72,86 |
16,47 |
|
1,070 |
12,65 |
2,148 |
1,250 |
40,58 |
8,049 |
1,430 |
74,09 |
16,81 |
|
1,075 |
13,48 |
2.301 |
1,255 |
41,36 |
8,237 |
1,435 |
75,35 |
17,16 |
|
1,080 |
14,31 |
2,453 |
1,260 |
42,14 |
8,426 |
1,440 |
76,71 |
17,53 |
|
1,085 |
15,13 |
2,605 |
1,265 |
42,92 |
8,616 |
1,445 |
78,07 |
17,90 |
|
1,090 |
15,95 |
2,759 |
1,270 |
43,70 |
8,808 |
1,450 |
79,43 |
18,28 |
|
1,095 |
16,76 |
2,913 |
1,275 |
44,48 |
9,001 |
1,455 |
80,88 |
18,68 |
|
1,100 |
17,58 |
3,068 |
1,280 |
45,27 |
9,195 |
1,460 |
82,39 |
19,09 |
|
1,105 |
18,39 |
3,224 |
1,285 |
46,06 |
9,394 |
1,465 |
83,91 |
19,51 |
|
1,110 |
19,19 |
3,381 |
1,290 |
46,85 |
9,590 |
1,470 |
85,50 |
19,95 |
|
1,115 |
20,00 |
3,539 |
1,295 |
47,63 |
9,789 |
1,475 |
87,29 |
20,43 |
|
1,120 |
20,79 |
3,696 |
1,300 |
48,42 |
9,990 |
1,480 |
89,07 |
20,92 |
|
1,125 |
21,59 |
3,854 |
1,305 |
49,21 |
10,19 |
1,485 |
91,13 |
21,48 |
|
1,130 |
22,38 |
4,012 |
1,310 |
50,00 |
10,39 |
1,490 |
93,49 |
22,11 |
|
1,135 |
23,16 |
4,171 |
1,315 |
50,85 |
10,61 |
1,495 |
95,46 |
22,65 |
|
1,140 |
23,94 |
4,330 |
1,320 |
51,71 |
10,83 |
1,500 |
96,73 |
23,02 |
|
1,145 |
24,71 |
4,489 |
1,325 |
5 52,56 |
11,05 |
1,502 |
97,23 |
23,18 |
|
1,150 |
25,48 |
4,649 |
1,330 |
5 53,41 |
11,27 |
1,504 |
97,74 |
23,33 |
|
1,155 |
26,24 |
4,810 |
1,335 |
54,27 |
11,49 |
1,505 |
97,99 |
23,40 |
|
1,160 |
27,00 |
4,970 |
1,340 |
55,13 |
11,72 |
1,506 |
98,25 |
23,48 |
|
1,165 |
27,76 |
5,132 |
1,345 |
56,04 |
11,96 |
1,508 |
98,76 |
23,63 |
|
1,170 |
28,51 |
5,293 |
1,350 |
56,95 |
12,20 |
1,510 |
99,26 |
23,79 |
|
1,175 |
29,25 |
5,455 |
1,355 |
57,87 |
12,44 |
1,513 |
100,0 |
24,01 |
Правила определения промежуточных значений плотности и
концентраций по имеющимся значениям таблицы
Наиболее простой способ графический. Строится график зависимости плотности от концентрации в ближайшем диапазоне искомых значений. А затем по графику по заданной величине концентрации определяют соответствующее значение плотности. Или, наоборот, по плотности находят концентрацию.
Существует и расчетный метод интерполяции – определение промежуточного значения по двум крайним. Формула расчета концентрации
Сх= С1+ (С2-С1)х (ρх - ρ1)/ (ρ2 - ρ1), отсюда формула расчета плотности
ρх = ρ1+(ρ2 - ρ1)х(Сх-С1)/ (С2-С1)
Пример 1. Определить плотность (ρх) 10% раствора серной кислоты.
По таблице находим самые близкие значения (одно больше, второе меньше) от искомого Сх=10%.
С1=9,259%, ρ1 = 1,050 г/см3.
С2=10,12%, ρ2 = 1,055 г/см3
ρх = 1,050+(1,055-1,050)х (10-9,259)/ (10,12-9,259)=1,054 г/см3.
Ответ. Плотность 10% раствора серной кислоты составляет
ρх = 1,054 г/см3.
Пример 2. Определить концентрацию раствора серной кислоты, если величина измеренной плотности составляет ρх= 1,237 г/см3.
По таблице находим самые близкие значения (одно больше, второе меньше) от искомого ρх= 1,237 г/см3.
ρ1 = 1,235 г/см3, С1=38,25%
ρ2 = 1,240 г/см3, С2=39,02%,
Сх = 38,25+(39,02-38,25)х (1,237-1,235)/ (1,240-1,235)=38,558%.
Ответ. Плотность ρх = 1,237 г/см3 имеет раствор серной кислоты с концентрацией Сх = 38,558%.
Практическая работа № 6
ОПРЕДЕЛЕНИЕ ВЛАГИ В СЫПУЧЕМ МАТЕРИАЛЕ
Отрабатываемые операции:
Взвешивание
Работа с сушильным шкафом
Для проведения работы необходимы:
- весы технические с точностью измерения 0,01 г,
- бюкс,
- сушильный шкаф,
- эксикатор,
- исследуемый сыпучий материал.
Ход выполнения работы.
-
Взвесить пустой сухой бюкс с крышкой.
-
В бюкс помещают 1- 10 г анализируемого материала и взвешивают закрытый бюкс.
-
Бюкс с навеской анализируемого материала ставят в разогретый до 105 оС на 40-60 минут, крышку вставляют ребром в бюкс.
-
После первой сушки бюкс закрывают крышкой вынимают из сушильного шкафа и помещают в эксикатор на 20 мин для остывания до комнатной температуры.
Вынимать горячий бюкс из сушильного шкафа нужно специальными щипцами или с помощью полотенца.
-
Бюкс с содержимым взвешивают. Массу навески определяют по разности массы бюкса с веществом и пустого бюкса.
-
Бюкс повторно помещают в сушильный шкаф на 20-30 минут. Затем вынимают, остужают и взвешивают.
-
Затем бюкс снова помещают в сушильный шкаф на 15-20 минут,
вынимают, остужают и взвешивают.
|
Расчет проводят, если масса навески между 2-мя взвешиваниями изменяется не более чем на 0,0002г. Если разница больше, операцию сушки и взвешивания повторяют. |
Расчет массовой доли влаги в процентах %Н2О вычисляют по формуле:
х = (g-g1 )х100/ g , где
g и g1 - масса анализируемой пробы до и после сушки в г..
Практическая работа № 7
ИЗУЧЕНИЕ ПРОЦЕССА ЭКСТРАКЦИИ ОРГАНИЧЕСКИМИ РАСТВОРИТЕЛЯМИ.
ЭКСТРАКЦИЯ ИОДА ИЗ ВОДНОГО РАСТВОРА
Отрабатываемые операции:
Работа с делительной воронкой
Экстракция
Для проведения работы необходимы:
-
делительная воронка, 2 стакана,
-
раствор йода
-
органический неполярный растворитель (масло).
Ход выполнения работы.
1. Приготовить раствор йода, добавив несколько капель йодной настойки в стакан с водой.
2. Часть раствора залить в делительную воронку.
3. Добавить масло в соотношении 1:1.
4. Перемешать содержимое воронки энергичным встряхиванием..
5. Дать время для расслоения масляной и водной части.
7. Слить нижнюю водную часть в стакан.
8. Сравнить цвет первоначального и образовавшегося растворов.
|
Экстракция – извлечение йода сопровождается эффектом обесцвечивания исходного водного раствора. |
Практическая работа № 8
ПЕРЕКРИСТАЛЛИЗАЦИЯ ВОДОРАСТВОРИМОГО ВЕЩЕСТВА
Получить задание у преподавателя.
Примерное задание. Получить перекристаллизацией 20 г нитрата натрия.
Если в задании не указан температурный интервал, насыщение проводят при 100 оС. Охлаждение же ведут под струей холодной воды или же в тающем льде (0оС).
1.Находим в справочной литературе растворимость NaNО3
при 100 оС - 184,5 г/100 г воды,
при 20 оС -88,0 г/100 г воды.
2. Необходимо рассчитать необходимое количество соли и растворителя для получения заданного количества вещества.
Их 100 г насыщенного при 100 оС раствора при охлаждении до 20 оС может выкристаллизоваться 184,5-88,0=96,5 г нитрата натрия.
Для получения 20 г в насыщенном растворе при 100 оС должно находиться
184,5 г – 96,5 г
х - 20 г х = 184,5*20/96,5 = 38,2 г.
Для насыщения этого количества соли необходимо взять воды
100 г -184,5 г
у - 38,2 г у = 100*38,2/184,5 = 20,7 г.
3. Взвесьте 38,2 г соли, всыпьте в стакан на 100 мл. Влейте чуть больше 20,7 мл воды ( с учетом на испарение при кипении).
4. Стакан с солью поставьте на асбестовую сетку и нагревайте на горелке или плитке до кипения.
5. Если раствор мутный или имеются инородные примеси, профильтруйте его горячим через воронку для горячего фильтрования с бумажным фильтром.
6. Фильтрат собирайте в чистый стакан. Горячий раствор сливайте порциями по стеклянной палочке в воронку. После того, как весь раствор отфильтрован, часть раствора перелейте в первый стакан и нагрейте до кипения и вылейте его на воронку. При этом часть кристаллов, которые образовались на воронке перейдут в раствор.
7. Стакан с профильтрованным раствором поставьте в холодную воду. Раствор перемешивайте стеклянной палочкой до полного охлаждения.
9. Кристаллы высушите с помощью фильтровальной бумаги, а затем на воздухе разложив их на сухую бумагу.
10. Взвесьте сухие кристаллы. Рассчитайте выход в %.
Например, получилось 19,2 г, следовательно, выход составит:
19,2/20*100 = 96%.
Задания к практической работе 8.
1. Получить перекристаллизацией 35 г нитрата натрия
2. Получить перекристаллизацией 28 г нитрата натрия
3. Получить перекристаллизацией 16 г нитрата натрия
4. Получить перекристаллизацией при 60оС 20 г бихромата калия К2Сr2О7 (растворимость при 20оС -13,1, при 60оС -50,5 г на 100 г воды)
5. Получить перекристаллизацией при 70оС 25 г бихромата калия К2Сr2О7 (растворимость при 20оС -13,1, при 70оС -61,5 г на 100 г воды)
6. Получить перекристаллизацией при 50оС 10 г нитрата калия КNO3 (растворимость при 20оС -31,6, при 50оС -85,5 г на 100 г воды)
7. Получить перекристаллизацией при 60оС 20 г нитрата калия КNO3
(растворимость при 20оС -31,6, при 60оС -110,0 г на 100 г воды)
8. Получить перекристаллизацией при 70оС 25 г нитрата калия КNO3
(растворимость при 20оС -31,6, при 70оС -138,0 г на 100 г воды)
Практическая работа № 9
ВОЗГОНКА
Отрабатываемые операции:
Работа со спиртовкой
возгонка
Для проведения работы необходимы:
-
воронка,
-
фарфоровая чашка,
-
термостойкий стакан,
-
круглодонная колба с водой.
Очистка хлорида аммония.
Берут небольшую порцию загрязненного хлорида аммония и высыпают в сухую фарфоровую чашку. Накрывают чашку перевернутой воронкой и нагревают над горелкой. При нагревании хлорид аммония разлагается на аммиак и хлористый водород, но образуется снова на стенках воронки. Чистый хлористый аммоний счищают или смывают со стенок воронки.
О чистка
иода.
чистка
иода.
Берут 1 г иода. 0,1 г иодида калия и 0,2 г оксида кальция. Смесь перемешиваю и помещают в стакан, который закрывают сосудом с водой. Прибор осторожно нагревают над горелкой. Кристаллы иода образуются на стенках сосуда с водой, их счищают и взвешивают. Рассчитывают выход кристаллов в процентах от взятого количества.
Практическая работа № 10
ЗНАКОМСТВО С «ИМЕННОЙ» ПОСУДОЙ
 Арбузова
колба –
применяется
при перегонке жидкостей под уменьшенным
давлением. Конструкция исключает
попадание жидкости в приемник. Колбы
выпускаются промышленностью емкостью
от 20 до1000 мл.
Арбузова
колба –
применяется
при перегонке жидкостей под уменьшенным
давлением. Конструкция исключает
попадание жидкости в приемник. Колбы
выпускаются промышленностью емкостью
от 20 до1000 мл.
А рбузов
Александр Ерминингельдович
– химик-органик, академик АН СССР
(1877-1968 г.г.)
рбузов
Александр Ерминингельдович
– химик-органик, академик АН СССР
(1877-1968 г.г.)
Аллина холодильник – обратный холодильник с внутренней трубкой (форштоссом), состоящей из шарообразных расширений для увеличения поверхности контакта, служит для конденсации паров и возврата их в реактор. Обратные холодильники устанавливают в вертикальном положении.
Б унзена
колба
– коническая колба с верхним тубусом
из толстого стекла предназначена для
отсасывания- фильтрования под вакуумом.
При фильтровании больших количеств
жидкости удобнее пользоваться колбами
Бунзена с нижним краном.
унзена
колба
– коническая колба с верхним тубусом
из толстого стекла предназначена для
отсасывания- фильтрования под вакуумом.
При фильтровании больших количеств
жидкости удобнее пользоваться колбами
Бунзена с нижним краном.
Б унзен
Роберт Вильгельм
– немецкий
химик, член-корр. Петербургской АН
(1811-1899 г.г.).
унзен
Роберт Вильгельм
– немецкий
химик, член-корр. Петербургской АН
(1811-1899 г.г.).
Бюхнера воронки применяются для фильтрования под вакуумом, изготавливают из фарфора. Они различаются по диаметру, высоте и количеству отверстий на фильтрующей поверхности.
Бюхнер (Бухнер) Эдуард – немецкий химик и биолог, лауреат Нобелевской премии 1907 г.(1860-1917 г.г.).
В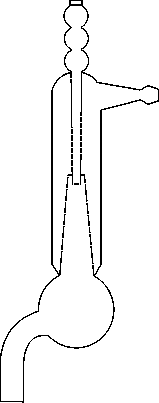
 етцеля
водоструйный насос
предназначен для
создания вакуума с помощью струи воды.
Его применяют для ускорения фильтрования,
при перегонке для создания вакуума над
кипящей жидкостью. Верхний конец через
резиновую трубку соединяют с водопроводным
краном. На боковой отросток надевают
толстостенную резиновую (вакуумную)
трубку и соединяют с прибором, в котором
создают вакуум. Между насосом и сосудом
должна быть предохранительная склянка
Вульфа.
етцеля
водоструйный насос
предназначен для
создания вакуума с помощью струи воды.
Его применяют для ускорения фильтрования,
при перегонке для создания вакуума над
кипящей жидкостью. Верхний конец через
резиновую трубку соединяют с водопроводным
краном. На боковой отросток надевают
толстостенную резиновую (вакуумную)
трубку и соединяют с прибором, в котором
создают вакуум. Между насосом и сосудом
должна быть предохранительная склянка
Вульфа.
Вульфа склянки могут быть с 2 или 3 горлами. Основное назначение – предохранительный сосуд при вакуумных насосах. Эти склянки можно также применять в качестве реакционных сосудов для получения и промывки газообразных продуктов. Склянки Вульфа большой емкости можно использовать для хранения титрованных растворов. Иногда склянки имеют в нижней части тубус.
В ульф
Питер (1727-1807 г.г.),
известен тем, что в 1771 г. получил пикриновую
кислоту..
ульф
Питер (1727-1807 г.г.),
известен тем, что в 1771 г. получил пикриновую
кислоту..
Вюрца колба – специальная колба с длинным боковым отводом под углом для перегонки жидкостей. Трубка может быть расположена на различном расстоянии от шарообразной части колбы.
Вюрц Шарль Адольф – французский химик-органик (1817- 1884 г.г.).
 Д
Д рекселя
склянки
с насадкой
служат для промывки, очистки и улавливания
газов. Для этого в склянку не больше
чем наполовину наполняют соответствующей
жидкостью, затем плотно закрыв пробку,
соединяют трубку, доходящую до дна, с
источником газа.
рекселя
склянки
с насадкой
служат для промывки, очистки и улавливания
газов. Для этого в склянку не больше
чем наполовину наполняют соответствующей
жидкостью, затем плотно закрыв пробку,
соединяют трубку, доходящую до дна, с
источником газа.
К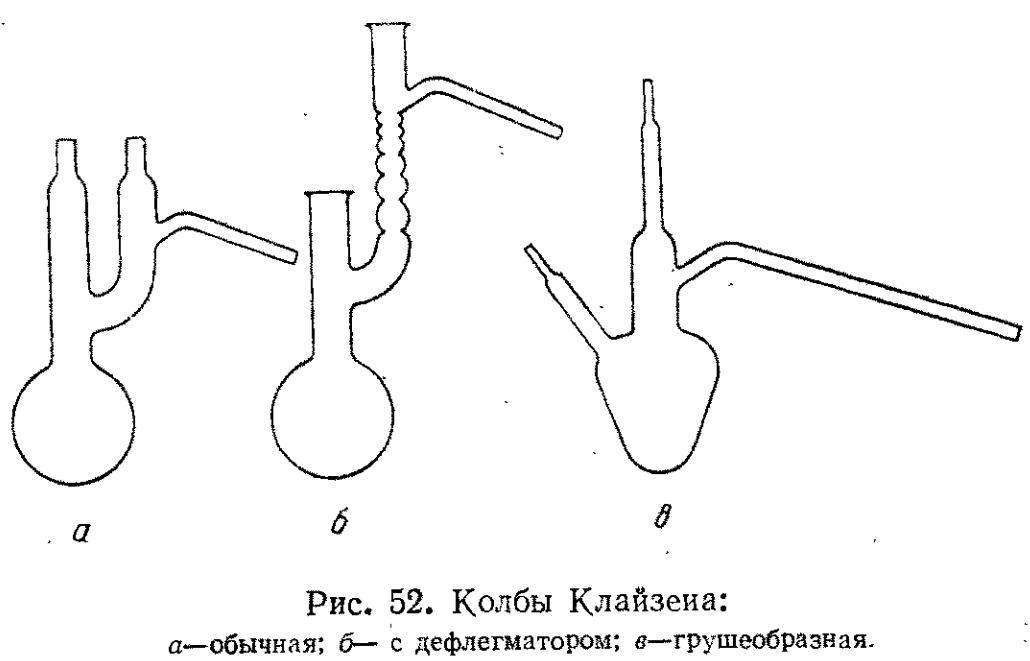 лайзена
колбы применяют
при перегонке в вакууме. Они могут быть
обычными (а) или с дефлегматором (б). Для
перегонки небольших количеств жидкости
применяют грушеобразную колбу (в).
лайзена
колбы применяют
при перегонке в вакууме. Они могут быть
обычными (а) или с дефлегматором (б). Для
перегонки небольших количеств жидкости
применяют грушеобразную колбу (в).
К лайзен
(Кляйзен) Людвиг Райнер – немецкий
химик-органик (1851-1930 г.г.). Особую колбу
для перегонки под вакуумом предложил
использовать в 1893 г.
лайзен
(Кляйзен) Людвиг Райнер – немецкий
химик-органик (1851-1930 г.г.). Особую колбу
для перегонки под вакуумом предложил
использовать в 1893 г.
Либиха холодильники - приборы для охлаждения и конденсации паров, прямые холодильники - трубка в трубке (1-форштос, 2-рубашка, 3- соединительные резиновые трубки, 4 – отростки. Могут иметь резиновые муфты или шлифы, устанавливаются наклонно.
Либих Юстус - немецкий химик-органик (1803-1873 г.г.). Хлодильник был предложен в 1771 г. Вейгелем, а использован Либихом, поэтому его называют также холодильником Вейгеля-Либиха.
М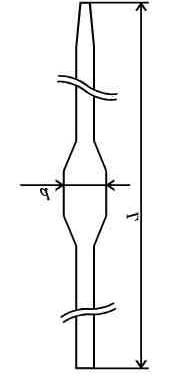 ора
пипетка с
меткой служит для точного отмеривания
определенного объема жидкости. Пипетки
могут быть прямыми на 1, 2 мл или с
расширением на 1-200 мл.
ора
пипетка с
меткой служит для точного отмеривания
определенного объема жидкости. Пипетки
могут быть прямыми на 1, 2 мл или с
расширением на 1-200 мл.
Мор Карл Фридрих – немецкий химик-аналитик (1806-1879 г.г.). Кроме пипетки сконструировал бюретку, зажим и рычажные весы, предназначенные для определения плотности жидкостей и твердых тел методом гидростатического взвешивания. Разработал метод определения серебра (метод Мора).
П

 етри
чашка –
лабораторная посуда имеет форму
невысокого плоского цилиндра, закрывается
крышкой подобной же формы, но несколько
большего диаметра. Применяется для
взвешивания на аналитических весах,
испарения и хранения химических веществ
и мелких предметов. Изобретена в 1877 г.,
названа в честь немецкого микробиолога
Юлиуса Рихарда
Петри (1852-1921
г.г.), ассистента немецкого микробиолога
Роберта Коха
(1843- 1910 г.г.).
Чашка Коха
применяется для тех же целей, но имеет
крышку с ручкой в виде
етри
чашка –
лабораторная посуда имеет форму
невысокого плоского цилиндра, закрывается
крышкой подобной же формы, но несколько
большего диаметра. Применяется для
взвешивания на аналитических весах,
испарения и хранения химических веществ
и мелких предметов. Изобретена в 1877 г.,
названа в честь немецкого микробиолога
Юлиуса Рихарда
Петри (1852-1921
г.г.), ассистента немецкого микробиолога
Роберта Коха
(1843- 1910 г.г.).
Чашка Коха
применяется для тех же целей, но имеет
крышку с ручкой в виде
бусины.
Сокслета холодильник – сферический холодильник применяется чаще как обратный холодильник. Пар проходит между наружной стенкой холодильника, охлаждаемой воздухом, и наружной стенкой внутреннего шара, через который циркулирует хладаагент. Используется также для перегонки жидкостей с высокой температурой кипения.
Сокслет Франц – немецкий химик. Изобрел также встряхиватель для перемешивания с мотором, известный как встряхиватель Сокслета.
 Тищенко
склянки – стеклянные
приборы для промывки и осушки газов с
помощью жидкого поглотителя (а) и твердого
(б). Внутри емкости имеется перегородка.
Тищенко
склянки – стеклянные
приборы для промывки и осушки газов с
помощью жидкого поглотителя (а) и твердого
(б). Внутри емкости имеется перегородка.
Тищенко Вячеслав Евгеньевич – советский химик, академик АН СССР ( 1851-1941 г.г.)
Разработал рецептуру стекла для химической посуды.
 Шотта
фильтр - воронки с
впаянным пористым стеклянным фильтром
для фильтрации под вакуумом, которые
различаются по классам:
Шотта
фильтр - воронки с
впаянным пористым стеклянным фильтром
для фильтрации под вакуумом, которые
различаются по классам:
- ПОР -160 с размером пор 100-160 мкм для грубозернистых и студнеобразных осадков;
- ПОР -100 с размером пор 40-100 мкм для кристаллических осадков,
- ПОР -40 с размером пор 16-40 мкм для мелкокристаллических осадков,
- ПОР -16 с размером пор 10-16 мкм для тонкодисперсных осадков.
Шотт Фридрих Отто – немецкий химик (1851- 1935 г.г. создал многие виды специальных стекол.
 Шустера
капельница
– маленький по объему сосуд с клювиком
служит для капельного дозирования
растворов, например индикаторов.
Шустера
капельница
– маленький по объему сосуд с клювиком
служит для капельного дозирования
растворов, например индикаторов.
