
- •1.Випаровування вологи і розкладання карбонатів в доменній печі.
- •2.Стандартна хімічна спорідненість металів до кисню, сірки галогенів. Взаємозв'язок спорідненості і окислювально-відновних процесів
- •3. Закономірності вуглетермічних відновних процесів
- •4. Фазові рівноваги в двокомпонентних системах. Діаграми плавкості. Правило важеля
- •5.Метод ентропії розрахунку константи рівноваги хімічних реакцій
- •6. Хімічні реакції металургійних процесів. Оцінка мимовільності їх протікання. Рівняння ізотерми Вант- Гоффа
- •7. Хімічна рівновага і константа рівноваги металургійних процесів. Рівноважні концентрації
- •8. Основи теорії металотермії
- •9. Рухливість хімічної рівноваги. Принцип Ле Шательє. Рівняння ізохори та ізобари Вант - Гоффа
- •10. Відновлення оксидів металів за допомогою со і н2
- •11.Закономірності відновних процесів в системах з розчинами
- •12. Основи теорії окислювального рафінування металів від домішок
- •13.Теоретичні основи процесів розкислювання сталі
10. Відновлення оксидів металів за допомогою со і н2
Відновлення оксидів металів газами відбувається за реакціями:
![]()
![]()
В
даному випадку
![]() є невідомим, тобто невідомими є умови
відновлення. Аналіз можна виконати,
якщо зпівставити між собою дві простіші
реакції:
є невідомим, тобто невідомими є умови
відновлення. Аналіз можна виконати,
якщо зпівставити між собою дві простіші
реакції:


![]()
![]()
Отже,
бачимо, що
![]() . Аби реакція відновлення могла йти
вправо, необхідно, аби
. Аби реакція відновлення могла йти
вправо, необхідно, аби
![]() було негативне. Це може бути досягнуто,
якщо
було негативне. Це може бути досягнуто,
якщо
![]() буде більш негативне, ніж величина
буде більш негативне, ніж величина![]() ,
значить, у СО(Н2)
спорідненість до кисню має бути більшою,
ніж у металу.
,
значить, у СО(Н2)
спорідненість до кисню має бути більшою,
ніж у металу.
Розглянемо три крайні випадки відновлення оксидів металу газами залежно від співвідношення між спорідненістю металу до кисню і спорідненістю відновника СО (Н2) до кисню.
1. Спорідненість в металу і СО (Н2) до кисню приблизно однакові.
Таким
чином
![]() ,
,
Значить
![]()
Тому
![]()
Це означає, що в рівноважній газовій фазі вміст СО і СО2 приблизно однаковий.

У відновній газовій суміші вміст СО повинен бути більше, ніж в рівноважній (див. точку “б”). Якщо газова суміш має склад в точці “в”, то відновний процес не можливий, а навпаки, може мати місце окислення металу.
Якщо
в газовій фазі міститься лише два гази,
то
![]() .
.
В
цьому випадку
 .
.
В
даному випадку маємо рівняння з одним
невідомим, з якого знаходимо
![]() .
.
![]() в
тому випадку, якщо коефіцієнти перед
СО і СО2
рівні.
в
тому випадку, якщо коефіцієнти перед
СО і СО2
рівні.
2. Спорідненість металу до кисню набагато менше спорідненості СО до кисню.
Таким
чином
![]()
![]()
![]()
![]() .
В цьому випадку сильно негативна
величина, отже константа рівноваги буде
великою величиною.
.
В цьому випадку сильно негативна
величина, отже константа рівноваги буде
великою величиною.

![]()
![]()
Це означає, що в рівноважному газі доля СО2 значно перевищує долю СО.
3. Спорідненість в металу до кисню значно вище, ніж в СО.
Таким
чином
![]()
![]()
![]() .
В цьому випадку величина
.
В цьому випадку величина
![]() буде величиною позитивною, а константа
рівноваги буде дуже маленькою величиною.
буде величиною позитивною, а константа
рівноваги буде дуже маленькою величиною.

![]()
![]()
Це означає, що в рівноважній газовій фазі доля СО складає практично 100 %.
Ця схема аналізу є основою класифікації оксидів по відновлюваності:
I група – середньовідновлювані оксиди – FеO, SnO, MoO, ZnO.
II група – легковідновлювані оксиди – NiO, CuO, PbO, MgO.
III група – важковідновлювані оксиди – MnO, Al2O3, CaO, V2O3
Гази СО та Н2 мають практично однакові відновні властивості, тому що спорідненість до кисню у них майже однакова. Аналіз необхідних відновних сумішей показує, що газами СО і Н2 раціонально відновлювати середньо- і легковідновлювані оксиди металів, а важковідновлювані оксиди краще відновлювати твердим вуглецем або металом – відновником.
11.Закономірності відновних процесів в системах з розчинами
В більшості випадків чисті речовини при підвищенні температури беруть участь в реакціях лише в певних долях від сумарного процесу. Надалі оксиди можуть переходити в шлак (розчини), а метали – розчинятися один в одному. Доля процесів за участю речовин в чистому вигляді і за наявності розчинів залежить від:
- складу шихти;
- швидкості реакції відновлення;
- швидкості процесів шлакоутворення;
- температури ведення процесів.
Вплив наявності розчинів в системі на результат процесу оцінюють, порівнюючи між собою реакції між чистими речовинами і реакції з розчинами.
Розглянемо відновні процеси в системах з розчинами. (Як відновник використовуємо газ СО).
Реакція між чистими речовинами:
![]()
![]()

Оксид є чистою фазою, а метал здатний розчинятися в іншому металі з утворенням розчину.
![]()
![]()

Якщо
речовини однакові в реакціях, і якщо
мають місце одні й ті ж температури,
тоді
![]() ,
це означає, що
,
це означає, що
![]() .
.
Порівнявши ці два варіанти отримуємо:

Отже:

оскільки
величина
![]() ,
то
,
то

Це означає, що, коли метал переходить в розчин, то в рівноважному газі міститиметься більше СО2 в порівнянні з реакцією між чистими речовинами.

Рівноважні криві для процесів відновлення, що супроводяться переходом металу в розчин, завжди відповідають вищим концентраціям СО2 (малюнок). Якщо метал здатний розчинятися в іншому металі, то умови його відновлення з оксиду полегшуються. Якщо сировина багатокомпонентна, то чистий метал отримати з нього неможливо, завжди виходитиме або сплав, або метал, що містить домішки.
Метал знаходиться в чистому вигляді, оксид знаходиться у шлаку.
![]()
![]()
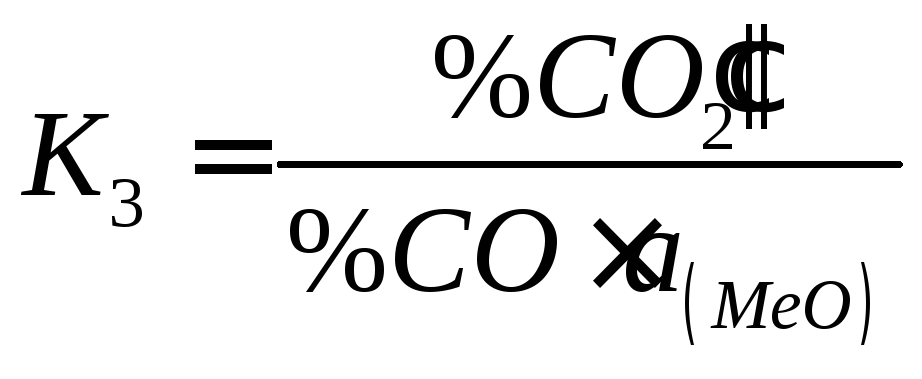
В
даному випадку маємо, що
![]() ,
тобто
,
тобто

Оскільки
![]() ,
тоді отримуємо
,
тоді отримуємо
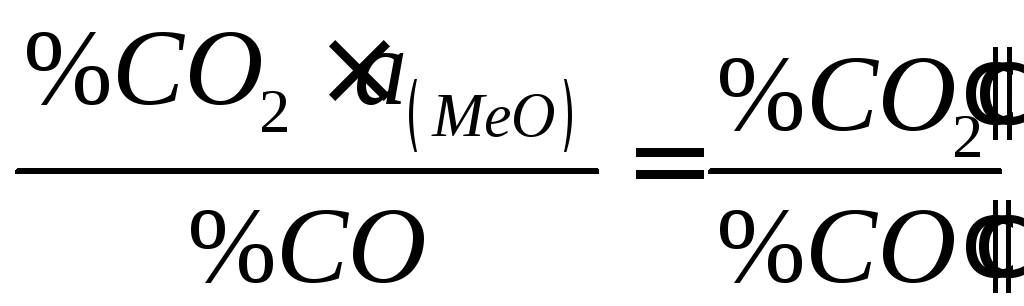
Отже
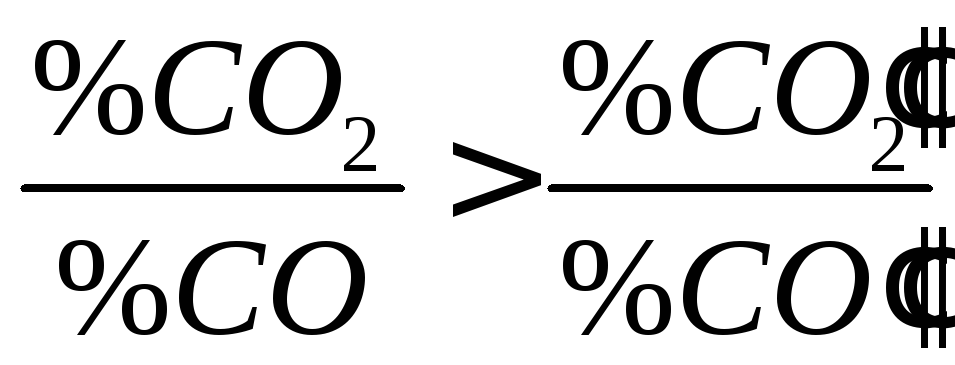
Це означає, що в рівноважному газі в системі, де оксид знаходиться у шлаку, доля СО буде більше, ніж в реакції з чистими речовинами.
Чим менше оксиду залишається у шлаку, тим вище має бути доля СО в рівноважному газі, тим вище має бути концентрація СО у відновній суміші. Таким чином, якщо оксид знаходиться у шлаку, то він відновлюється важче, і тим важче, чим менше його залишається у шлаку. Теорія говорить про те, що оксид з шлаку повністю відновити неможливо.
