
- •1.Випаровування вологи і розкладання карбонатів в доменній печі.
- •2.Стандартна хімічна спорідненість металів до кисню, сірки галогенів. Взаємозв'язок спорідненості і окислювально-відновних процесів
- •3. Закономірності вуглетермічних відновних процесів
- •4. Фазові рівноваги в двокомпонентних системах. Діаграми плавкості. Правило важеля
- •5.Метод ентропії розрахунку константи рівноваги хімічних реакцій
- •6. Хімічні реакції металургійних процесів. Оцінка мимовільності їх протікання. Рівняння ізотерми Вант- Гоффа
- •7. Хімічна рівновага і константа рівноваги металургійних процесів. Рівноважні концентрації
- •8. Основи теорії металотермії
- •9. Рухливість хімічної рівноваги. Принцип Ле Шательє. Рівняння ізохори та ізобари Вант - Гоффа
- •10. Відновлення оксидів металів за допомогою со і н2
- •11.Закономірності відновних процесів в системах з розчинами
- •12. Основи теорії окислювального рафінування металів від домішок
- •13.Теоретичні основи процесів розкислювання сталі
7. Хімічна рівновага і константа рівноваги металургійних процесів. Рівноважні концентрації
Після початку реакції хімічний потенціал одних речовин зменшується, інших – збільшується, настає їх рівність, тобто хімічна рівновага.
У
рівноважному стані
![]() реакції стає рівним нулю, концентрації
речовин стають рівноважними, і їх
співвідношення можна виразити через
конкретну величину, яка називається
константою рівноваги.
реакції стає рівним нулю, концентрації
речовин стають рівноважними, і їх
співвідношення можна виразити через
конкретну величину, яка називається
константою рівноваги.
Для рівноважного стану можна записати:
![]()
константа
рівноваги рівна:

В разі, якщо Кр>1 – це означає, що продуктів реакції більше, ніж вихідних речовин, якщо Кр<1, то відповідно, навпаки. Якщо ж Кр=1, то концентрації речовин при рівновазі приблизно однакові.
За величиною константи рівноваги можна якісно судити про повноту протікання процесу. Окрім цього, знаючи величину Кр, можна розрахувати рівноважні концентрації для більшості 2-х і більш компонентних сумішей. У рівноважній системі встановлюється постійне співвідношення між мікрочастками різних речовин учасників реакції. Щільність матеріальних часток і їх енергій за об'ємом системи або за окремими фазами встановлюється постійною. Константа рівноваги, що обчислюється з рівняння (1), обов'язково повинна виражатися або через парціальний тиск, або через активність речовин в розчині, або через те і інше. В той же час, концентрації речовин, особливо газів, часто зручно виражати іншими величинами: через молярні долі, об'ємні відсотки, молярність (число молей на літр). У цих випадках для однієї і тієї ж реакції в цифровому відношенні константи можуть відрізнятися, але між ними, природно, існує взаємозв'язок.
Приклад:

![]()
![]() -
Рівноважні парціальні тиски речовин в
газовій суміші.
-
Рівноважні парціальні тиски речовин в
газовій суміші.
![]() -
загальний тиск суміші.
-
загальний тиск суміші.
Виразимо
константу рівноваги через молярні долі.
У рівноважному стані маємо
![]() відповідно
відповідно
![]() загальне число молей в суміші. Знайдемо
молярні долі кожної речовини в рівноважному
газі
загальне число молей в суміші. Знайдемо
молярні долі кожної речовини в рівноважному
газі



![]()
Зв'язок між парціальними тисками і мольними долями має вигляд:
![]()
![]()
![]()
З даних залежностей знайдемо:

Таким чином, зв'язок між константою рівноваги, вираженою через парціальні тиски, і константою рівноваги, вираженою через молярні долі, носить наступний характер:
![]()
![]() -
різниця між стехіометричними коефіцієнтами
в газах, що стоять справа і зліва від
знаку рівності в даному випадку:
-
різниця між стехіометричними коефіцієнтами
в газах, що стоять справа і зліва від
знаку рівності в даному випадку:
![]()
Знайдемо константу рівноваги через об'ємні відсотки:


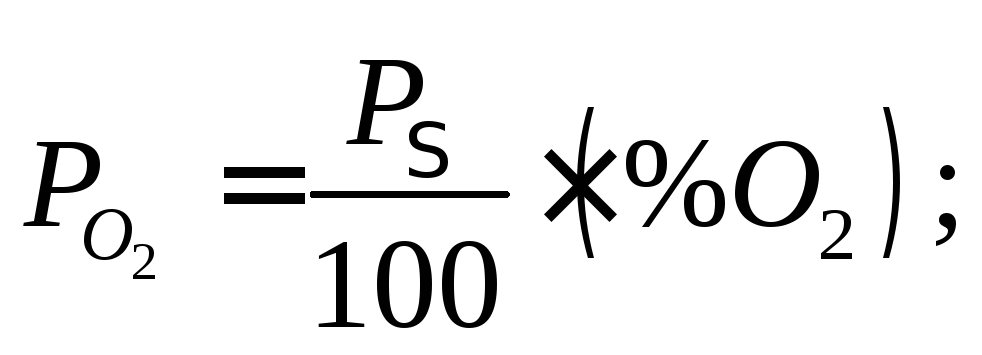

Таким
чином, зв'язок між Kp
та Kc
виглядає так:
Знайдемо константу рівноваги через молярність:
Використовуємо
рівність
![]() ,
,
де ![]() кількість молей речовини
кількість молей речовини
![]() загальний
об'єм, виражений в літрах.
загальний
об'єм, виражений в літрах.
Тоді
![]()
Для кожного газу в рівноважній системі маємо:
![]()
![]()
![]()

Таким
чином, зв'язок між Кр
та Кс
має вигляд:
![]()
Отже, взаємозв'язок між константами рівноваги виглядає таким чином:

8. Основи теорії металотермії
Металотермічні процеси – процеси, в яких як відновник використовують інший метал, той в якому спорідненість вища, ніж у відновлюваного. При цьому керуються наступним:
Бажано, аби відмінність в спорідненості була максимально великою;
Метал – відновник має бути доступним і відносно дешевим;
У металотермії відновлювана частина шихти і відновник максимально повно перемішуються між собою, тому розміри часток відновника і відновлюваної руди (концентрату) мають бути невеликими.
Найширше поширена алюмінотермія. Al застосовують в гранулах або порошкоподібний.
Поширення знайшла і силікотермія. Si (сплави на його основі Si-Mn, Fe-Si, Si-Cr, Si-Ca) – крихкий матеріал, він легко подрібнюється.
Застосовують також як відновник і Mg, який використовують в рідкому вигляді.
В основному, вибір металу – відновника у металотермії здійснюють по величині питомої теплоти процесу. Всі реакції металотермії – екзотермічні. Тепло реакцій може виявитися достатнім для розігрівання вихідних речовин і продуктів, а може і ні. Принцип достатності заснований на практичному правилі Жемчужного, згідно якому реакція самозабеспечує себе теплом, якщо на 1кг шихтової суміші або продуктів виділяється не менше 550 ккал тепла:

де
![]() - тепловий ефект реакції при певній
температурі
- тепловий ефект реакції при певній
температурі
![]() -
сума молекулярних мас речовин, що
вступають в реакцію або утворюються.
-
сума молекулярних мас речовин, що
вступають в реакцію або утворюються.
![]() -
критерій самозабеспеченості процесу
теплом, і, одночасно, критерій можливості
протікання реакції, оскільки безпосередньо
коригується з величиною
-
критерій самозабеспеченості процесу
теплом, і, одночасно, критерій можливості
протікання реакції, оскільки безпосередньо
коригується з величиною
![]() .
.
Реакція металотермії в загальному вигляді виглядає так:
![]()
Речовини зліва і праворуч від знаку рівності подібні, тому різниця S невелика, і величина G з практичною прийнятністю збігається з H0.
Можливість реакції металотермії можна було б розрахувати по одному з відомих методів:
Ентропії:
![]()
По приведеному потенціалу
![]()
Також
по методу Темкіна – Шварцмана та ін.
Якщо
![]() ,
то таку реакцію називають автогенною,
якщо ж тепла не вистачає, то необхідно
приймати додаткові заходи (підводити
тепло), в основному це енергія електричної
дуги, рідше – індукційне підігрівання.
,
то таку реакцію називають автогенною,
якщо ж тепла не вистачає, то необхідно
приймати додаткові заходи (підводити
тепло), в основному це енергія електричної
дуги, рідше – індукційне підігрівання.
В деяких випадках в шихту додають легковідновлювані оксиди, але в цьому випадку отримують сплав. Якщо ж тепла багато, то в шихту додають інертні матеріали (флюси): CaCO3; MgCO3; CаO; Ca,Mg(CO3)2 і так далі
Металотермічні процеси можуть бути таких типів:
Плавка на випуск
Плавка на блок
Одним з видів металотермії є процес здобуття губчастого титану: на поверхню рідкого магнію вдувається газоподібний TiCl4
![]()
Широко використовується металотермія в урановій промисловості:
![]()
