
- •Титульный лист Оглавление
- •Список вопросов на экзамен на бакалавра
- •Тмп и физ. Химия
- •Металлургия цветных металлов
- •Качественная схема обогащения руды
- •Украинский деловой язык
- •Пояснювальна записка
- •Стандартизация и метрология
- •Экономика
- •Охрана труда и безопасность жизнедеятельности
- •Вопрос 10: Категории помещений по пожарной и взрывопожарной опасности.
- •Вопрос 11: Защита от вибрации. Защита от общей и локальной вибрации.
- •Вопрос 13. Защита от тепловых воздействий: теплоизоляция, экранирование, другие способы.
- •Вопрос 14.Защита от электрического тока: защита от прикосновения к токоведущим частям, заземление, зануление, сиз.
- •Вопрос 15. Искусственное освещение, его виды, системы, нормирование.
- •Вопрос 16. Вентиляция. Ее назначения, виды.
- •Вопрос 17. Воздушная среда. Микроклимат и чистота воздуха.
- •Вопрос 18. Технические нормативы: конструктивные, габаритно – планировочные, параметрические.
- •Вопрос 19. Гигиенические нормативы. Санитарные нормы.
- •Вопрос 20. Проведение работ. Система допусков, когда применяется, что включает в себя.
- •Вопрос 21. Классификация методов охраны труда. Организационные, санитарные, технические методы, индивидуальная защита.
- •Вопрос 22. Вредные и опасные факторы производства. Последствия
- •Вопрос 23. Дать определение инженерной охране труда. Основные определения. Несчастные случаи, травмы, увечья, проф. Заболевания.
- •Вопрос 24. Требования охраны труда к территории предприятия. Санитарно-защитная зона. Ее размеры для различных классов предприятия.
- •Вопрос 25. Нервная система как система защиты от опасности. Анализаторы: зрительный, слуховой, тактильный.
- •Металлургия чёрных металлов
- •Вопрос № 2. Методы загрузки доменной печи.
- •История Украины Вопрос № 1. Происхождение славян.
- •Вопрос № 1. Культура Киевской Руси.
- •Основы экономической теории
- •Задания
- •Тема: Термодинамические свойства индивидуальных веществ
- •Варианты заданий:
- •Тема: Тепловой эффект химических реакций.
- •Тема: Расчет константы химического равновесия и равновесного состава газовой фазы
- •Варианты химических реакций и температур, в результате протекания которых достигаются равновесные состояния
- •Тема: Термодинамика реакций восстановления оксидов металлов газами со и н2
- •Варианты заданий
- •Тема: Диаграммы фазовых равновесий в двухкомпонентных системах
Варианты заданий:
Al, O2; 1.5 Ge, CO2 1.9 Ti, CO2;;
Bi, N2; 1.6 Ni, N2; 1.10 Zr, H2
Cu, N2; 1.7 Pb, CO;
Fe, CO; 1.8 Sn, O2;
ЗАДАНИЕ 2
Тема: Тепловой эффект химических реакций.
Тепло при химической реакции выделяется или поглощается по причине неодинаковости, при определенной температуре, энтальпий у веществ продуктов и вступающих в реакцию. Таким образом, тепловой эффект реакции при любой температуре равен разности энтальпий веществ продуктов и вступающих в реакцию.
![]() (1)
(1)
![]() (2)
(2)
К числу фундаментальных методов расчета тепловых эффектов следует отнести два следующих:
по энтальпиям для индивидуальных веществ реагентов
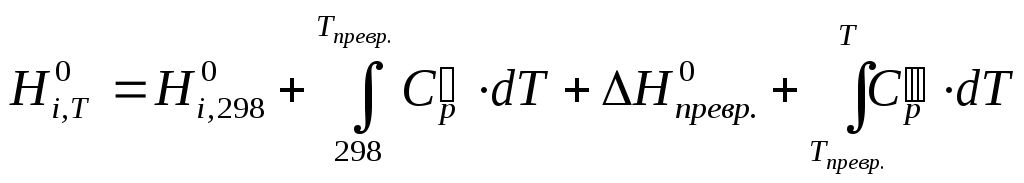 (3)
(3)
с последующим определением их разности по уравнению (2);
путем интегрирования уравнения Кирхгофа
![]() (4)
(4)
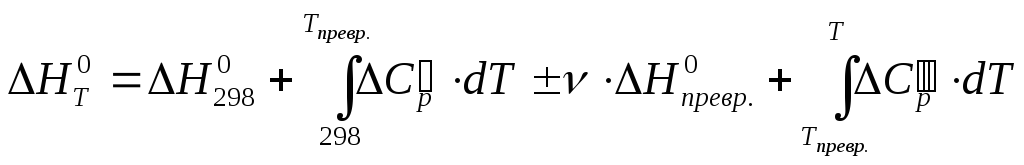 (5)
(5)
Зная зависимость теплоемкости от температуры и тепловой эффект реакции при 298 К вычисляем тепловой эффект для любой другой температуры.
Варианты заданий
|
Т=1000 К |
Т=1500 К |
Реакция |
|
2.1 |
2.6 |
2CO + O2 = 2CO2 |
|
2.2 |
2.7 |
C + CO2 = 2CO |
|
2.3 |
2.8 |
CO + H2O = CO2 + H2 |
|
2.4 |
2.9 |
FeO + CO = Fe + CO2 |
|
2.5 |
2.10 |
TiO2 + 4/3 Al = Ti + 2/3 Al2 O3 |
Выразить зависимость теплового эффекта реакции от температуры и найти тепловой эффект при 1000 или 1500 К двумя указанными методами. Сравнить тепловые эффекты Н01000 или Н01500, рассчитанные разными методами между собой и тепловым эффектом при 298 К.
Оценить в % по отношению к Н0298 изменение теплового эффекта при переходе к Т=1000 К или Т=1500 К.
ЗАДАНИЕ 3
Тема: Расчет константы химического равновесия и равновесного состава газовой фазы
Расчет константы равновесия основан на решении уравнений:
![]() (1)
(1)
![]() (2)
(2)
Для
вычисления
![]() реакции в преобладающем числе случаев
используют энтропийный метод, основанный
на решении уравнения Гиббса - Гельмгольца
реакции в преобладающем числе случаев
используют энтропийный метод, основанный
на решении уравнения Гиббса - Гельмгольца
![]() (3)
(3)
Зависимость теплового эффекта и изменения энтропии реакции от температуры находим по уравнениям:
![]() (4)
(4)
![]() (5)
(5)
где
![]() и
и![]() - тепловой эффект и изменение энтропии
для298 К;
Ср
- разность
теплоемкостей веществ продуктов и
вступающих в реакцию, с учетом стехиометрии
реагирования.
- тепловой эффект и изменение энтропии
для298 К;
Ср
- разность
теплоемкостей веществ продуктов и
вступающих в реакцию, с учетом стехиометрии
реагирования.
Зависимость теплоемкости веществ от температуры представим уравнением:
![]() Дж/моль
. К
(6)
Дж/моль
. К
(6)
В тех случаях, когда одно или несколько веществ в интервале температур 298-Т К претерпевают модификационное или агрегатное превращение, весь промежуток температур от 298 до Т К необходимо разбивать на несколько более коротких, в каждом из которых учитываются именно те свойства, которые им присущи. В соответствии с этим в правой части уравнений (4) и (5) число слагаемых увеличивается и появляются два или более слагаемых, и, кроме того, теплоты превращений и изменения энтропии веществ.
Вычислив по уравнению (2) константу равновесия, находим из нее равновесные концентрации веществ.
Константа равновесия - количественная характеристика равновесного состояния, представляющая собой отношение произведения равновесных концентраций веществ, вступающих в реакцию.
При содержании в равновесной газовой фазе не более трех веществ вычисление равновесных концентраций не представляет затруднений, но при наличии в газовой фазе трех компонентов необходимо знать или задаться количествами веществ в исходном состоянии системы.
