- •РЕГУЛЯЦИЯ
- •Организация химических реакций в метаболические пути
- •В ряде случаев пространственная организация ферментов настолько сильно выражена, что продукт реакции ни
- •Органоспецифичность
- •Компартментализация
- •2. Структура метаболических путей
- •Принципы регуляции метаболических путей
- •Регуляция скорости ферментативных реакций осуществляется на 3 независимых уровнях:
- •1. Регуляция количества молекул фермента в клетке
- •2. Регуляция скорости ферментативной реакции доступностью молекул субстрата и коферментов
- •3. Регуляция каталитической активности ферментов
- •Изостерическая регуляция
- •Изостерическим ингибитором СДГ является также оксалоацетат, который регулирует, таким образом, заключительные этапы цикла
- •Аллостерическая регуляция
- •Роль аллостерических ферментов в метаболизме клетки.
- •- при катаболических процессах.
- •Аллостерические эффекторы.
- •Более редкий случай аллостерической регуляции, когда
- •Выявить ферменты с аллостерической регуляцией можно, изучая кинетику этих ферментов.
- •S-образная кривая зависимости скорости реакции от концентрации субстрата
- •Работа регуляторных субъединиц АКТ-азы
- •Кооперативное связывание
- •Коэффициент Хилла h – безразмерная величина, характеризующая кооперативность связывания лиганда ферментом
- •Графическое определение коэффициента Хилла
- ••Для изостерических ферментов, у которых кооперативного взаимодействия между активными
- •Особенности строения и функционирования аллостерических ферментов:
- •-аллостерические ферменты обладают свойством кооперативности: взаимодействие аллостерического эффектора с аллостерическим центром вызывает последовательное
- •Локализация аллостерических ферментов в метаболическом пути.
- •Фермент, катализирующий превращение субстрата А в продукт В, имеет аллостерический центр для отрицательного
- •В центральных метаболических путях исходные вещества могут быть активаторами ключевых ферментов метаболического пути.
- •В качестве примера можно рассмотреть принципы регуляции гликолиза - специфического (начального) пути распада
- •Регуляция каталитической активности ферментов белок-белковыми взаимодействиями.
- •Активация ферментов в результате присоединения регуляторных белков.
- •В мембране аденилатциклаза функционирует в комплексе с другими белками:
- •Регуляция каталитической активности ферментов ассоциацией/диссоциацией протомеров
- •Протеинкиназа А (цАМФ-зависимая) состоит из 4 субъединиц 2 типов: 2 регуляторных (R) и
- •Регуляция каталитической активности ферментов путём фосфорилирования/дефосфорилирования
- •Регуляция каталитической активности ферментов частичным (ограниченным) протеолизом
- •Частичный протеолиз - пример регуляции, когда активность фермента изменяется необратимо.
- •Рассмотрим механизм частичного протеолиза на примере активации протеолитического фермента трипсина.
Локализация аллостерических ферментов в метаболическом пути.
Скорость метаболических процессов зависит от концентрации веществ, использующихся и образующихся в данной цепи реакций.
Такая регуляция представляется логичной, так как при накоплении конечного продукта он (конечный продукт) может действовать как аллостерический ингибитор фермента, катализирующего чаще всего начальный этап данного метаболического пути
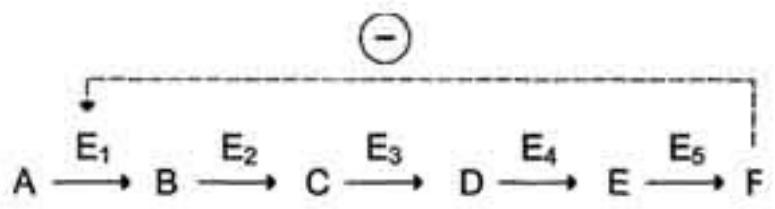
Фермент, катализирующий превращение субстрата А в продукт В, имеет аллостерический центр для отрицательного эффектора, которым служит конечный продукт метаболического пути F. Если концентрация F увеличивается (т.е. вещество F синтезируется быстрее, чем расходуется), ингибируется активность одного из начальных ферментов.
Такую регуляцию называют отрицательной обратной связью, или ретроингибированием. Отрицательная
обратная связь - часто встречающийся механизм регуляции метаболизма в клетке.
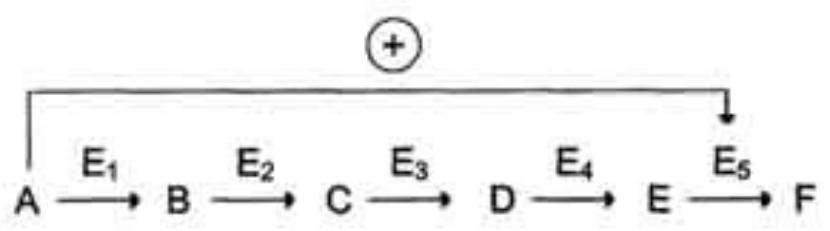
В центральных метаболических путях исходные вещества могут быть активаторами ключевых ферментов метаболического пути. Как правило, при этом аллостерической активации подвергаются ферменты, катализирующие ключевые реакции заключительных этапов метаболического пути:
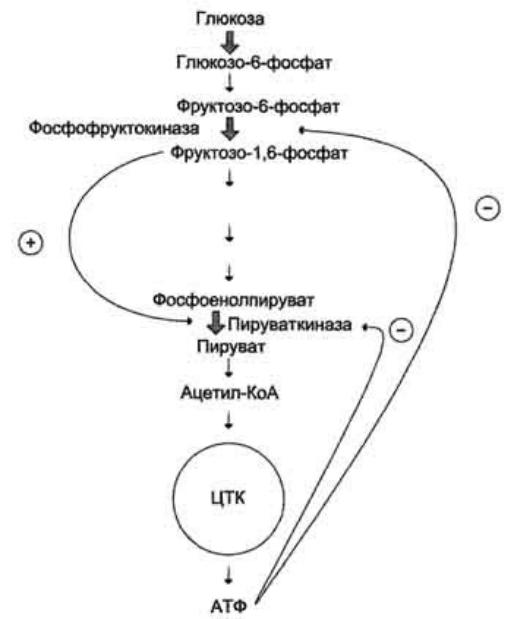
В качестве примера можно рассмотреть принципы регуляции гликолиза - специфического (начального) пути распада глюкозы.
Один из конечных продуктов распада глюкозы - молекула
АТФ. При избытке в клетке АТФ происходит ретро- ингибирование аллостерических ферментов
фосфофруктокиназы и пируваткиназы.
При образовании большого количества фруктозо-1,6- бисфосфата наблюдают аллостерическую активацию фермента пируваткиназы.
Регуляция каталитической активности ферментов белок-белковыми взаимодействиями.
Некоторые ферменты изменяют свою каталитическую активность в результате белок-белковых взаимодействий.
2 механизма активации ферментов с помощью белок- белковых взаимодействий:
-активация ферментов в результате присоединения регуляторных белков;
-изменение каталитической активности ферментов вследствие ассоциации или диссоциации протомеров фермента.
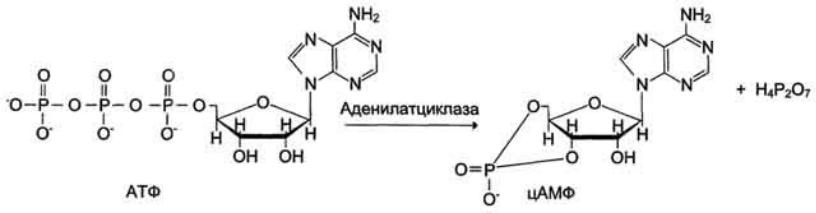
Активация ферментов в результате присоединения регуляторных белков.
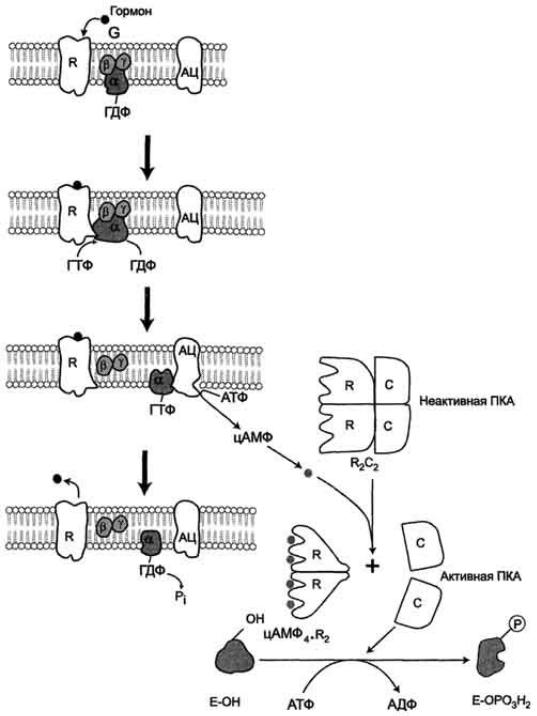
Пример, фермент аденилатциклаза, локализованная в плазматической мембране клетки.
Активный центр аденилатциклазы локализован на цитоплазматической стороне плазматической мембраны. Активированная аденилатциклаза катализирует реакцию образования из АТФ циклического 3',5'-АМФ (цАМФ) - вторичного, внутриклеточного посредника действия гормонов.
В мембране аденилатциклаза функционирует в комплексе с другими белками:
1)рецептором гормона, выступающего во внеклеточную среду и взаимодействующего с гормонами;
2)с G-белком, занимающим промежуточное положение между рецептором и ферментом аденилатциклазой. G-белок - олигомерный белок, состоящий из 3 субъединиц - α, β, γ. α-Субъединица имеет центр связывания и расщепления ГТФ. Поэтому этот белок называется ГТФ- связывающим белком, или G-белком;
3)в результате связывания гормона с рецептором происходит изменение конформации G-белка, уменьшение его сродства к молекуле ГДФ, с которой он связан в отсутствие гормонального сигнала, и увеличение сродства к ГТФ. Присоединение ГТФ вызывает конформационные изменения в G-белке и диссоциацию его на субъединицы: субъединицу α, связанную с ГТФ (α-ГТФ), димер βγ;
4)α-ГТФ имеет высокое сродство к аденилатциклазе, его присоединение приводит к активации последней, поэтому α-ГТФ - регуляторный белок, а данный механизм активации аденилатциклазы называют активацией ферментов в результате присоединения регуляторных белков.
Регуляция каталитической активности ферментов ассоциацией/диссоциацией протомеров
Протеинкиназы - группа ферментов, катализирующих перенос остатка фосфорной кислоты с АТФ на специфические ОН-группы аминокислотных остатков белков (вызывают фосфорилирование белков). Механизмы активации различных протеинкиназ неодинаковы. В качестве примера регуляции каталитической активности ферментов ассоциацией или диссоциацией протомеров можно привести регуляцию активности фермента Протеинкиназы А.
Протеинкиназа А (цАМФ-зависимая) состоит из 4 субъединиц 2 типов: 2 регуляторных (R) и 2 каталитических
(С).
Такой тетрамер не обладает каталитической активностью. Регуляторные субъединицы имеют участки связывания для циклического 3',5'-АМФ (цАМФ), по 2 на каждую субъединицу.
Присоединение 4 молекул цАМФ к 2 регуляторным субъединицам приводит к изменению конформации регуляторных протомеров и к диссоциации тетрамерного комплекса, при этом высвобождаются 2 активные каталитические субъединицы.
Такой механизм регуляции обратим. Отщепление молекул цАМФ от регуляторных субъединиц приведёт к ассоциации регуляторных и каталитических субъединиц Протеинкиназы А с образованием неактивного комплекса.