
СM = |
mNaOH |
= |
2 |
|
= 0,05 моль/л. |
M NaOH × Vр− ра |
|
|
|||
40× 1 |
|||||
2.NaOH Na+ + OH-, так как NaOH относится к сильным электролитам, то при СM = 0,05 моль/л примем a = 1.
Следовательно, Срасп. на ионы = Собщ. = 0,05 моль/л; [Na+] = [OH-] =[NaOH]расп. на ионы = 0,05 моль/л.
3.Из ионного произведения воды [Н+] × [OH-] = 10-14
|
10− 14 |
10− 14 |
|
следует [Н+] = |
|
= |
0,05 = 2×10-13 моль/л. |
[OH − ] |
|||
4. Водородный показатель рН = -lg[Н+] = lg2×10-13 = 12,7.
Ответ. [ОH-] = 5×10-2 моль/л, [H+] = 2×10-13 моль/л и рН = 12,7.
КОНТРОЛЬНЫЕ ВОПРОСЫ И ЗАДАЧИ
Теоретические вопросы
1.Какой процесс называется электролитической диссоциацией?
2.Какие вещества называются электролитами и неэлектролитами? Приведите примеры.
3.Какова роль сольватации (гидратации) в процессах растворения и электролитической диссоциации?
4.Что называется степенью электролитической диссоциации? Какие электролиты относятся к сильным, средним и слабым? Приведите примеры для различных классов неорганических соединений.
5.От каких факторов зависит степень электролитической диссоциации a? Влияние природы растворенного вещества и растворителя, концентрации растворен-
19
ного вещества, температуры, наличия в растворе веществ, содержащих одноименные ионы, на степень диссоциации.
6.Что называется константой электролитической диссоциации? (Определение). От каких факторов зависит константа электролитической диссоциации?
7.Используя вывод закона разведения (разбавления)
Оствальда, приведите взаимосвязь Kдис., α и молярной концентрации. Для каких электролитов применим закон Оствальда?
8.Ступенчатая диссоциация кислот и оснований. Приведите примеры и напишите Kдис. для каждой ступени.
Сравните α и Kдис. Для каждой из ступеней электролитической диссоциации.
9.К каким электролитам относят соли? Приведите примеры электролитической диссоциации для средних, кислых основных солей.
10.Приведите примеры (не менее 5) наиболее распространенных кислот и оснований. Какие из них относят к сильным электролитам, а какие - к слабым?
11.Какие электролиты относятся к сильным? Приведите примеры для каждого класса неорганических соединений. Состояние сильных электролитов в растворах. Понятие об активности и коэффициенте активности.
12.К каким электролитам относится вода? Напишите уравнение электролитической диссоциации воды. Константа диссоциации воды. Ионное произведение воды.
13.Каково соотношение концентраций ионов водорода и гидроксильных ионов в воде, растворах кислот и оснований?
14.Водородный показатель рН (определение) и его значения в нейтральных, кислых и щелочных растворах.
20
Задачи
1.Вычислите концентрацию гидроксид-иона и рН в 0,1 молярном растворе азотной кислоты.
2.Вычислите молярную концентрацию ионов водорода и рН
в0,01 молярном растворе гидроксида калия.
3.Водородный показатель раствора рН = 3. Определите молярную концентрацию иона водорода и гидроксид-иона
вэтом растворе.
4.Молярная концентрация гидроксид-иона равна 10-3 моль/л. Вычислите рН и концентрацию иона водорода в растворе.
5.Вычислите рН и концентрацию гидроксид-иона в 0,1%- ном растворе соляной кислоты. Степень электролитической диссоциации и плотность раствора считать равными единице.
6.Вычислите молярную концентрацию гидроксид-иона и рН
в0,01 нормальном растворе азотной кислоты.
7.Чему равна концентрация гидроксид-иона в растворе, рН которого равен 11?
8.Определите рН и концентрацию ионов водорода в растворе, в 1 литре которого содержится 0,4 грамма гидроксида натрия.
9.Определите концентрацию ионов водорода и рН в 10-3 молярном растворе гидроксида калия.
10.В одном литре раствора содержится 0,056 граммов гидроксида калия. Определите концентрацию ионов водорода и гидроксида-иона в этом растворе.
11.Степень диссоциации уксусной кислоты СН3СООН в 10-3 молярном растворе равна 10 %. Определите концентрацию ионов водорода и рН раствора.
12.Вычислите константу диссоциации и концентрацию ионов гидроксида в 2×10-3 молярном растворе гидроксида аммония NH4OH, если степень его диссоциации a = 10 %.
21
13.Вычислите степень диссоциации, концентрацию ионов водорода и рН в 0,05 молярном растворе плавиковой кислоты. Константа диссоциации Kдис.HF равна 7,4×10-4.
14.Вычислите концентрацию ионов водорода, степень диссоциации и рН в 0,1 молярном растворе перекиси водорода Н2О2. Kдис. H2O2 по первой ступени равна 2,4×10-12.
15.Степень диссоциации сероводородной кислоты в 5 %-ном (по массе) растворе равна 3 %. Вычислите константу диссоциации сероводородной кислоты по первой ступени диссоциации. Плотность раствора принять равной 1 г/см3.
16.Вычислите степень диссоциации гидроксида аммония и концентрацию гидроксид-иона в 0,1 молярном растворе. Константа диссоциации Kдис. NH 4OH = 1,8×10-5.
17.Вычислите концентрацию ионов водорода и степень диссоциации уксусной кислоты в 1%-ном растворе. Плотность раствора принять равной 1 г/см3. Константа диссоциации Kдис. CH3COOH = 1,8×10-5.
18.Вычислите молярную концентрацию раствора плавиковой кислоты, если степень диссоциации равна 8 %. Константа диссоциации Kдис. НF =7,4×10-4.
19.Вычислите концентрацию ионов водорода, степень диссоциации и рН раствора угольной кислоты с массовой долей 3 %. Плотность раствора принять равной 1 г/см3. Константа диссоциации угольной кислоты по первой ступени Kдис. H2CO3 = 3,5×10-5.
20.Вычислите степень диссоциации и рН раствора сероводородной кислоты с массовой долей 3 %. Плотность раствора принять равной 1 г/см3. Константа диссоциации по первой ступени Kдис. H 2 S = 1,02×10-7.
22
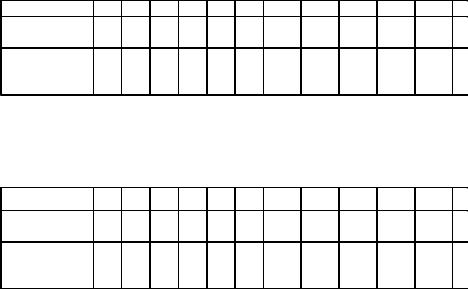
Домашние задания по теме «Растворы»
Вариант |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
1 |
Теоретичес- |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
1 |
кий вопрос |
|
|
|
|
|
|
|
|
|
|
|
|
Задачи |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
1 |
|
16 |
17 |
18 |
19 |
20 |
21 |
22 |
23 |
24 |
25 |
26 |
2 |
|
31 |
32 |
33 |
34 |
35 |
36 |
37 |
38 |
39 |
40 |
31 |
3 |
Домашние задания по теме «Электролитическая диссоциация»
Вариант |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
1 |
Теоретичес- |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
1 |
кий вопрос |
|
|
|
|
|
|
|
|
|
|
|
|
Задачи |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
2 |
|
|
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
12 |
1 |
23
