
- •СОДЕРЖАНИЕ
- •ПРЕДИСЛОВИЕ
- •1. СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИЙ
- •1.1. Массовые концентрации
- •1.2. Объемные концентрации
- •1.3. Безразмерные концентрации
- •2. ВОДНЫЕ РАСТВОРЫ ЭЛЕКТРОЛИТОВ
- •2.1. Слабые электролиты
- •2.2. Сильные электролиты
- •3. БУФЕРНЫЕ РАСТВОРЫ
- •Аммиак и хлорид аммония
- •4. ГИДРОЛИЗ
- •5. РАВНОВЕСИЕ В СИСТЕМЕ ОСАДОК – РАСТВОР
- •5.2. Растворимость
- •5.3. Влияние одноименных ионов на растворимость
- •5.4. Влияние ионной силы на растворимость (солевой эффект)
- •5.5. Образование осадка
- •6. КОНТРОЛЬНЫЕ ЗАДАНИЯ
- •ЗАКЛЮЧЕНИЕ
- •СПИСОК ЛИТЕРАТУРЫ
- •Продолжение табл. 1
- •Продолжение табл. 2
4. ГИДРОЛИЗ
Гидролиз (от лат. hydro – вода, lysis – разлагаю) – обменная реакция между веществом и водой. Гидролиз – частный случай сольволиза. Он протекает не только в водных растворах, но и при взаимодействии воды или ее паров с твердыми, жидкими и газообразными веществами. Гидролизу подвергаются соли, гидриды, оксиды, галогеноангидриды, тиоангидриды и др.
При гидролизе изменяется рН раствора, водные растворы многих солей имеют, кислую или щелочную среду. Гидролиз соли – процесс, обратный нейтрализации.
Многие реакции гидролиза обратимы. Равновесие при обратимом гидролизе подчиняется закону действия масс.
Процесс гидролиза характеризуется двумя величинами:
1)константой гидролиза Кгидр, представляющей собой константу равновесия гидролитической реакции при условии, что концентрация воды постоянна;
2)степенью гидролиза h, которая равна отношению концентрации гидролизованной части соли к ее исходной концентрации.
Гидролизу подвергаются соли слабой кислоты и сильного основания, сильной кислоты и слабого основания, слабой кислоты и слабого основания. Соль сильного основания и сильной кислоты практически не подвергается гидролизу; ее водные растворы имеют нейтральную реакцию среды.
Гидролиз в аналитической химии имеет большое значе-
ние. Его применяют для обнаружения некоторых ионов (образование антимонил- и висмутил-ионов; отделение Cr3+ от Al3+, Al3+ от Zn2+, осаждении BaCrO4, гидроокиси алюминия).
41

4.1. Гидролиз солей, образованных слабыми основаниями и сильными кислотами
Примером таких солей могут служить NH4Cl, NH4NO3, CuSO4, FeCl3, AlCl3 и др.
Рассмотрим пример алгебраического выражения Кгидр, h и расчет рН в растворе хлорида аммония:
NH4Cl + HOH NH4OH + HCl, NH4+ + HOH NH4OH + H+
Как видно, в результате гидролиза соли появляется некоторое избыточное количество ионов водорода, т.е. среда подкисляется, рН < 7.
Константа равновесия
[H+ ][NH 4 OH] К = [NH4 + ][HOH] .
Так как концентрация воды практически постоянная, то, перенеся в левую часть уравнения [HOH], получим:
K[HOH] = |
[H+ ][NH4 OH] |
= Kгидр. |
||
[NH 4 + |
] |
|
||
|
|
|
||
Константу гидролиза можно вычислить, исходя из ион- |
||||
ного произведения воды Кw и константы диссоциации гидроксида аммония КNH4OH:
[H+][OH-] = Kw, |
[H+] = Kw/[OH-]. |
||||
Подставив значение [H+] в уравнение для константы |
|||||
гидролиза, получим: |
K w |
||||
|
K w [NH4 OH] |
||||
|
|
|
= |
|
= Кгидр. |
[OH− ][NH4 |
+ ] |
K NH4OH |
|||
В общем случае для любой соли, образованной слабым
основанием и сильной кислотой, Кгидр = Кw/Kb (где Kb – константа диссоциации слабого основания, образующегося при
гидролизе).
42
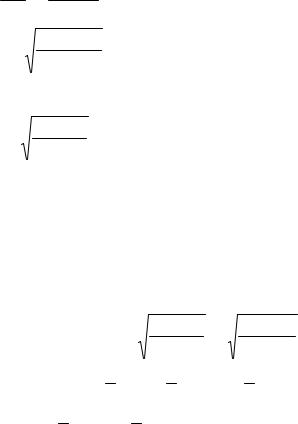
Из этого уравнения можно вычислить и степень гидролиза соли. Концентрацию соли обозначим через СМеА (в моль/л). Тогда равновесные концентрации молекул слабого основания и ионов водорода H+ составят:
[NH4OH] = [H+] = (hСМеА),
а равновесная концентрация соли:
[NH4Cl] = СМеА - hСМеА = СМеА(1- h).
Отсюда
K w
K b
h =
=CMeA h2 ;
(1−h)
K w (1−h) .
Kb CMeA
Если степень гидролиза мала по сравнению с единицей, то величиной h в выражении (1-h) можно пренебречь; тогда
h = |
Kw |
Kb CMeA . |
Из формулы видно, что степень гидролиза соли сильного основания и слабой кислоты тем больше, чем больше ионное произведение воды (которое увеличивается с повышением температуры раствора), чем меньше константа диссоциации слабой кислоты и чем меньше концентрация соли. С разбавлением гидролиз усиливается.
Расчет рН
+ |
Kw |
|
K w СMeA |
|
[H ] = hСМеА = CMeA |
Kb CMeA |
= |
Kb |
, |
рН = -lg[H+] = - 12 lgKw - 12 lgCMeA + 12 lgKb, pH = 7 - 12 lgCMeA - 12 pKb.
43

Пример 1. Вычислить константу гидролиза хлорида аммония и величину рН в 0,1 М растворе этой соли.
Решение. KNH4Cl = 1,8×10-5 (см. приложение, табл. 1).
|
K |
w |
10 |
−14 |
-10 |
||||||
|
|
|
|
|
|
|
|
= 5,56×10 |
|||
Kгидр = |
|
|
|
= |
|
|
|
. |
|||
K b |
1,8×10−5 |
||||||||||
рH = 7 - |
1 |
lgCMeA - |
|
1 |
pKb, |
|
|||||
|
2 |
|
|||||||||
|
2 |
|
|
|
|
|
|
||||
где pKb = -lgKb = -lg(1,.8×10-5) = 4,74.
рН = 7 - 12 lg0,1 - 12 4,74 = 5,13.
Задачи-тренажеры
1.Вычислить константу гидролиза нитрата аммония и величину рН в 0,2 М растворе этой соли.
2.Вычислить константу гидролиза хлорида аммония и величину рН в 0,05 М растворе этой соли.
3.Вычислить константу гидролиза бромида аммония и величину рН в 0,1 М растворе этой соли.
4.Вычислить константу гидролиза хлорида аммония и величину рН в 0,01 М растворе этой соли.
5.Вычислить константу гидролиза нитрата аммония и величину рН в 0,02 М растворе этой соли.
Гидролиз солей, образованных слабыми основаниями многовалентных металлов, протекает ступенчато. В результате гидролиза по первой ступени образуется основная соль, например:
1ст. FeCl3 + H2O FeOHCl2 + HCl,
Fe3+ + H2O FeOH2+ + H+.
44

Вторая и третья ступени гидролиза представляют собой взаимодействие с водой образовавшейся основной соли (или, точнее, образовавшегося гидроксокатиона):
2ст. FeOHCl2 + H2O Fe(OH)2Cl + HCl,
FeOH2+ + H2O Fe(OH)2+ + H+.
3ст. Fe(OH)2Cl + H2O Fe(OH)3 + HCl,
Fe(OH)2+ + H2O Fe(OH)3 + H+.
Константа гидролиза по первой ступени значительно выше, чем константа гидролиза по второй и по третьей ступеням: Кг,1 > Кг,2 > Кг,3. Поэтому при расчете концентраций ионов [H+] или [OH-] второй и третьей ступенью гидролиза обычно пренебрегают. Анализ уравнений гидролиза показывает, что для расчета константы гидролиза по первой ступени входит константа диссоциации слабого электролита по последней ступени. Например, константа гидролиза иона Fe3+ по первой ступени равна
Кг,1 = K w .
K b,3
4.2. Гидролиз солей, образованных слабыми кислотами и сильными основаниями
К ним относятся KCN, CH3COONa, Na2CO3, K2CO3 и др.
Пример:
CH3COONa + H2O CH3COOH + NaOH, CH3COO- + H2O CH3COOH + OH-.
Как видно, в результате гидролиза появилось некоторое избыточное количество гидроксид-ионов, а реакция среды стала основной, рН > 7.
Степень гидролиза и константа гидролиза в данном случае описывается теми же уравнениями, но лишь с тем исключением, что в уравнения входит константа диссоциации слабой кислоты (Ka).
45
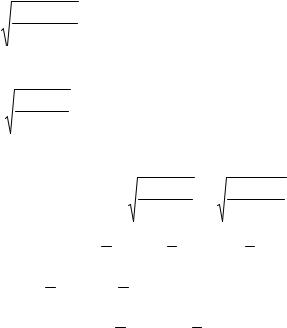
Kг = |
[CH3COOH][OH− ] |
; |
|||||||||
|
|
|
[CH3COO− ] |
||||||||
|
|
|
|
|
|
|
|
||||
Kг = |
K w |
; |
|
|
|
|
|||||
|
|
|
|
|
|||||||
|
|
|
|
Ka |
|
|
|
|
|
|
|
|
K |
w |
|
= |
C |
MeA |
h2 |
; |
|
||
|
Ka |
|
(1−h) |
|
|||||||
|
|
|
|
|
|
||||||
h = |
|
|
|
K w (1−h) |
. |
|
|||||
|
|
|
Ka CMeA |
|
|||||||
|
|
|
|
|
|
|
|||||
Если степень гидролиза мала по сравнению с единицей, то величиной h в выражении (1-h) можно пренебречь; тогда
H = |
Kw |
. |
|
|
|
Ka CMeA |
|
|
|
||
|
|
|
|
|
|
Расчет рН |
|
|
|
|
|
- |
|
Kw |
|
K w СMeA |
|
[OH |
] = hСМеА = СМеА Ka CMeA |
= |
Ka |
, |
|
рOН = -lg[OH-] = - 12 lgKw - 12 lgCMeA + 12 lgKa, pOH = 7 - 12 lgCMeA - 12 pKa,
pH = 14 - pOH = 7 + 12 lgCMeA + 12 pKa.
Пример 2. Вычислить степень гидролиза ацетата калия в 0,1 М растворе и рН раствора.
Решение. Уравнения реакции гидролиза:
CH3COOK + H2O CH3COOH + KOH, CH3COO- + H2O CH3COOH + OH-.
KCH3COOH = 1,8×10-5 (см. приложение, табл. 1).
46
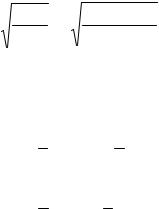
|
|
|
K |
w |
|
|
10−14 |
= 5,56×10 |
-10 |
|
|
|
Kгидр = |
|
|
= |
|
|
|
, |
|
||||
|
Kа |
|
1,8×10−5 |
|
|
|||||||
h = |
|
Kг |
|
= |
5,56 ×10 |
−10 |
|
-5 |
. |
|||
CMeA |
0,1 |
|
= 7,5×10 |
|
||||||||
|
|
|
|
|
|
|
||||||
[OH-] = hCMeA = 7,5×10-5×0,1 = 7,5×10-6 М, pOH = -lg[OH-] = -lg(7,5×10-6) = 5,13.
рH = 14 – 5,13 = 8,87
или
pH = 7 + 12 lgCMeA + 12 pKa,
где pKa = -lgKa = -lg(1,8×10-5) = 4,74.
РН = 7 + 12 lg0,1 + 12 4,74 = 8,87.
Задачи-тренажеры
1.Вычислить степень гидролиза ацетата калия в 0,01 М растворе и рН раствора.
2.Вычислить степень гидролиза фторида калия в 0,1 М растворе и рН раствора.
3.Вычислить степень гидролиза нитрита калия в 0,05 М растворе и рН раствора.
4.Вычислить степень гидролиза цианида калия в 10-3 М растворе и рН раствора.
5.Вычислить степень гидролиза цианида калия в 0,1 М растворе и рН раствора.
Гидролиз солей, образованных слабыми многоосновными кислотами, протекает ступенчато, причем продуктами первых стадий гидролиза являются кислые соли:
K2CO3 + H2O KHCO3 + KOH, CO32- + H2O HCO3- + OH-.
47
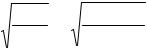
Кг,1= |
K w |
= |
10−14 |
|
= 2,1×10 |
-4 |
. |
|
Kа,2 |
4,7 |
×10 |
−11 |
|
||||
|
|
|
|
|
||||
KHCO3 + H2O H2CO3 + KOH,
HCO3- + H2O H2CO3 + OH-.
Кг,2 |
= |
K w |
= |
10−14 |
|
= 2,2×10 |
-8 |
. |
|
K а,1 |
4,5 |
×10 |
−7 |
|
|||||
|
|
|
|
|
|
||||
Как видно, Кг,2 << Кг,1, поэтому при приближенных расчетах, связанных с гидролизом солей слабых многоосновных кислот, можно принимать во внимание только гидролиз по первой ступени.
Пример 3. Определить рН 0,1 М раствора ортофосфата калия.
Решение. Будем считать, что гидролиз практически протекает только по первой ступени:
K3PO4 + H2O K2HPO4 + KOH, PO43- + H2O HPO42- + OH-.
K3,H3PO4 = 1,3×10-12 (приложение, табл. 1).
Кг,1 = |
|
K w |
= |
|
10−14 |
|
= 7,7×10 |
-3 |
. |
|
|
|
K а,3 |
1,3×10−12 |
|
|
|
||||||
|
|
|
|
|
|
|
|
||||
h = |
|
Kг1 |
= |
7,7 ×10 |
−3 |
|
|
-2 |
. |
||
CMeA |
0,1 |
|
= 2,8×10 |
|
|||||||
|
|
|
|
|
|
|
|
||||
[OH-] = hCMeA = 2,8×10-2×0,1 = 2,8×10-3 М, pOH = -lg[OH-] = -lg(2,8×10-3) = 2,55,
pH = 14 – 2,55 = 11,45.
Задачи-тренажеры
1.Определить рН 0,01 М раствора ортофосфата калия.
2.Определить рН 0,05 М раствора карбоната калия.
3.Определить рН 0,1 М раствора сульфида калия.
48

4.Определить рН 0,01 М раствора сульфида калия.
5.Определить рН 0,001 М раствора силиката калия.
4.3. Гидролиз солей, образованных слабыми кислотами и слабыми основаниями
К ним относятся такие соли, как NH4CN, (NH4)2S, Al2S3, (CH3COO)3Fe и др.
Пример:
NH4F + H2O NH4OH + HF, NH4+ + F- + H2O NH4OH + HF.
Как видно, в результате гидролиза образуются как ионы водорода, так и ионы гидроксида. Константа гидролиза зависит от константы диссоциации как слабого основания (Kb), так
и слабой кислоты(Ka): |
|
|||
Кг = |
[NH4 OH][HF] |
; |
||
[NH4 |
+ ][F− ] |
|||
Кг = |
K w |
. |
|
|
|
|
|||
|
Ka K b |
|
|
|
Степень гидролиза и концентрация ионов водорода в этом случае не зависят от исходной концентрации соли:
h |
= |
Kг = |
K w |
. |
|
1 − h |
Ka Kb |
||||
|
|
|
Так как гидролиз таких солей проходит со степенью гидролиза близкой к 1, то пренебрегать h в выражении (1-h) нельзя.
Расчет рН
[NH4+] = [F-] CNH4F CMeA, [NH4OH] = [HF] = [HF]2 = [HA]2,
[HA]2
Kг = C2 MeA ,
49

|
[HA] = |
[H+ ][A− |
] |
= |
[H |
+ ]C |
MeA |
, |
|
|
|||||||||||||||||
|
|
|
|
|
Ka |
|
|
|
|
|
|
Ka |
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Kг = |
[H+ |
]2 C2 MeA |
|
|
= |
[H+ |
]2 |
, |
|
|
|
|
|||||||||||||||
|
C2 MeA K 2 a |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
K 2 a |
|
|
|
|
|||||||||||
|
Кг = |
|
|
K w |
, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
Ka K b |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
[H+ ]2 |
|
|
|
K w |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
= |
|
|
|
|
, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
K 2 a |
|
|
Ka K b |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
[H+ ] = |
|
|
K w Ka |
, |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
Kb |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
рН = -lg[H+] = - |
1 |
lgKw |
- |
1 |
lgKa + |
1 |
lgKb, |
|||||||||||||||||||
|
2 |
2 |
2 |
||||||||||||||||||||||||
pH = 7 + |
|
1 |
pKa - |
|
1 |
pKb. |
|
|
|
|
|
|
|
||||||||||||||
2 |
2 |
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Как видно, в зависимости от соотношения Ka и Kb среда может иметь как кислую (Ka > Kb), основную (Ka < Kb), так и нейтральную (Ka Kb) реакцию.
Так, например, при гидролизе карбоната аммония (NH4)2CO3 реакция среды будет слабо щелочная
(KNH4OH = 1,79×10-5, K1,H2CO3 = 4,45×10-7), при гидролизе ацетата
аммония NH4CH3COO (KNH4OH=1,79×10-5, KCH3COOH=1,75×10-5)
– нейтральная.
Некоторые соли, например сульфид алюминия Al2S3 и сульфид хрома Cr2S3, гидролизуются полностью, потому что в результате гидролиза получаются труднорастворимое основание и слабодиссоциирующая кислота.
Al2S3 + 6H2O Al(OH)3↓ + 3H2S↑,
2Al3+ + 3S2- + 6H2O 2Al(OH)3↓ + 3H2S↑.
50
Пример 4. Вычислите степень гидролиза и рН раствора цианида аммония.
Решение. Уравнения реакции гидролиза:
NH4CN + H2O NH4OH + HCN, NH4+ + CN- + H2O NH4OH + HCN.
KNH4OH = 1,8×10-5 (pK = 4,75), KHCN = 7,9×10-10 (pK = 9,10) (см. приложение, табл. 1).
h |
= |
K w |
= |
|
10−14 |
|
−5 = 0,84, |
|
1 − h |
Ka Kb |
7,9 |
×10 |
−10 |
×10 |
|||
|
|
1,8 |
|
|||||
h = 0,84(1-h),
h = 0,46 или 46%.
рH = 7 + 12 pKa - 12 pKb = 7 + 4,55 – 2,375 = 9,175.
Задачи-тренажеры
1.Вычислите степень гидролиза и рН раствора фторида аммония.
2.Вычислите степень гидролиза и рН раствора ацетата аммония.
3.Вычислите степень гидролиза и рН раствора карбоната аммония.
4.Вычислите степень гидролиза и рН раствора сульфида аммония.
5.Вычислите степень гидролиза и рН раствора нитрита аммония.
Итак, при гидролизе солей, образованных слабыми кислотами или (и) основаниями, происходит подщелачивание или подкисление раствора. Степень гидролиза возрастает с разбавлением раствора и при увеличении температуры.
Если в раствор гидролизующейся соли ввести реактив, связывающий образующиеся при гидролизе ионы H+ или OH-,
51
то в соответствии с принципом Ле Шателье равновесие смещается в сторону усиления гидролиза; в результате гидролиз может протекать полностью – до образования конечных продуктов. При этом ионы H+ (или OH-) можно связать в молекулы воды, вводя в раствор не только щелочь (или кислоту), но и другую соль, гидролиз которой приводит к накоплению в растворе ионов OH- (или H+). При этом ионы H+ и OH- нейтрализуют друг друга, что вызовет взаимное усиление гидролиза обеих солей и в результате – образование конечных продуктов гидролиза.
Например, при смешении растворов Na2CO3 и AlCl3, в которых соответственно имеется избыток ионов OH- и H+, взаимное усиление гидролиза приводит к выделению CO2 и образованию осадка Al(OH)3:
2AlCl3 + 3Na2CO3 + 3H2O = 2Al(OH)3↓ + 3CO2↑ + 6NaCl, 2Al3+ + 3CO32- + 3H2O = 2Al(OH)3↓ + 3CO2↑.
В осадок в подобных случаях выпадает наименее растворимый из возможных продуктов гидролиза. Так, растворимость карбоната гидроксомеди (CuOH)2CO3 меньше, чем гидроксида меди Cu(OH)2. Поэтому при сливании растворов CuSO4 и Na2CO3 конечным продуктом гидролиза является именно (CuOH)2CO3:
2CuSO4+2Na2CO3+H2O = (CuOH)2CO3↓+CO2↑+2Na2SO4, 2Cu2+ + 2CO32- + H2O = (CuOH)2CO3↓+ CO2↑.
Равновесие гидролиза может быть смещено также изменением температуры. Реакция гидролиза представляет собой эндотермический процесс, поэтому повышение температуры ведет к усилению гидролиза, а понижение температуры – к его ослаблению.
Пример 5. Усилит или уменьшит гидролиз хлорида железа (III) добавление к раствору а) гидроксида натрия, б) со-
52
ляной кислоты, в) хлорида цинка, г) карбоната натрия, д) хлорида аммония и е) воды.
Решение. Уравнения реакции гидролиза по первой сту-
пени:
FeCl3 + H2O FeOHCl2 + HCl, Fe3+ + H2O FeOH2+ + H+.
а) NaOH – усилит гидролиз FeCl3, так как ионы OH-, образующиеся при диссоциации гидроксида натрия, связывают ионы H+, образующиеся при гидролизе соли, в молекулы воды;
б) HCl – уменьшит гидролиз FeCl3, так как увеличение концентрации ионов H+ в растворе соли согласно принципу Ле Шателье сместит равновесие в сторону исходных веществ; в) ZnCl2 - уменьшит гидролиз FeCl3, так как увеличение концентрации ионов H+ в растворе соли в результате гидролиза хлорида цинка согласно принципу Ле Шателье сместит
равновесие в сторону исходных веществ;
ZnCl2 + H2O ZnOHCl + HCl, Zn2+ + H2O ZnOH+ + H+;
г) Na2CO3 - усилит гидролиз FeCl3, так как ионы OH-, образующиеся в результате гидролиза карбоната натрия, связывают ионы H+, образующиеся при гидролизе соли, в молекулы воды;
Na2CO3 + H2O NaHCO3 + NaOH, CO32- + H2O HCO32- + OH-;
д) NH4Cl - уменьшит гидролиз FeCl3, так как увеличение концентрации ионов H+ в растворе соли в результате гидролиза хлорида аммония согласно принципу Ле Шателье сместит равновесие в сторону исходных веществ;
NH4Cl + H2O = NH4OH + HCl, NH4+ + H2O = NH4OH + H+;
е) H2O – усилит гидролиз FeCl3, так как с разбавлением раствора степень гидролиза увеличивается.
53
Задачи-тренажеры
1.Усилит или ослабит гидролиз сульфида калия добавление к раствору а) гидроксида натрия, б) соляной кислоты, в) хлорида цинка, г) карбоната натрия, д) хлорида аммония, е) воды.
2.Усилит или ослабит гидролиз хлорида магния добавление к раствору а) гидроксида натрия, б) соляной кислоты, в) хлорида цинка, г) карбоната натрия, д) хлорида аммония, е) воды.
3.Усилит или ослабит гидролиз силиката калия добавление к раствору а) гидроксида натрия, б) соляной кислоты, в) хлорида цинка, г) карбоната натрия, д) хлорида аммония, е) воды.
4.Усилит или ослабит гидролиз цианида калия добавление к раствору а) гидроксида натрия, б) соляной кислоты, в) хлорида цинка, г) карбоната натрия, д) хлорида аммония, е) воды.
5.Усилит или ослабит гидролиз хлорида алюминия добавление к раствору а) гидроксида натрия, б) соляной кислоты, в) хлорида цинка, г) карбоната натрия, д) хлорида аммония, е) воды.
54
