
Глаголева Физическая химия Лабораторный практикум 2008
.pdfкость из капилляра. Процесс повторите несколько раз. Проверьте качество отмывания, сопоставив результаты измерений для следующих порций дистиллированной воды. В случае совпадения результатов, внесите их в табл. 12.2.
14.Приготовьте раствор ПАВ, внесенный в табл. 12.2 под номером 2. Для этого отмерьте в коническую колбу из бюретки 15 мл воды и 1 мл исходного раствора ПАВ.
15.Небольшим количеством приготовленного раствора ополосните сосуд, затем вылейте раствор и заполните сосуд новой порцией раствора. Промойте капилляр этим раствором так, как это описано в п. 13. Если этого не сделать, в капилляре останется раствор от предыдущих измерений.
16.Закройте сосуд пробкой, проверьте, касается ли капилляр поверхности жидкости. Закрепите сосуд в термостате и выдержите в нем не менее 5 мин. После этого вновь определите капиллярное давление, повторив пп.10–12.
17.Проведите аналогичные измерения для растворов последующих концентраций, переходя от менее к более концентрированному раствору, каждый раз тщательно промывая капилляр.
18.Вымойте капилляр и сосуд дистиллированной водой.
19.Выборочно, по рекомендации преподавателя, повторите измерения для отдельных концентраций, двигаясь в сторону уменьшения концентрации раствора. Перед каждым измерением промывайте капилляр и стакан сначала дистиллированной водой, а затем исследуемым раствором. Если результаты первого и повторного измерений совпадут, качество отмывания было удовлетворительным. Если это не так, опыт следует повторять до получения совпадающих результатов.
20.Закончив измерения, вымойте сосуд и капилляр дистиллированной водой, залейте в сосуд дистиллированную воду примерно на 1 см выше отметки и погрузите в нее капилляр.
Оформление опыта
1.Приведите схему прибора Ребиндера для измерения поверхностного натяжения (см. рис. 12.1).
151
|
|
|
|
|
|
|
|
Результаты измерений и расчетов |
Таблица 12.2 |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
№ |
Объем ком- |
Концентра- |
Разность уровней |
Поверхно- |
Отрезок |
Адсорбция |
||||||||||||||||
п/п |
понентов |
|
ция |
манометра ( h), |
стное на- |
ординаты |
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
мм |
тяжение |
(Z·103), |
|
|
|
|
|
||||
|
Во- |
Рас- |
С, |
|
|
|
, |
Первое |
Повтор- |
(σ·103), |
Дж/м2 |
Г·106, |
|
|
|
|
||||||
|
ды, |
твора |
моль/ |
л/мол |
изме- |
|
ное из- |
Дж/м2 |
|
|
|
моль/ |
· , |
|||||||||
|
V1, |
ПАВ, |
л |
|
рение |
|
мерение |
|
|
|
|
|
м2 |
|||||||||
|
мл |
V2, мл |
|
|
|
ь |
|
|
|
(выбо- |
|
|
|
|
|
|
10 |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
м2/мол |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
рочно) |
|
|
|
|
|
|
|
ь |
||
1 |
16,0 |
|
0 |
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
15,0 |
|
1,0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
14,0 |
|
2,0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
12,0 |
|
4,0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5 |
9,0 |
|
7,0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6 |
6,0 |
|
10,0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7 |
3,0 |
|
13,0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8 |
0 |
|
16,0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Определение константы прибора |
Таблица 12.3 |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
Состав |
Температура |
Показания |
Поверхностное |
Константа |
Погрешности |
|||||||||||||||||
раствора |
|
(Т), К |
манометра |
|
|
натяжение |
прибора |
определения |
||||||||||||||
|
|
|
|
|
|
( h1), мм |
при температуре |
η |
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
∆σ |
|
∆η |
|||||||||||
|
|
|
|
|
|
|
|
|
|
опыта (σ ·103), |
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
Дж/м12 |
|
|
|
|
|
|
|
|
|
|
Н2О |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

2.Внесите в табл. 12.1 данные об условиях опыта и справочные данные. Внесите в табл. 12.3 данные для определения константы прибора. По уравнению (12.8) рассчитайте константу прибора. Используя уравнения (12.9) и (12.10), по величине погрешности показаний манометра (1 мм) вычислите погрешности определения константы прибора и поверхностного натяжения.
3.Рассчитайте и внесите в табл. 12.2 величины поверхностного натяжения (12.7) и концентраций (С) исследованных растворов:
,
где V1 и V2 – объемы соответственно воды и исходного раствора ПАВ.
4.Постройте график зависимости поверхностного натяжения от
концентрации раствора ПАВ. Рекомендуемый масштаб – 1 см:10·10-3 Дж/м2 и 1 см:0,01 М. Ожидается, что полученная кривая не имеет перегибов и экстремумов.
5.Проведите графическую обработку построенной кривой с целью определения зависимости адсорбции от концентрации. Для этого отметьте на кривой точки, абсциссы которых соответствуют концентрациям исследованных растворов, и через каждую точку проведите касательную к кривой и горизонталь до пересечения с осью ординат (рис. 12.2). Касательную проводите с помощью прямоугольного зеркала. Для этого поместите зеркало в выбранной точке так, чтобы поверхность зеркала была перпендикулярна поверхности графика. Поворачивая зеркало, добейтесь того, чтобы изображение кривой в зеркале продолжало саму кривую без изломов. Если теперь провести линию по нижнему краю зеркала, то она будет перпендикуляром к касательной. Для большей точности целесообразно проделать то же самое, перевернув зеркало и рассматривая в нем кривую по другую сторону от выбранной точки.
6.В треугольнике ABD, образовавшемся между осью ординат, касательной к кривой в выбранной точке и горизонталью, проведенной через эту точку, угол φ (см. рис. 12.2) является дополнительным к углу наклона касательной к оси абсцисс.
153
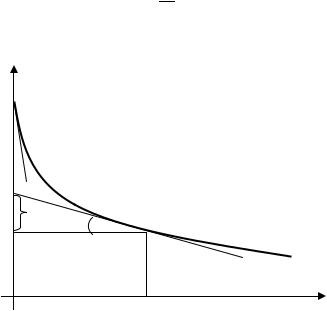
Следовательно,
tg π φ |
tgφ |
BD |
(12.12) |
|
|
AB. |
Определив таким образом графически производную для всех точек и умножая ее каждый раз на соответствующее значение концентрации, можно получить значения адсорбции согласно уравнению (IV.4). При этом операции дифференцирования и умножения легко объединяются, поскольку в уравнение (12.12) уже входит концентрация (BD=С), а значит отрезок (АВ=Z), отсекаемый касательной и горизонталью на оси ординат, представляет собой произведение концентрации на производную с обратным знаком:
BDtgφ |
. |
||
Из уравнения (IV.4) следует, что |
|
||
Γ |
R |
. |
(12.13) |
Определите величину отрезка Z, вычислите значения адсорбции для всех растворов и внесите эти значения в табл. 12.2.
σ
А φ0 |
|
|
Z |
φ |
D |
|
В
0 |
С |
C |
Рис. 12.2. Концентрационная зависимость поверхностного натяжения раствора
154

7.Постройте график зависимости адсорбции от концентрации
Γ= f (C) . Оцените приближенно протяженность линейного
участка кривой и ее асимптоту.
8.Постройте график зависимости обратной адсорбции от обратной концентрации (1/Γ)=f(1/С), который в соответствии с уравнением (IV.6) имеет вид прямой. Определите параметры
изотермы графически по ординате, отсекаемой прямой |
|
, и |
||
|
||||
по тангенсу угла ее наклона к оси абсцисс |
|
. |
|
|
|
|
|
||
9.Определите поверхностную активность по тангенсу угла на-
клона касательной к кривой |
|
в точке С=0 (см. уравне- |
|
ние (IV.2)). Сравните |
полученное значение с вычисленным по |
||
|
σ |
|
|
уравнению (12.5). Рассчитайте работу адсорбции, площадь, занимаемую молекулой в поверхностном слое, и длину молекулы ПАВ, используя уравнения (12.2)–(12.5). Результаты вычислений внесите в табл. 12.4.
Таблица 12.4 Результаты вычислений характеристик ПАВ по параметрам изотермы
Формула ПАВ
Граница линейной адсорбции
Предельная адсорбция (Г∞), моль/м2
Константа адсорбции (К), м3/моль
Поверхностная активность (g), Дж·м/моль
Работа адсорбции (L), Дж/моль
Площадь, занимаемая молекулой в поверхностном слое (Sa),. Ǻ2
Длина молекулы (l), Ǻ
Опыт 2. Сравнение поверхностной активности и работы адсорбции
ПАВ одного гомологического ряда
При проведении этого опыта следует использовать полученные в опыте 1 данные о величинах константы прибора, поверхностного натяжения растворителя, а также адсорбционной константы,
155
предельной адсорбции, работе адсорбции и поверхностной активности ПАВ известного состава.
Выполнение опыта
1.Отметьте температуру в помещении. Измерения проводите при комнатной температуре в термостате.
2.В конической колбе приготовьте 0,1 М раствор ПАВ неизвестного состава, для чего смешайте 8 мл выданного преподавателем раствора ПАВ с концентрацией 0,2 М и 8 мл дистиллированной воды.
3.Ополосните приготовленным раствором сосуд Ребиндера, промойте им капилляр, руководствуясь п. 13 (см. «Выполнение
опыта 1»).
4.Определите поверхностное натяжение 0,1 М раствора ПАВ по методике, описанной в разделе «Выполнение опыта 1».
5.После окончания измерений вымойте сосуд и капилляр дистиллированной водой.
Оформление опыта
1.Внесите в табл. 12.5 значение константы прибора, полученное в опыте 1, запишите температуру и результаты измерения поверхностного натяжения неизвестного ПАВ.
2.По концентрационной зависимости поверхностного натяжения известного ПАВ, полученной в опыте 1, определите его поверхностное натяжение при концентрации 0,1 М.
3.Укажите предельную адсорбцию. Для всех одноатомных спиртов она имеет примерно одинаковое значение. Используйте величину предельной адсорбции, полученную в опыте 1.
4.Используя уравнение Шишковского (12.1), рассчитайте константу адсорбции для обоих ПАВ. Для известного ПАВ приведите также значение константы, полученное при обработке изотермы адсорбции в опыте 1.
5.По уравнению (12.5) рассчитайте поверхностную активность.
156

Для известного ПАВ поверхностную активность рассчитайте кроме того по величине тангенса угла наклона касательной, проведенной к концентрационной зависимости поверхностного натяжение в нулевой точке.
6.Вычислите работу адсорбции для двух ПАВ. Для известного ПАВ приведите результаты вычислений с использованием значений констант, полученных обоими методами. По разно-
сти работ адсорбции определите разность числа групп (СН2) в углеводородной цепи молекул известного и неизвестного ПАВ (уравнение (IV.3). Определите формулу неизвестного ПАВ.
|
|
|
|
|
|
|
|
Таблица 12.5 |
|
|
Результаты измерений и расчетов характеристик ПАВ |
||||||
Результаты измерений |
|
Неизвестное ПАВ |
|
Известное ПАВ |
||||
|
|
и вычислений |
|
|
|
|
||
Температура опыта (t), оС |
|
|
|
|
||||
Константа прибора (из опыта 1) |
|
|
|
|||||
Поверхностное натяжение чистого |
|
|
|
|||||
растворителя (σ·103), Дж/м2 (из |
|
|
|
|||||
опыта 1) |
|
|
|
|
|
|
|
|
Концентрация (С), моль/л |
|
0,1 |
|
0,1 |
||||
Показания манометра (h), мм |
|
|
|
– |
||||
Поверхностное натяжение (σ·103), |
|
|
… |
|||||
Дж/м2 |
|
|
|
|
|
|
|
(из опыта 1) |
Предельная адсорбция (Г∞·106), |
|
|
… |
|||||
моль/м2 |
|
|
|
|
|
|
|
(из опыта 1) |
Показатель степени |
экспоненты |
|
|
|
||||
КонстантаГ |
адсорбции |
|
|
|
|
… (1) |
||
( K′и К), м3/моль |
|
|
|
|
|
… (2) |
||
Поверхностная |
активность |
(g), |
|
|
… (1) |
|||
Дж·м/моль |
|
|
|
|
|
… (2) |
||
Работа |
адсорбции |
(L и |
L), |
|
|
… (1) |
||
кДж/моль |
|
|
' |
|
|
|
… (2) |
|
Разность |
работ |
адсорбции |
двух |
|
|
|
||
ПАВ(L –L), кДж/моль |
|
|
|
|
|
|||
Работа' |
адсорбции на одно звено |
|
0,17 |
|||||
углеводородной |
цепи |
(LC), |
|
|
|
|||
кДж/моль |
|
|
|
|
|
|
|
|
Разность числа групп (СН2) двух |
|
|
|
|||||
ПАВ ( nC) |
|
|
|
|
|
|
|
|
Формула |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
157 |
|
КОНТРОЛЬНЫЕ ВОПРОСЫ
1.Что такое адсорбция, адсорбент, адсорбат? Каковы единицы измерения адсорбции?
2.Что такое поверхностная активность? Как ее определяют? Какие вещества называются поверхностно-активными и поверх- ностно-инактивными?
3.Как располагаются адсорбированные молекулы ПАВ в поверхностном слое?
4.Приведите уравнение изотермы адсорбции Гиббса.
5.При каких допущениях выполняется уравнение Ленгмюра? Выведите его.
6.Каков принцип действия прибора Ребиндера?
7.Вычислите размеры молекулы ПАВ, используя справочные данные о длинах связей, и сравните их с полученными в
опыте 1.
8.Выведите уравнение Шишковского совместным решением уравнений Гиббса и Ленгмюра.
9.Выведите уравнение, связывающее поверхностную активность с константой адсорбции.
158

Р а б о т а 13
ИЗУЧЕНИЕ АДСОРБЦИИ УКСУСНОЙ КИСЛОТЫ НА АКТИВИРОВАННОМ УГЛЕ
Цель работы: определение адсорбции статическим методом; построение изотермы адсорбции; вычисление величины предельной адсорбции.
Приборы и оборудование:
весы технические Scout II, бюретка на 25 мл с автоматически устанавливающимся уровнем для раствора уксусной кислоты, бюретка для щелочи на 25 мл, цилиндр на 100 мл, колбы конические на 500 мл (3 шт.), 250 мл (3 шт.), 100 мл (1 шт.), колбы мерные на 200 мл (3 шт.), 100 мл (1 шт.), 50 мл (2 шт.), ложка для активированного угля, пипетки на 25, 10 и 5 мл, капельница для фенолфталеина, емкость для сбора отработанного активированного угля.
Реактивы:
растворы уксусной кислоты СН3СООН (1 М), щелочи NaOH или КОН (0,1 М);
0,1 % раствор фенолфталеина в 70 % растворе этилового спирта; уголь активированный марки БАУ; дистиллированная вода.
Внеаудиторная подготовка
Ознакомьтесь со следующими темами: адсорбция, статический метод изучения адсорбции, изотермы адсорбции Лэнгмюра и Фрейндлиха, факторы, влияющие на величину адсорбции и вид изотермы.
Величина адсорбции зависит от многих факторов: природы адсорбата и адсорбента (их химического и структурного соответствия), площади и состояния поверхности, от концентрации адсорбата, присутствия других компонентов, температуры.
Чем больше развита поверхность адсорбента, тем большее количество вещества он может адсорбировать. У непористых адсор-
159
бентов (сажи, аэросила, диоксида титана и др.) величина удельной поверхности составляет от нескольких м2/г до сотен м2/г. Наличие в твердом теле пор (как в случае активированного угля или силика-
геля) может приводить к увеличению удельной поверхности до сотен и тысяч м2/г.
Активированный уголь и силикагель (гель кремниевой кислоты) относятся к числу наиболее распространенных адсорбентов. Уголь хорошо адсорбирует малополярные газы и пары с высокой температурой конденсации (Cl2, SO2, NH3, углеводороды), но не эффективен в случае высокополярных газов и паров (Н2О) и газов с низкой температурой конденсации (Н2, СО, N2). Силикагель, напротив, лучше адсорбирует пары воды и полярные газы. На силикагеле лучше адсорбируются неорганические вещества, а на активированном угле – органические. При адсорбции из растворов растворитель и растворенное вещество адсорбируются одновременно, а значит адсорбция растворителя затрудняет адсорбцию растворенных веществ. Поэтому в растворах на основе органических растворителей хорошим адсорбентом является силикагель, а в водных растворах – уголь. Среди жирных кислот одного гомологического ряда на силикагеле лучше адсорбируются кислоты с короткой углеводородной цепью, а на угле – с длинной. Однако следует учитывать, что адсорбируемость различных компонентов может изменяться при изменении размеров пор адсорбента. Так, по мере уменьшения размеров пор относительно увеличивается адсорбция молекул с лучшей адсорбируемостью, но лишь до тех пор, пока эти молекулы могут проникать внутрь пор. Если размеры пор меньше размера молекул, адсорбция таких молекул отрицательна.
Количество адсорбата, приходящегося на единицу массы или единицу поверхности адсорбента, зависит от его концентрации в объеме фазы. Вид соответствующих кривых определяется природой адсорбата и адсорбента и состоянием поверхности. Для простейшего случая монослойной лэнгмюровской адсорбции, удовлетворяющей рассмотренным в начале главы допущениям, в области малых концентраций адсорбция практически линейно зависит от концентрации, однако при больших концентрациях имеет место тенденция к насыщению (рис. 13.1).
160
