
Карцев В.Г.Избранные методы с-за и модифик. гетероциклов т.2 , 2003
.pdf
1.Касьян А.О., Зленко Е.Т., Тарабора И.Н., Оковитый С.И., ЖОрХ 1999 35
(7)1042.
2.Касьян А.О., Зленко Е.Т., ЖОрХ 2001 37 (12) 1640.
3.Касьян А.О., Красновская О.Ю., Зленко Е.Т., ЖОрХ 1996 32 (8) 1156.
4.Патент США 29 261 772, 1960; РЖХим. 1961 18Л278.
5.Касьян А.О., Красновская О.Ю., Оковитый С.И., Касьян Л.И., ЖОрХ 1995
31 (3) 357.
6.Sera A., Jtoh J., Yamaguchi H., Tetrahedron Lett. 1990 31 (45) 6547.
7.Just G., Liak T., Lim M., Can. J. Chem. 1980 58 (18) 2024.
8.Just G., Martel A., Tetrahedron Lett. 1973 17 1517.
9.Grieco P.A., Zelle R., Lis R., Finn J., J. Am. Chem. Soc. 1983 105 1403.
10.Мамедов М.К., Набиев Е.К., ЖОрХ 2001 37 (12) 1871.
11.Емельянов Н.П., Наумова Л.В., Козлов Н.С., Докл АН БССР 1967 2
(2)140.
Генеральный спонсор и организатор – InterBioScreen Ltd. |
21 |
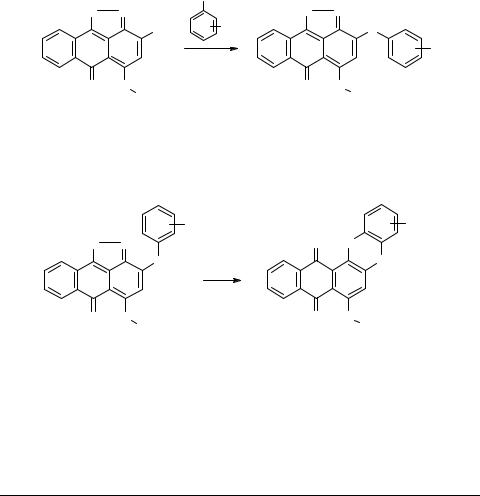
Реакции 6H-6-оксоантра[1,9-cd]изоксазолов с S-нуклеофилами
Арнольд Е.В., Сайботалова Г.Р., Юносова О.Н., Подвязный О.В., Горностаев Л.М.
Красноярский государственный педагогический университет 660049, Красноярск, ул. Лебедевой, 89
Найдено, что 6H-6-оксоантра[1,9-cd]изоксазолы 1, содержащие галоген в положении 3 достаточно легко реагируют с некоторыми S-нуклеофилами (арентиолы, тиомочевина). Ранее сообщалось лишь о реакции подобных субстратов с некоторыми простейшими арентиолами [1].
O |
N |
SH |
O |
N |
|
X |
|||||
|
Br |
|
S |
||
|
|
|
|
X |
|
O |
HN R |
|
O |
HN R |
|
1 |
|
R = Ar, Alk |
2 |
|
|
|
|
|
|
Полученные изоксазолы 2 могут изомеризоваться в фенотиазины 3 по аналогии с данными [2]. Особый интерес представляют продукты 3, содержащие в фенотиазиновом фрагменте карбоксильную группу.
|
|
CO2H |
|
CO2H |
O |
N |
|
O |
HN |
|
S |
∆ |
|
S |
|
|
|
|
|
O |
HN R |
|
O |
HN R |
2 |
|
|
3 |
|
Такие производные 3 далее могут быть модифицированы по карбоксильной группе с выходом на аналоги активных антиаритмических препаратов [3], антиконвульсантов [4] и др.
1.Лаврикова Т.И., Арнольд Е.В., Сакилиди В.Т. и др., ХГС 1993 (6) 822.
2.Горностаев Л.М., Левданский В.А., Фокин Е.П., ЖОрХ 1979 15 (8) 1692.
3.Yamamoto T., Hori M., Watanabe I., et al., Chem. Pharm. Bull. 2000 48 (6) 843.
4.Laws M.L., Roberts R.R., et al., Bioorg. Med. Chem. 1998 6 (12) 2289.
22 |
Стендовые доклады |
Синтез и свойства новых солей 2,2-пентаметилен- 6-фенил-4-[4-хлор-4-(4-метоксифенил)-1,3-бутадиенил]- 2H-[1,3]-диоксиния
Арсеньев В.Г., Олехнович Е.П., Олехнович Л.П.
Ростовский государственный университет 344090, Ростов-на-Дону, ул. Зорге, 7
Соли 2H-[1,3]-диоксинилия 1, впервые полученные нами в 1993 г., проявили высокую активность алкильных заместителей в реакциях с электрофилами – арилальдегидами, формамидами, сульфоксидами, триэтилортоформиатом [1]. Полученные в результате реакции с последним этоксивинильные производные оказались реакционноспособными по отношению к различным C- и N-нуклеофилам [2].
В продолжение этих исследований из перхлората 4-метил-2,2-пентаметилен- 6-фенил-2H-[1,3]-диоксинилия 1 и 3-(4-метоксифенил)-3-хлорпропеналя 2 нами получены соответствующие 4-[4-хлор-4-(4-метоксифенил)-1,3-бутадиенил]-произ- водные 3.
− R |
R' |
|
H |
Cl |
|
R |
R' |
− |
R |
R' |
− |
|
|
|
|
||||||||
ClO4 O + |
O |
O |
2 |
|
Ar |
O + |
O |
ClO4 Cl |
O |
O |
ClO4 Cl |
|
|
AcOH, Ac2O Ph |
|
|
|
|
|
+ |
|||
Ph |
|
|
|
|
Ar Ph |
|
Ar |
||||
1 |
|
|
|
|
a |
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
d |
|
|
|
R |
R' |
ClO− |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
4 |
|
+ |
Ar' |
b |
|
|
Ph |
|
|
O |
O |
|
|
|
|
|
|
||||
|
|
N |
|
|
|
c |
|
|
|
||
|
|
|
|
|
|
|
|
N N |
|
||
Ph |
|
|
|
|
Ar |
|
|
|
|
||
|
4 |
R |
R' |
|
|
X |
|
|
|
H |
Ar |
|
ClO−4 |
|
|
|
7 |
||||||
|
|
+ |
|
O |
OH |
Cl |
|||||
|
|
O |
O |
|
|
N |
|
Cl |
|
||
|
Ph |
|
5 |
|
|
|
Ar |
Ph |
6 |
Ar |
|
|
|
|
|
|
|
|
|
|
|
||
R+R' = (CH2)5; Ar = 4-MeOC6H4; Ar' = 4-BrC6H4, 4-PhNHC6H4; X = O, NH, CH2; a - Ar'NH2, CHCl3; b - морфолин, пиперазин или пиперидин, CHCl3;
c - ДМФА, H2O, NaHCO3; d - NH2NH2·H2O, MeCN
Предполагалось, что при взаимодействии 3 с нуклеофилами, как и в случае этоксивинилпроизводных, будет происходить лишь нуклеофильное замещение хо-
Генеральный спонсор и организатор – InterBioScreen Ltd. |
23 |

рошей уходящей группы – в данном случае атома хлора. Действительно, в реакциях с ариламинами и циклическими диалкиламинами реализовался этот путь и образовались иминиевые соли 4 и 5, соответственно. Однако, более жесткие нуклеофилы предпочтительно атаковали гетероцикл – основный гидролиз привел к кетоенолу 6, а реакция с гидразин-гидратом – к пиразолу 7. По-видимому, различная направленность реакций обусловлена как стерическими причинами, так и характером нуклеофила.
Структуры всех соединений подтверждены методами ИК и ЯМР 1H спектроскопии.
1.Олехнович Е.П., Арсеньев В.Г., Олехнович Л.П. и др., ХГС 1996 (11/12) 1445.
2.Арсеньев В.Г., Олехнович Е.П., Бородкин Г.С. и др., ЖОрХ 1998 34 (12) 1852.
24 |
Стендовые доклады |
Синтез производных новой трициклической системы фуро[3',4':6,7]циклогепта[b]пиранона-7 на основе 8-гидрокси-4H-циклогепта[c]фуранона-4
и арилиденмалононитрилов
Арсеньева М.Ю., Арсеньев В.Г., Олехнович Л.П.
Ростовский государственный университет 344090, Ростов-на-Дону, ул. Зорге, 7
Ранее было установлено, что взаимодействие арилиденмалононитрилов 1 с электронообогащенными фенолами, нафтолами и другими нуклеофильными енолами приводит к производным 2-амино-4Н-пиранов [1, 2].
Нами осуществлена реакция 1 с 8-гидрокси-1,3-диметил-4H-циклогепта[c]- фураноном-4 2 с целью изучения его нуклеофильных свойств. Как и предполагалось, кипячение смеси 1 и 2 в спирте в присутствии каталитических количеств пиперидина привело к получению соответствующих производных 2-амино-8,10- диметил-4H,7H-фуро[3',4':6,7]циклогепта[b]пиранона-7 3.
Обнаруженная реакция является первым примером аннелирования 4H-пира- новой системы к гидрокситропону. Ранее ни моноциклические гидрокситропоны, ни их бензоили гетероаннелированные производные в подобное превращение не вводились.
|
O |
|
O |
|
Ar |
|
пиперидин |
|
|
+ |
O |
O |
||
EtOH |
||||
NC CN |
|
|
||
|
Ar |
|
||
|
OH |
O |
||
|
|
|||
|
|
NC |
NH2 |
|
|
2 |
|
||
1 |
|
3 |
Ar = 4-MeOC6H4, 2-ClC6H4 и др.
Строение синтезированных соединений подтверждено данными ЯМР 1H спектроскопии.
1.Elagamey A.G.A., Sawllim S.Z., El-Taweel F.M.A., et al., Collect. Czech. Chem. Commun. 1988 53 1534.
2.Шаранин Ю.А., Промоненков В.К., Шаранина Л.Г., ЖОрХ 1982 18 (3) 625.
Генеральный спонсор и организатор – InterBioScreen Ltd. |
25 |
Синтез, свойства и использование диоксолановых и дитиолановых производных в трансформациях
8-аза-D-гомогона-12,17a-дионов (2,3,4,6,7,11b,12,13-
октагидро-1Н-изохино[2,1-a]хинолин-1,13-дионов)
Ахрем А.А., Гулякевич О.В., Михальчук А.Л.
ГНУ Институт биоорганической химии Национальной Академии наук Беларуси 220141, Минск, ул. aкад. В.Ф. Купревича, 5/2
Енаминодикарбонильный (ЕДК) или α-ацил-β-аминовинилкарбонильный (ААВК) фрагмент 1 является ключевой частью структуры многих фармакологически активных соединений, в частности, проявляющих иммуномодулирующие свойства 8-аза- стероидов (8-ас) 2 [1, 2]. Для получения новых производных 8-ас нами разработан синтез диоксолановых и дитиолановых производных по С(12)- и С(17а)-карбо- нильным группам [3, 4].
|
O |
O |
|
|
|
O |
O |
|
|
|
α |
|
|
|
R' 12 |
α |
17a R'' |
|
|
|
N β |
|
R |
|
|
N β |
X |
|
|
|
|
|
|
|
|
|
|
||
|
1 |
|
R |
|
|
2 |
|
|
|
O |
O |
O |
S |
|
S O |
R'' |
O |
S |
S |
R' |
|
R'' |
R' |
|
|
R' |
|
R'' |
|
|
N |
X |
|
N |
X |
|
N |
|
X |
|
|
|
|
|
|
|
|||
|
3 |
|
|
|
4 |
|
|
5 |
|
Такие производные 8-ас представляют также интерес как модели для изучения взаимовлияния пространственно сближенных молекулярных фрагментов.
С целью выяснения этих и других вопросов строения и свойств 8-ас нами осуществлен синтез, изучены свойства и некоторые превращения диоксолановых и дитиолановых производных 8-аза-D-гомогона-12,17а-дионов 3–5.
Установлено, что диоксолановые производные образуются только по С(12)- карбонильной группе 3. В тоже время дитиолановые производные образуются как по С(12)-, так и по С(17а)-карбонильным группам 4, 5. Образования диоксолановых или дитиолановых производных одновременно по С(12)- и по С(17а)-карбо- нильным группам в изученном ряду соединений не установлено.
26 |
Стендовые доклады |

В докладе приводятся и обсуждаются физико-химические и спектральные характеристики производных 3–5, влияние структуры 8-ас на образование производных 4, 5, некоторые трансформации производных 3–5.
1.Ахрем А.А., Кузьмицкий Б.Б., Лахвич Ф.А. и др., в сб. Химия и биология иммунорегуляторов, Зинатне: Рига, 1985, с. 265.
2.Конопля Н.А., Гулякевич О.В., Михальчук А.Л., Кузьмицкий Б.Б., Весці АН Беларусі, Сер. хім. навук 1994 (3) 91.
3.Михальчук А.Л., Гулякевич О.В., Ахрем А.А., ЖОрХ 1992 28 (8) 1771.
4.Гулякевич О.В., Михальчук А.Л., Ахрем А.А., ХГС 1995 (2) 187.
Генеральный спонсор и организатор – InterBioScreen Ltd. |
27 |
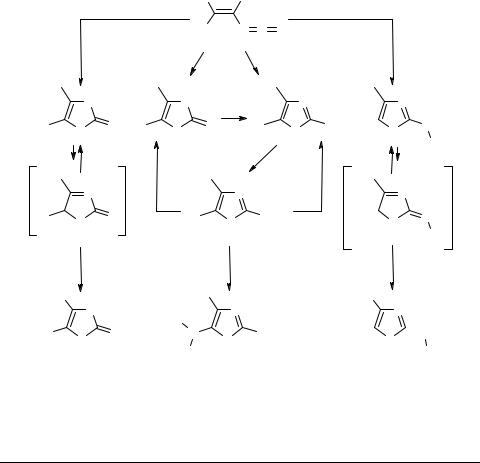
Синтезы новых трифункциональных производных 1,3-тиазола на основе 1-тозил-2,2-дихлорэтенилизо- тиоцианата
Бабий С.Б., Зябрев В.С., Драч Б.С.
Институт биоорганической химии и нефтехимии НАН Украины 02094, Киев, ул. Мурманская, 1
Недавно нами предпринято систематическое исследование циклоконденсаций доступного 1-тозил-2,2-дихлорэтенилизотиоцианата 1 с различными O-, S- и N-нуклео- филами. Показана возможность активного использования реагента 1 для синтеза целого ряда новых трифункционально замещенных тиазолов 2–9, представленных на схеме.
|
|
MeOH, Py |
Cl |
|
Ts |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HBr |
Cl |
|
N |
C S |
|
|
|
|
|
|
|
1 |
|
|
|
|
|
Na |
S.9H O |
|
|
RSH, Et |
N |
|
|
|
2 |
2 |
|
|
|
3 |
|
Ts |
|
Ts |
|
|
|
Ts |
|
|
|
NH |
NH |
|
RHal |
|
|
N |
|
|
|
O Cl |
|
S |
|
|
|
|
Cl |
S |
S |
Cl |
S |
|
|||
|
|
|
|
|
|
|||
|
|
2 |
3 |
|
H2O2 |
|
4 |
|
Ts |
|
|
Ts |
|
|
RSH |
||
|
N |
NaSH |
|
N |
|
|||
|
|
|
Et3N |
|||||
Cl |
S |
O |
Cl |
|
S |
SO2R |
|
|
|
2a |
|
|
|
6 |
|
|
|
|
|
2Ar'SH |
|
|
2R'R"NH |
|
|
|
|
|
2Et3N |
|
|
|
|
|
|
Ar'S |
|
NH |
Ts |
N |
|
|
|
|
|
|
R' |
|
|
|
|
||
Ar'S |
|
O |
|
|
SO2R |
|
|
|
S |
N |
|
S |
|
|
|||
|
7 |
|
R'' |
|
8 |
|
|
|
R = Alk, Ar; R'R"N = AlkNH, Alk2N, O(CH2)4N
2ArNH2
Ts
SR Cl
Ts
Cl
Ar'S
Ar'S
N |
|
|
S |
NH |
|
Ar |
||
5 |
||
N |
|
|
S |
N |
|
5a |
Ar |
2Ar'SH 2Et3N
N
S  NH 9 Ar
NH 9 Ar
1.Бабий С.Б., Зябрев В.С., Драч Б.С., ЖОХ 2002 72 1834.
2.Бабий С.Б., Зябрев В.С., Драч Б.С., ЖОХ 2002 72 1813.
28 |
Стендовые доклады |
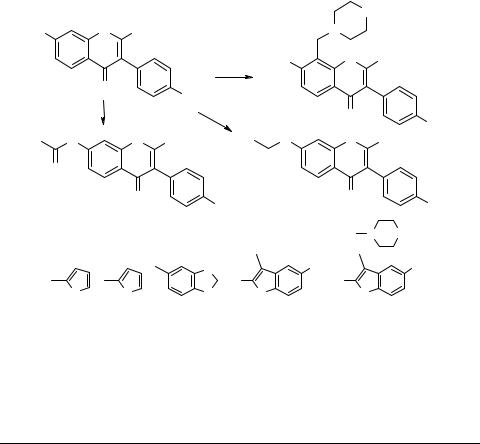
Синтез производных формононетина
Бондаренко С.П., Фрасинюк М.С., Хиля В.П.
Киевский национальный университет им. Тараса Шевченко 01033, Украина, Киев, ул. Владимирская, 64
Известен широкий спектр биологического действия природных изофлавоноидов [1].
Внастоящей работе нами синтезированы производные формононетина – 4'-метокси- 7-гидроксиизофлавона.
Для модификации полученых изофлавонов [2, 3] были использованы реакции ацилирования, алкилирования и аминометилирования. В качестве ацилирующих реагентов использованы хлорангидриды ароматических и гетероциклических кислот, замещенные карбамоилхлориды и этиловый эфир хлоругольной кислоты.
Вусловиях реакции алкилирования были получены эфиры 4-оксо-4H-хроменил-7- оксиуксусных кислот, а также замещенные 7-бензилокси- и 7-фенацилоксипроиз- водные.
Сцелью получения оснований Манниха были использованы аминали с остатками пиперидина и пиперазина.
|
|
|
|
|
|
X |
HO |
O |
R |
|
|
N |
|
|
|
|
|
HO |
O |
R |
|
O |
|
OMe |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
OMe |
|
|
|
|
|
|
|
R' |
O |
O R |
R'' |
O |
O |
R |
|
O |
|
|
|
|
|
|
|
O |
OMe |
|
O |
OMe |
R = H, Me, CF3, CO2Et; |
|
|
||||
|
|
|
N O , |
|||
R' = OEt, Et2N, Ph2N, 3,4-MeOC6H3, 3,4,5-MeOC6H2, CH=CHPh, |
||||||
|
|
|
O |
|
OEt |
OAc |
|
, |
, |
, Ph |
O |
, Ph |
; |
|
O |
S |
O |
|
O |
|
R" = MeOCO, EtOCO, CH=CHPh, Ph, 4-MeOC6H4, COPh;
X = CH2, CHMe, NMe, NCH2CH2OH
Работа выполнена при поддержке InterBioScreen–Эксимед.
1.Казаков А.Л., Хиля В.П., Межерицкий В.В. и др., Природные и модифициро-
ванные изофлавоноиды, Ростов-на-Дону: Изд. РГУ, 1985.
2.Szabo V., Borbely S., Darbai M., Maqy. Kem. Foly. 1975 81 (7) 311.
3.Levai A., J. Chem. Res. Synop. 1992 5 163.
Генеральный спонсор и организатор – InterBioScreen Ltd. |
29 |

Реакция Харда–Моури в синтезе новых производных кумарина
Борисов А.В., Джавахишвили С.Г., Горобец Н.Ю., Никитченко В.М.
Харьковский Национальный университет им. В.Н. Каразина 61077, Украина, Харьков, пл. Свободы, 4
Реакция Харда–Моури [1], приводящая к производным 1,2,3-тиадиазола, в последние годы активно изучается [2–7]. Анализ литературных данных, однако, выявил некоторые противоречия относительно продуктов и механизма этой реакции. Нас привлекла возможность объединения двух интересных с точки зрения биологической активности структурных фрагментов 1,2,3-тиадиазола и кумарина в одной молекуле. Нами было изучено взаимодействие тозилгидразонов 3-ацетилкумари- нов с хлористым тионилом в различных условиях.
|
|
|
|
|
|
Ts |
|
|
SOCl2 (1.1 эк.), |
|
N |
N |
|
|
|
|
|
S O |
||
|
|
80°C, ДХЭ, 1 ч |
R |
|
|
|
N |
NHTs |
A |
O |
|
||
O |
|
|||||
|
|
|
|
|
||
|
|
|
|
2a−h (75−85%) |
|
|
R |
|
|
|
Et3N |
N |
N |
O O |
|
|
|
[1] |
||
|
SOCl2 |
(20 эк.), |
|
|
S |
|
1a−i |
|
|
|
|
||
|
80°C, 1 ч |
|
|
|
||
|
|
R |
|
|
||
|
|
B |
|
|
||
|
|
O |
O |
|
||
|
|
|
|
|
||
3a−i (80−95%)
ДХЭ - СlCH2CH2Cl
R = 6-Cl (a); 6-Br (b); 6-MeO (c); 6-NO2 (d); 5,6-benzo (e); 6-t-Bu,8-OH (f); 8-MeO (g); 6,8-Cl (h); 7-Et2N (i)
Были найдены оптимальные условия как для получения производных 3-(2,5- дигидро-[1,2,3]-тиадиазол-1-оксид)кумаринa 2а–h c примесью соответствующих 3-([1,2,3]-тиадиазолил-4)кумаринов 3а–h менее чем 5% (метод A), так и для производных 3-([1,2,3]-тиадиазолил-4)кумарина 3а–i (метод B). В случае 7-диэтилами- нокумарина 1i наблюдалось только превращение в соответствующий 3-([1,2,3]- тиадиазолил-4)кумарин 3i. Интересно отметить, что ожидаемое превращение тиадиазолоксидов 2а–h в тиадиазолы 3а–h не наблюдалось в предложенных авторами [1] условиях.
30 |
Стендовые доклады |
