
БХ
.pdf
метаболизма, химическом составе и строении различных тканей и различных организмов имеются и бесспорные различия. Что касается метаболизма, то особенности его в соответствующих органах или тканях, несомненно, определяются набором ферментов. Различия в химическом составе органов и тканей тоже зависят от их ферментного состава, в первую очередь от тех ферментов, которые участвуют в процессах биосинтеза. Не исключено, что и более очевидные различия, касающиеся строения и формы тех или иных органов и тканей, также имеют энзимологическую природу: Известно, что строение и форма находятся под контролем генов; контроль осуществляется путем образования специфических белков, из которых главными для организации тканей являются ферменты я транспортные системы. Продуктами генов могут быть также белки, не обладающие каталитическими свойствами, но играющие важную роль в «встраивании» ферментных белков в соответствующие структурные ансамбли, например мембраны; однако такие молекулы можно рассматривать как компоненты катализаторов, поскольку они находятся в теснейшей взаимосвязи с ними.
27.Изменение активности ферментов при болезнях. Наследственные энзимопатии. Происхождение ферментов крови и значение их определения при болезнях.
В основе многих заболеваний лежат нарушения функционирования ферментов в клетке - энзимопатии. Различают первичные (наследственные) и вторичные (приобретённые) энзимопатии. Приобретённые энзимопатии, как и вообще протеинопатии, по-видимому, наблюдают при всех болезнях.
При первичных энзимопатиях дефектные ферменты наследуются, в основном, по аутосомнорецессивному типу. Гетерозиготы, чаще всего, не имеют фенотипических отклонений. Первичные энзимопатии обычно относят к метаболическим болезням, так как происходит нарушение определённых метаболических путей. При этом развитие заболевания может протекать по одному из ниже перечисленных "сценариев". Рассмотрим условную схему метаболического пути:
Вещество А в результате последовательных ферментативных реакций превращается в продукт Р. При наследственной недостаточности какого-либо фермента, например фермента Е3, возможны разные нарушения метаболических путей: Нарушение образования конечных продуктов. Недостаток конечного продукта этого метаболического пути (Р) (при отсутствии альтернативных путей синтеза) может приводить к развитию клинических симптомов, характерных для данного заболевания:
Клинические проявления. В качестве примера можно рассмотреть альбинизм. При альбинизме нарушен синтез
вмеланоцитах пигментов - меланинов. Меланин находится в коже, волосах, радужке, пигментном эпителии сетчатки глаза и влияет на их окраску. При альбинизме наблюдают слабую пигментацию кожи, светлые волосы, красноватый цвет радужки глаза из-за просвечивающих капилляров. Проявление альбинизма связано с недостаточностью фермента тирозингидроксилазы (тирозиназы) - одного из ферментов, катализирующего
метаболический путь образования меланинов Накопление субстратов-предшественников. При недостаточности фермента Е3 будут накапливаться вещество С, а
также во многих случаях и предшествующие соединения. Увеличение субстратов-предшественников дефектного фермента - ведущее звено развития многих заболеваний:
Клинические проявления. Известно заболевание алкапгонурия, при котором нарушено окисление гомогентизиновой кислоты в тканях (гомогентизиновая кислота - промежуточный метаболит катаболизма тирозина). У таких больных наблюдают недостаточность фермента окисления гомогентизиновой кислоты - диоксигеназы гомогентизиновой кислоты, приводящей к развитию заболевания. В результате увеличиваются концентрация гомогентизиновой кислоты и выведение её с мочой. В присутствии кислорода гомогентизиновая кислота превращается в соединение чёрного цвета - алкаптон. Поэтому моча таких больных на воздухе окрашивается в чёрный цвет. Алкаптон также образуется и в биологических жидкостях, оседая в тканях, коже,
сухожилиях, суставах. При значительных отложениях алкаптона в суставах нарушается их подвижность.
Нарушение образования конечных продуктов и накопление субстратов предшественников. Отмечают заболевания,
когда одновременно недостаток продукта и накопление исходного субстрата вызывают клинические проявления.
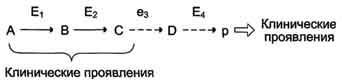
Клинические проявления. Например, у людей с болезнью Гирке (гликогеноз I типа) наблюдают снижение концентрации глюкозы в крови (гипогликемия) в перерывах между приёмами пищи. Это связано с нарушением распада гликогена в печени и выходом из неё глюкозы вследствие дефекта фермента глюкозо-6- фосфатфосфатазы. Одновременно у таких людей увеличиваются размеры печени (гепатомегалия) вследствие накопления в ней не используемого гликогена.
Особый интерес для клиники представляет исследование активности индикаторных ферментов в сыворотке крови, так как по появлению в плазме или сыворотке крови ряда тканевых ферментов в повышенных количествах можно судить о функциональном состоянии и поражении различных органов (например, печени, сердечной и скелетной мускулатуры). При остром инфаркте миокарда особенно важно исследовать активность креатинкиназы, АсАТ, ЛДГ и оксибутиратдегидрогеназы. При заболеваниях печени, в частности при вирусном гепатите (болезнь Боткина), в сыворотке крови значительно увеличиваетсяактивность АлАТ и АсАТ, сорбитолдегидрогеназы, глутаматдегидрогеназы и некоторых других ферментов. озрастание активности
ферментов сыворотки крови при многих патологических процессах объясняется прежде всего двумя причинами: 1) выходом в кровяное русло ферментов из поврежденных участков органов или тканей на фоне продолжающегося ихбиосинтеза в поврежденных тканях; 2) одновременным повышением каталитической активности некоторых ферментов, переходящих вкровь. Возможно, что повышение активности
ферментов при «поломке» механизмов внутриклеточной регуляции обмена веществсвязано с прекращением действия соответствующих регуляторов и ингибиторов ферментов, изменением под влиянием различных факторов строения и структуры макромолекул ферментов.
28.Применение ферментов для лечения болезней. Применение ферментов как аналитических реагентов при лабораторной диагностике (определении глюкозы, этанола, мочевой кислоты и т.д.). Иммобилизованные ферменты
Второе направление медицинской энзимологии – энзимодиагностика – развивается по двум путям. Один путь – использование ферментов в качестве избирательных реагентов для открытия и количественного определения нормальных или аномальных химических веществ в сыворотке крови, моче, желудочном соке и др. (например, выявление при помощи ферментов глюкозы, белка или других веществ в моче, в норме не обнаруживаемых). Другой путь – открытие и количественное определение самих ферментов в биологических жидкостях при патологии. Оказалось, что ряд ферментов появляется в сыворотке крови при распаде клеток (отсюда их название «некротические ферменты»). Для диагностики органических и функциональных поражений органов и тканей широко применяются отдельные ферментные тесты, выгодно отличающиеся от других химических диагностических тестов, используемых в клинике, высокой чувствительностью и специфичностью. Известно около 20 тестов, основанных на количественном определении активности ферментов(и изоферментов), главным образом в крови (реже в моче), а также в биоптатах (кусочки тканей, полученные при биопсии). Следует отметить, что из огромного
числа ферментов (более 3500), открытых в природе (частично и в организме человека), в диагностической энзимологии используется лишь ограниченный набор ферментов и для весьма небольшого числа болезней (гепатиты, инфаркт миокарда, органические поражения почек, поджелудочной железы, печени и др.). Так, уровень липазы, амилазы, трипсина и химотрипсина в крови резко увеличен при сахарном диабете, злокачественных
поражениях поджелудочной железы, болезнях печени и др. Резко повышается в сыворотке крови уровень двух аминотрансфераз, креатинкиназы (и ее изоформ) и лактатдегидрогеназы (и ее изоформ) при инфаркте миокарда; умеренно повышено их содержание при поражениях тканей мозга и печени. Определяют, кроме того,активность кислой фосфатазы (уровень повышен при карциноме предстательной железы), щелочной фосфатазы, холинэсте-разы и некоторых других органоспецифических ферментов (например, гистидазы, уроканиназы,
глицинамидинотрансферазы) в сыворотке крови при патологии костной ткани, печени, метастатических карциномах и т. д. Доказано, что органы и ткани человека характеризуются специфическим ферментным и изоферментным спектром, подверженным не только индивидуальным, но и суточным колебаниям. Существует большой градиент концентрации ферментов между внутриклеточными и внеклеточными частями тела. Поэтому любые, даже
незначительные, повреждения клеток (иногда функциональные расстройства) приводят к выделению ферментов во внеклеточное пространство, откуда они поступают в кровь. Механизм гиперферментации (повышенное содержание ферментов в крови) до конца не расшифрован. Повышение уровня внутриклеточных ферментов в плазме крови прямо зависит от природы повреждающего воздействия, времени действия и степени повреждения
биомембран клеток и субклеточных структур органов. В оценке ферментных тестов для диагностических целей особое значение имеет знание периода полужизни (полураспада) в плазме крови каждого из диагностических ферментов, что делает важным выбор точного времени для ферментного анализа крови. Весьма существенным является также знание
особенностей распределения (топографии) ферментов в индивидуальных органах и тканях, а также их внутриклеточной локализации.
Впоследнее время стали применять ферменты рестрикции – специфические эндонуклеазы катализирующие разрывы межнуклео-тидных связей ДНК, для диагностики фенилкетонурии, α- и β-талассемии и других наследственных болезней человека. Метод основан на полиморфизме рестрикционных фрагментов ДНК.
Из представленных данных следует, что диагностическая энзимология может служить основой не только для постановки правильного и своевременного диагноза болезни, но и для проверки эффективности применяемого метода лечения.
Дальнейшее развитие диагностической энзимологии преимущественно идет по двум перспективным направлениям медицинской энзимологии: по пути упрощения и рациональной модификации уже испытанных методов и по пути поиска новых органоспецифических (тканеспецифических) ферментов и изоферментов.
Третье направление медицинской энзимологии – энзимотерапия, т.е. использование ферментов и модуляторов (активаторов иингибиторов) действия ферментов в качестве лекарственных средств, имеет пока небольшую историю. До сих пор работы в этом направлении почти не выходят за рамки эксперимента. Исключение составляют некоторые про-теиназы: пепсин, трипсин, химотрипсини их смеси (абомин, химопсин), которые применяют для лечения ряда болезней пищеварительного тракта. Помимо протеиназ, ряд других ферментов, в частности РНКаза, ДНКаза, гиалуронидаза, коллагеназы, эластазы, отдельно или в смеси с протеина-зами используются при ожогах, для обработки ран, воспалительных очагов, устранения отеков, гематом, келоидных рубцов, кавернозных процессов при туберкулезе легких и др. Ферменты применяются также для лечения сердечно-сосудистых заболеваний, растворениясгустков крови. В нашей стране разработан первый в мире препарат иммобилизованной
стрептокина-зы, рекомендованный для лечения инфаркта миокарда. Калликреины – ферменты кининовой системы используются для снижения кровяного давления.
Важной и многообещающей областью энзимотерапии является применение ингибиторов ферментов. Так, естественные ингибиторы протеиназ (α1-трипсин, α1-химотрипсин, α-макроглобулин) нашли применение в терапии острых панкреатитов, артритов, аллергических заболеваний, при которых отмечается активация протеолиза и фибринолиза, сопровождающаяся образованием вазоактивных кининов.
Впоследнее время получило признание применение в онкологической клинике ферментов бактериальной природы в качествелекарственных средств. Широко используется L-аспарагиназа (выпускается в промышленных количествах и L- глутамин(аспарагин)аза для лечения острых и хронических форм лейкозов и лимфогранулематозов. Более десятка описанных в литературе бактериальных ферментов испытаны в основном на животных с перевивными опухолями или на раковых клетках опухолей человека и животных, выращенных в культуре ткани. Основными постулатами применения ферментов в онкологии являются различия в метаболизме клетокопухолей по сравнению с
обменом в нормальной, здоровой, клетке. В частности, современные стратегия и тактика энзимотерапии опухолевых поражений учитывают разную чувствительность нормальных и опухолевых клеток к недостатку (дефициту) незаменимых (так называемых эссенциальных) факторов роста. К таким ростстимулирующим факторам относятся не только пищевые факторы (витамины, незаменимые аминокислоты, макро- и микроэлементы), но и ряд так называемых заменимых веществ, включая заменимые аминокислоты, к недостатку которых опухолевая клетка оказывается в силу особенностей ее обмена более чувствительной, чем нормальная. Лечебный
эффект, например, L-аспарагиназы и L-глутамин (аспа-рагин)азы при лейкозах, вероятнее всего, объясняется необратимым распадом как глутамина, так и аспарагина. Оказалось, что опухолевые клетки для своего роста и размножения нуждаются в аминокислотах из организма, поскольку сами лишены способности синтезировать амиды аминокислот, в то время как нормальные клетки наделены этой способностью. Был сделан вывод о том, что амидный азот глутамина и аспарагина выполняет в клетках ряд уникальных функций, которые лучше выяснены для глута-мина. В частности, амидный азот глутамина оказался абсолютно необходимым и не заменимым другими аминокислотами источником атома азота минимум в 10 реакциях синтеза, например, пуриновых и
пиримидиновых нуклеотидов, соответственно ДНК и РНК, АТФ, ге-ксозаминов, гистидина и др. Таким образом, не лишена основания гипотеза, что любой фермент или агент, катализирующий необратимое расщепление незаменимого для опухолевойклетки пищевого фактора (включая аминокислоты), может в принципе быть применен в энзимотерапии опухолей, если будут устранены ограничения, связанные с белковой природой фермента. В оценке эффективности ферментов в экспериментальной и клинической онкологии имеется немало противоречий и очень много пробелов. Положительные результаты, отмеченные в ряде случаев, вселяют надежду, что приготовление стандартных ферментных препаратов (включая создание иммобилизованных форм) в промышленных масштабах и их разумное применение в клинике, организованное на строгой научной основе, несомненно дадут в руки врачей еще одно ценное оружие в борьбе с опухолевыми заболеваниями человека.
Идея применения ферментов в качестве лекарственных средств (фармакологии ферментов) всегда казалась заманчивой. Однако их нестабильность, короткий период полураспада, нежелательные антигенные свойства, связанные с белковой природой ферментов и опасностью развития аллергических реакций, трудности доставки к пораженным органам и тканям (мишеням) существенно ограничивали возможности использования ферментных препаратов. В разработке методов иммобилизации ферментов наметились конкретные пути преодоления указанных трудностей: применение водорастворимых, биосовместимых носителей, например полимолочной кислоты (легко
разлагается в организме), использование методов химической модификации имикрокапсулирования, приготовление моно- и поликлональных антител и ферментсодержащих липосом и т.д.
В последнее время интенсивно разрабатываются методы направленного транспорта ферментов, заключенных в своеобразные микроконтейнеры (тени эритроцитов, липосомы и др.), к внешней поверхности которых могут быть прикреплены адресные (векторные) белковые молекулы (например, иммуноглобулины – антитела против специфических компонентов органа или ткани-мишени, в частности опухоли). Иммобилизованные ферменты в качестве лекарственных средств начали применять в специальных колонках для экстракорпоральной перфузии крови (типа искусственной почки). Такое лечение полностью исключает нежелательные воздействия наорганизм чужеродного белка и может проводиться длительное время.
29.Обмен веществ: питание, метаболизм и выделение продуктов метаболизма. Органические и минеральные компоненты пищи. Основные и минорные компоненты.
Условно процесс обмена веществ можно разделить на три этапа:
Первый этап — ферментативное расщепление белков, жиров и углеводов до растворимых в воде аминокислот, моно- и дисахаридов, глицерина, жирных кислот и других соединений, происходящее в различных отделах желудочнокишечного тракта, и всасывание их в кровь и лимфу.
Второй этап — транспорт питательных веществ кровью к тканям и клеточный метаболизм, результатом которого является их ферментативное расщепление до конечных продуктов. Часть этих продуктов используется для построения составных частей мембран, цитоплазмы, для синтеза биологически активных веществ и воспроизведения клеток итканей.
Расщепление веществ сопровождается выделением энергии, которая используется для процесса синтеза и обеспечения работы каждого органа и организма в целом.
Третий этап — выведение конечных продуктов метаболизма в составе мочи, кала, пота, через легкие в виде CO2 и т. д Для обеспечения всех этапов метаболизма организму необходимо питаться.
Современные исследования подтверждают жизненную важность минеральных элементов. Выявлены новые стороны их биологического действия, что позволило выделить большую группу биологически активных веществ - биомикроэлементов. Изучение минеральных веществ как необходимой составной части питания тесно связано c предупреждением распространения и ликвидацией ряда эндемических заболеваний: эндемического зоба, флюороза, кариеса, стронциевого рахита и др. Значительный вклад в развитие учения o биологическом значении минеральных элементов внесли исследования акад, B. И. Вернадского, который является основоположником учения о связи и сочетанности эволюционных процессов в химическом составе, происходящих в земной коре и организмах. B изучении роли минеральных элементов в возникновении некоторых эндемических заболеваний видное место занимают исследования акад. A. П. Виноградова, который создал учение о "биогеохимических провинциях", т. e. территориях c повышенным или недостаточным содержанием микроэлементов. Физиологическое значение минеральных элементов
восновном определяется их участием в:
1.структуре и функции большинства ферментных систем и процессов, протекающих в организме;
2.пластических процессах и построении тканей организма, особенно костной ткани, где фосфор и кальций являются основными структурными компонентами;
3.поддержании кислотно-щелочного состояния в организме;
4.поддержании нормального солевого состава крови и участия в структуре форменных ее элементов;
5.нормализации водно-соленого обмена. Физиологическое влияние минеральных элементов значительно шире их биологического их действия.
Оно распространяется на все системы организма и процессы, протекающие в них. Особая роль принадлежит минеральным веществам в поддержании в организме кислотно-щелочного состояния. Последнее необходимо для обеспечения постоянства внутренней среды организма. Обмен веществ и все биохимические процессы в организме протекают в условиях постоянства внутренней среды. Последнее обеспечивается различными регуляторными и буферными системами, a также многими другими факторами, среди которых наиболее важным является кислотнощелочное состояние. Оно поддерживается работой сложной системы регуляторов, объединенных в единое целое центральной нервной системой. Кислотно-щелочное состояние обеспечивает создание необходимой концентрации водородных ионов в клетках и тканях, межтканевых и межклеточных жидкостях и сообщает им осмотические свойства, необходимые для нормального течения процессов обмена
Незаменимые элементы пищи различны для разных видов живых организмов. Например, большинство видов млекопитающих синтезируют свою собственную аскорбиновую кислоту . Следовательно, она не

считается незаменимой для этих животных . Но она является незаменимым элементом в пище людей , которые нуждаются во внешних источниках аскорбиновой кислоты (известной как витамин C в контексте питания). Потребности организма человека колеблются широко. Так, человек массой 70 кг содержит 1,0 кг кальция , но только 3 мг кобальта. Многие незаменимые элементы пищи при приёме в чрезмерных количествах токсичны, что приводит к возникновению патологическогосостояния (напр., гипервитаминоза). Другие же можно потреблять без видимого вреда в количествах, больших, чем в типичном суточном рационе. Дважды Нобелевскийлауреат Лайнус
Полинг о витамине B3 (известном также как ниацин и ниацинамид) как-то сказал: «Меня ошеломила его очень низкая токсичность при том, что он оказывает такое значительное физиологическое влияние. Ежедневный приём крошечной малости, 5 мг, достаточен для того, чтобы сохранить жизнь умирающему от пеллагры , но у него нет токсичности в количествах в десятки тысяч раз больших, которые *иногда+ можно принять без вреда» [4] К незаменимым элементам пищи человека относят следующие четыре категории:
Незаменимые жирные кислоты
α-линоленовая кислота (омега-3 жирная кислота с кратчайшей цепочкой),
линолевая кислота (омега-6 жирная кислота с кратчайшей цепочкой).
Незаменимые аминокислоты для взрослых людей
изолейцин,
лизин,
лейцин,
метионин,
фенилаланин,
треонин,
триптофан,
валин.
Витамины
биотин (витамин B7, витамин H),
холин (витамин Bp),
фолат (фолиевая кислота, витамин B9, витамин M),
ниацин (витамин B3, витамин P, витамин PP),
пантотеновая кислота (витамин B5),
рибофлавин (витамин B2, витамин G),
тиамин (витамин B1),
витамин A (ретинол),
витамин B6 (пиридоксин, пиридоксамин или пиридоксаль),
витамин B12 (кобаламин),
витамин C (аскорбиновая кислота),
витамин D (эргокальциферол или холекальциферол),
витамин E (токоферол),
витамин K (нафтохиноны).
30.Основные пищевые вещества: углеводы, жиры, белки, суточная потребность, переваривание; частичная взаимозаменяемость при питании.
Животные, в основном, получают аминокислоты из белков содержащихся в пище. Белки разрушаются в процессе пищеварения, который обычно начинается с денатурации белка путём помещения его в кислотную среду и гидролиза с помощью ферментов, называемых протеазами. Некоторые аминокислоты, полученные в результате пищеварения, используются для синтеза белков организма, а остальные превращаются в глюкозу в процессе глюконеогенеза или используются в цикле Кребса. Использование белка в качестве источника энергии особенно важно в условиях голодания, когда собственные белки организма, в особенности мускулов, служат источником энергии. Аминокислоты также являются важным источником азота в питании организма. В среднем человеку необходимо порядка 1-2 г белка на 1кг собственного веса в сутки для нормального функционирования организма. В зависимости от интенсивности жизнедеятельности потребность может колебаться как в одну, так и в другую стороны.
глеводы (сахариды) — общее название обширного класса природных органических соединений. Название происходит от слов «уголь» и «вода». Причиной этого является то, что первые из известных науке углеводов описывались брутто-формулой Cx(H2O)y, формально являясь соединениями углерода и воды. Углеводы выполняют структурную функцию, то есть участвуют в построении различных клеточных структур,
выполняют пластическую функцию — хранятся в виде запаса питательных веществ, а также входят в состав сложных молекул. Углеводы являются основным энергетическим материалом. При окислении 1 грамма углеводов выделяются 4,1 ккал энергии и 0,4 г воды. Углеводы участвуют в обеспечении осмотического давления и осморегуляции. Так,
вкрови содержится 100—110 мг/% глюкозы. От концентрации глюкозы зависитосмотическое давление крови. Углеводы выполняют рецепторную функцию — многие олигосахариды входят в состав воспринимающей части клеточных рецепторов или молекул-лигандов. Суточная потребность в углеводах составляет 400-450 г. Многие жиры в первую очередь триглицериды, используются организмом как источник энергии. При полном
окислении 1 г жира выделяется около 9 ккал энергии, примерно вдвое больше, чем при окислении 1 г белков или углеводов. Поэтому жировые отложения используются в качестве запасных источников питательных веществ прежде всего животными, которые вынуждены носить свои запасы на себе. Растения чаще запасают углеводы. однако в семенах многих растений высоко содержание жиров (растительные масла добывают из семян подсолнечника. кукурузы, рапса, льна и других масличных растений). Суточная потребность взрослого человека в липидах — 70-140 грамм. Оптимальным в рационе практически здорового человека является соотношение белков, жиров и углеводов, близкое к 1:1,2:4. Это соотношение наиболее благоприятно для максимального удовлетворения как пластических, так и энергетических потребностей организма человека. Белки в большинстве случаев должны составлять 12 %, жиры — 30-35 % общей калорийности рациона. Лишь в случае значительного повышения доли физического труда и увеличения
всвязи с этим потребности в энергии содержание белков в рационе может быть снижено до 11 % его общей калорийности (за счет увеличения доли жиров и углеводов как поставщиков калорий).
31 .Незаменимые компоненты основных пищевых веществ. Незаменимые аминокислоты; пищевая ценность различных пищевых белков. Линолевая кислота - незаменимая жирная кислота.
Среди пищевых веществ есть такие, которые не образуются в организме человека. Эти пищевые вещества называются незаменимыми, или эссенциальными. Они обязательно должны поступать с пищей. Отсутствие в рационе любого из них приводит к заболеванию, а при длительном недостатке – и к смерти. В настоящее время науке о питании известно около 50 незаменимых пищевых веществ, которые не могут образоваться в организме и единственным источником их является пища. К незаменимым элементам пищи человека относят следующие четыре категории: незаменимые жирные кислоты, незаменимые аминокислоты, витамины и минеральные соли.
В ходе эволюции человек утратил способность синтезировать почти половину из двадцати аминокислот, входящих в состав белков. К их числу относят те аминокислоты, синтез которых включает много стадий и требует большого количества ферментов, кодируемых многими генами. Следовательно, те аминокислоты, синтез которых сложен и неэкономичен для организма, очевидно, выгоднее получать с пищей. Такие аминокислоты называют незаменимыми.
Кним относят:
Валин (содержится в зерновых, мясе, грибах, молочных продуктах, арахисе, сое)
Изолейцин (содержится в миндале, кешью, курином мясе, турецком горохе (нут), яйцах, рыбе, чечевице, печени, мясе, ржи, большинстве семян, сое.)
Лейцин (содержится в мясе, рыбе, буром рисе, чечевице, орехах, большинстве семян.)
Лизин (содержится в рыбе, мясе, молочных продуктах, пшенице, орехах.)
Метионин (содержится в молоке, мясе, рыбе, яйцах, бобах, фасоли, чечевице и сое.)
Треонин (содержится в молочных продуктах и яйцах, в умеренных количествах в орехах и бобах.)
Триптофан (содержится в овсе, бананах, сушёных финиках, арахисе, кунжуте, кедровых орехах, молоке, йогурте, твороге, рыбе, курице, индейке, мясе.)
Фенилаланин (содержится в говядине, курином мясе, рыбе, соевых бобах, яйцах, твороге, молоке. Также является составной частью синтетического сахарозаменителя —аспартама, активно используемого в пищевой промышленности.)
Аргинин (содержится в семенах тыквы, свинине, говядине, арахисе, кунжуте, йогурте, швейцарском сыре.) Две аминокислоты - аргинин и гистидин - у взрослых образуются в достаточных количествах, однако детям для
нормального роста организма необходимо дополнительное поступление этих аминокислот с пищей. Поэтому их называют частично заменимыми. Две другие аминокислоты - тирозин и цистеин - условно заменимые, так как для их синтеза необходимы незаменимые аминокислоты. Тирозин синтезируется из фенилаланина, а для образования цистеина необходим атом серы метионина.
Остальные аминокислоты легко синтезируются в клетках и называются заменимыми. К ним относят глицин, аспарагиновую кислоту, аспарагин, глутаминовую кислоту, глутамин, серии, пролин, аланин.
Как было показано выше, основным источником аминокислот для клеток организма являются белки пищи. В различных пищевых продуктах содержание белка колеблется в широких пределах. Распространённые продукты растительного происхождения содержат мало белка (кроме гороха и сои). Наиболее богаты белками продукты животного происхождения (мясо, рыба, сыр). Белки не являются незаменимыми пищевыми факторами, они являются источниками содержащихся в них незаменимых аминокислот, необходимых для нормального питания.
Питательная ценность белка зависит от его аминокислотного состава и способности усваиваться организмом. Белки значительно различаются по аминокислотному составу. Некоторые их них содержат полный набор незаменимых
аминокислот в оптимальных соотношениях, другие не содержат одной или нескольких незаменимых аминокислот. Растительные белки, особенно пшеницы и других злаковых, полностью не перевариваются, так как защищены оболочкой, состоящей из целлюлозы и других полисахаридов, которые не гидролизуются пищеварительными ферментами. Некоторые белки по аминокислотному составу близки к белкам тела человека, но не используются в качестве пищевых, так как имеют фибриллярное строение, малорастворимы и не расщепляются протеазами ЖКТ. К ним относят белки волос, шерсти, перьев и другие. Если белок содержит все незаменимые аминокислоты в необходимых пропорциях и легко подвергается действию протеаз, то биологическая ценность такого белка условно принимается за 100, и он считается полноценным. К таким относят белки яиц и молока. Белки мяса говядины имеют биологическую ценность 98. Растительные белки по биологической ценности уступают животным, так как труднее перевариваются и бедны лизином, метионином и триптофаном. Однако при определённой комбинации растительных белков организм можно обеспечить полной и сбалансированной смесью аминокислот. Так, белки кукурузы (биологическая ценность - 36) содержат мало лизина, но достаточное количество триптофана. А белки бобов богаты лизином, но содержат мало триптофана. Каждый из этих белков в отдельности является неполноценным. Однако смесь бобов и кукурузы содержит необходимое человеку количество незаменимых аминокислот.
Линолевая кислота ω-6 жирная кислота), а также арахидоновая кислота и линоленовая кислота относятся к так называемым незаменимым жирным кислотам, необходимым для нормальной жизнедеятельности; в организм человека и животных эти кислоты поступают с пищей, главным образом в виде сложных липидов — триглицеридов и фосфатидов . В виде триглицерида линолевая кислота в значительных количествах (до 40—60 %) входит в состав многих растительных масел и животных жиров, например соевого, хлопкового,подсолнечного, льняного, конопляного масел, китового жира. Линолевая кислота
является незаменимым питательным веществом, без которого организм не может вырабатывать простагландин Е1(простагландин Е1 -одно из важнейших средств защиты организма от преждевременного старения, заболеваний сердца, различных форм аллергии, рака и многих-многих других).
32.История открытия и изучения витаминов. Классификация витаминов. Функции витаминов.
Важность некоторых видов еды для предотвращения определённых болезней была известна ещё в древности. Так, древние египтяне знали, что печень помогает от куриной слепоты. Ныне известно, что куриная слепота может вызываться недостатком витамина A.
В 1330 году в Пекине монгол Ху Сыхуэй опубликовал трёхтомный труд «Важные принципы пищи и напитков», систематизировавший знания о терапевтической роли питания и утверждавший необходимость для здоровья комбинировать разнообразные продукты.
В1747 году шотландский врач Джеймс Линд (James Lind) открыл свойство цитрусовых предотвращать цингу.
В1753 году он опубликовал трактат «Лечение цинги». Однако эти взгляды получили признание не сразу. Тем не менее Джеймс Кук на практике доказал роль растительной пищи в предотвращении цинги, введя в корабельный рацион кислую капусту. В результате он не потерял от цинги ни одного матроса — неслыханное достижение для того времени.
В1795 лимоны и другие цитрусовые стали стандартной добавкой к рациону британских моряков. Это послужило появлением крайне обидной клички для матросов — лимонник. Известны т. н. лимонные бунты: матросы выбрасывали за борт бочки с лимонным соком.
В1880 году русский биолог Николай Лунин из Тартуского университета скармливал подопытным мышам по отдельности все известные элементы, из которых состоит коровье молоко: сахар, белки, жиры, углеводы, соли. Мыши погибли. В то же время мыши, которых кормили молоком, нормально развивались. В своей диссертационной (дипломной) работе Лунин сделал вывод о существовании какого-то неизвестного вещества, необходимого для жизни в небольших количествах. Вывод Лунина был принят в штыки научным сообществом. Другие учёные не смогли воспроизвести его результаты. Одна из причин была в том, что Лунин использовал тростниковый сахар, в то время как другие исследователи использовали молочный сахар, плохо очищенный и содержащий некоторое количество витамина B.
Впоследующие годы накапливались данные, свидетельствующие о существовании витаминов. Так,
в 1889 году голландский врач Христиан Эйкман обнаружил, что куры при питании варёным белым рисом заболевают бери-бери, а при добавлении в пищу рисовых отрубей — излечиваются.
Роль неочищенного риса в предотвращении бери-бери у людей открыта в 1905 году Уильямом Флетчером.
В 1906 году Фредерик Хопкинс предположил, что помимо белков, жиров, углеводов и т. д. пища содержит ещё какието вещества, необходимые для человеческого организма, которые он назвал «accessory factors». Последний шаг был сделан в 1911 году польским учёным Казимиром Функом(Casimir Funk), работавшим в Лондоне. Он выделил кристаллический препарат, небольшое количество которого излечивало бери-бери. Препарат был назван «Витамайн» (Vitamine), от латинского vita — жизнь и английского amine — амин, азотсодержащее соединение. Функ высказал предположение, что и другие болезни — цинга, пеллагра,рахит — тоже могут вызываться недостатком каких-то веществ.
В1920 году Джек Сесиль Драммонд предложил убрать «e» из слова «vitamine», потому что недавно открытый витамин C не содержал аминового компонента. Так витамайны стали витаминами.
В1929 году Хопкинс и Эйкман за открытие витаминов получили Нобелевскую премию, а Лунин и Функ — не получили. Лунин стал педиатром, и его роль в открытии витаминов была надолго забыта. В 1934 году в Ленинграде состоялась Первая всесоюзная конференция по витаминам, на которую Лунин (ленинградец) не был приглашён.
В1910-е, 1920-е и 1930 годы были открыты и другие витамины. В 1940 годы была расшифрована химическая структура витаминов.
По химическому строению и физико-химическим свойствам (в частности, по растворимости) витамины делят на 2 группы.
Водорастворимые
Витамин В1 (тиамин);
Витамин В2 (рибофлавин);
Витамин РР (никотиновая кислота, никотинамид, витамин В3);
Пантотеновая кислота (витамин В5);
Витамин В6 (пиридоксин);
Биотин (витамин Н);
Фолиевая кислота (витамин Вс, В9);
Витамин В12 (кобаламин);
Витамин С (аскорбиновая кислота);
Витамин Р (биофлавоноиды).
Жирорастворимые
Витамин А (ретинол);
Витамин D (холекальциферол);
Витамин Е (токоферол);
Витамин К (филлохинон).
Водорастворимые витамины при их избыточном поступлении в организм, будучи хорошо растворимыми в воде, быстро выводятся из организма.
Жирорастворимые витамины хорошо растворимы в жирах и легко накапливаются в организме при их избыточном поступлении с пищей. Их накопление в организме может вызвать расстройство обиена веществ, называемое гипервитаминозом, и даже гибель организма.
Витамины участвуют во множестве биохимических реакций, выполняя каталитическую функцию в составе активных центров большого количества разнообразных ферментов либо выступая информационными регуляторными посредниками, выполняя сигнальные функции экзогенных прогормонов
и гормонов. Они не являются для организма поставщиком энергии и не имеют существенного пластического значения. Однако витаминам отводится важнейшая роль в обмене веществ. Концентрация витаминов в тканях и суточная потребность в них невелики, но при недостаточном поступлении витаминов в организм наступают характерные и опасные патологические изменения. Большинство витаминов не синтезируются в организме человека. Поэтому они должны регулярно и в достаточном количестве поступать в организм с пищей или в виде витаминно-минеральных комплексов и пищевых добавок. С нарушением поступления витаминов в организм связаны 3 принципиальных патологических состояния: недостаток витамина —гиповитаминоз, отсутствие витамина — авитаминоз, и избыток витамина — гипервитаминоз.
ЗЗ. Алиментарные и вторичные авитаминозы и гиповитаминозы. Гипервитаминозы. Примеры.
С нарушением поступления витаминов в организм связаны 3 принципиальных патологических состояния: недостаток витамина —гиповитаминоз, отсутствие витамина — авитаминоз, и избыток витамина — гипервитаминоз. Алиментарный авитаминоз - заболевание, являющееся следствием длительного неполноценного питания, в котором отсутствуют какие-либо витамины.
Вторичный авитаминоз (эндогенный) – заболевание, связанное с нарушением процессов пищеварения или нарушением работы органов, связанных непосредственно с пищеварением, поступлением в организм антивитаминов, например лекарственных препаратов синкумар, дикумарол, применяющихся при лечении повышенной свертываемости крови, особенностями обмена веществ в пожилом и детском возрасте.
Гиповитаминоз - болезненное состояние, возникающее при нарушении соответствия между расходованием витаминов и поступлением их в организм; то же, что витаминная недостаточность. Гиповитаминоз развивается при недостаточном поступлении витаминов. Гиповитаминоз развивается незаметно: появляется раздражительность, повышенная утомляемость, снижается внимание, ухудшается аппетит, нарушается сон. Систематический длительный недостаток витаминов в пище снижает работоспособность, сказывается на состоянии отдельных органов и тканей
(кожа, слизистые, мышцы, костная ткань) и важнейших функциях организма, таких как рост, интеллектуальные и физические возможности, продолжение рода, защитные силы организма.
Гипервитаминоз — острое расстройство в результате интоксикации сверхвысокой дозой одного или нескольких витаминов (содержащихся в пище или витаминсодержащих лекарствах). Чаще всего, гипервитаминозы вызываются приёмом резко повышенных доз жирорастворимых витаминов.
Примеры авитаминозов:
Авитаминоз С Цинга) - недостаток витамина C приводит к нарушению синтеза коллагена, соединительная ткань теряет свою прочность. Симптомы — вялость, быстрая утомляемость, ослабление мышечного тонуса, ревматоидные боли в крестце и конечностях (особенно нижних), расшатывание и выпадение зубов; хрупкость кровеносных сосудов приводит к кровоточивости дёсен, кровоизлияниям в виде тёмно-красных пятен на коже. При полном прекращении поступления аскорбиновой кислоты в организм цинга развивается примерно через 4–12 недель; при гиповитаминозе С клинические проявления менее выражены и появляются в более поздние сроки, обычно через 4–6 месяцев.
Авитаминоз В1 Бери-бери) - Витамин В1, называемый также тиамином, способствует нормальному протеканию процессов углеводного и жирового обмена. Его дефицит приводит к накоплению в крови человека пировиноградной кислоты и её повышенной концентрации в нервной системе. Последствием такого биохимического нарушения обмена веществ является энцефалопатия Вернике (острое поражение среднего мозга) или полиневрит (поражения нервной системы). Поражения локализуются в периферических нервах и характеризуются развитием в них дегенеративных явлений типа паренхиматозного неврита.
Авитаминоз D (Рахит) - специфическая функция витамина D заключается в регуляции процессов всасывания кальция, фосфора в кишечнике и отложения их в костную ткань, а также реабсорбции кальция и фосфатов в почечных канальцах. При дефиците витамина D происходит нарушение фосфорно-кальцивого обмена, в результате чего происходит нарушение образования костей и недостаточность их минерализации. Нарушения фосфорно-кальциевого обмена приводят к снижению окислительных процессов, развитию ацидоза в кости,
углубляющего изменения клеточного метаболизма и нарушающего нормальный процесс обызвествления хрящевой и остеоидной ткани.
Примеры гипервитаминозов:
Гипервитаминоз А - протекает в виде двух форм: Острый - при однократном приеме в пищу большого количества продуктов, содержащих витамин А (печень белого медведя, кита, моржа). Протекает по типу интоксикации (острого отравления). Хронический - развивается, преимущественно у детей, при длительном приеме внутрь витамина А в максимально допустимых суточных дозах. Проявляется в виде каротинемии. В отличие от желтухи при каротинемии отмечается желтушность кожных покровов и ладонных поверхностей кисти. В крови повышается уровень холестерина и ретинола. Наблюдаются органические изменения в печени.
Гипервитаминоз D - при гипервитаминозе D активная форма витамина стимулирует остеокласты, усиливает всасывания кальция в кишечнике, стимулирует реабсорбцию, что вызывает гиперкальциемию, а также остеопороз. Избыток 1,25-дигидроксихолекальциферола приводит к повреждению мембран клеток и органелл. При разрушении лизосом высвобождаются и поступают в цитоплазму их ферменты. В первую очередь изменения возникают в почках и печени. Гиперкальциемия ведёт к кальцинозу крупных сосудов и клапанов сердца.
34.Минеральные вещества пищи. Региональные патологии, связанные с недостаточностью микроэлементов в пище и воде.
Минеральные вещества в зависимости от их содержания в организме и пищевых продуктах подразделяют на макро- и микроэлементы. К макроэлементам, которые содержатся в больших количествах (десятки и сотни миллиграммов на 100 г живой ткани или продукта), относятся кальций, фосфор, магний, калий, натрий, хлор и сера. Микроэлементы содержатся в организме и продуктах в очень малых количествах, выражаемых единицами, десятками, сотыми, тысячными долями миллиграммов. В настоящее время 14 микроэлементов признаны необходимыми для жизнедеятельности: железо, медь, марганец, цинк, кобальт, йод, фтор, хром, молибден, ванадий, никель, стронций, кремний, селен.
КАЛЬЦИЙ - (Ca) Кальций необходим для нормального роста и развития организма, работы сердца, свертываемости крови, а также для формирования мышц и нервных клеток.Длительный дефицит кальция приводит к серьезным изменениям в организме и вызывает такие заболевания, как кариес, рахит, декальцинацию костной ткани. При его недостатке часто возникают боли в суставах, которые иногда ошибочно принимают за проявления ревматизма
ЖЕЛЕЗО - (Fe)Недостаток железа в питании может вызвать анемию (малокровие). В сочетании с белком железо образует красящее вещество крови — гемоглобин, а так как процесс распада и образования кровяных телец непрерывен, то железо должно поступать в организм постоянно, в течение всей жизни.
НАТРИЙ - (Na)Дефицит ее в течение длительного времени ведет к слабости, потере аппетита, тошноте, усталости, мышечным судорогам.
КАЛИЙ - (К)Как и натрий, калий регулирует кровяное давление и содержание воды в тканях, способствует выведению воды через почки. Недостаток его проявляется в ослаблении мышечного тонуса и снижении кровяного давления.
35.Понятие о метаболизме и метаболических путях. Ферменты и метаболизм. Понятие о регуляции метаболизма. Основные конечные продукты метаболизма у человека
Метаболизм — полный процесс превращения химических веществ в организме, обеспечивающих его рост, развитие, еятельность и жизнь в целом. В живом организме постоянно расходуется энергия, причём не только во время физической и умственной работы, но и при полном покое (сне). Обмен веществ представляет собой комплекс биохимических и энергетических процессов, обеспечивающих использование пищевых веществ для нужд организма и удовлетворения его потребностей в пластических и энергетических веществах.
Метаболический путь – это последовательный ряд превращений химического вещества из исходного состояния в необходимое, проходящий через ряд промежуточных форм, где в каждом последующем акте превращения принимает участие необходимый фермент.
Все химические реакции в клетке протекают при участии ферментов. Поэтому, чтобы воздействовать на скорость протекания метаболического пути, достаточно регулировать количество или активность ферментов. Обычно в метаболических путях есть ключевые ферменты, благодаря которым происходит регуляция скорости всего пути. Эти ферменты (один или несколько в метаболическом пути) называются регуляторными ферментами; они катализируют, как правило, начальные реакции метаболического пути, необратимые реакции, скорость-ли-митирующие реакции (самые медленные) или реакции в месте переключения метаболического пути (точки ветвления).Регуляция скорости ферментативных реакций осуществляется на 3 независимых уровнях:
изменением количества молекул фермента;
доступностью молекул субстрата и кофер-мента;
изменением каталитической активности молекулы фермента.
1. Регуляция количества молекул фермента в клетке Известно, что белки в клетке постоянно обновляются.
Количество молекул фермента в клетке определяется соотношением 2 процессов - синтеза и распада белковой молекулы фермента. Синтез и фолдинг белка - многостадийный процесс. Регуляция синтеза белка может происходить на любой стадии формирования белковой молекулы. Наиболее изучен механизм регуляции синтеза белковой молекулы на уровне транскрипции, который осуществляется определёнными метаболитами, гормонами и рядом биологически активных молекул. Что касается распада ферментов, то регуляция этого процесса менее изучена. Можно только предполагать, что это не просто процесс протеолиза (разрушения белковой молекулы), а сложный механизм, возможно, определяемый на генетическом уровне.
2. Регуляция скорости ферментативной реакции доступностью молекул субстрата и коферментов Важный параметр, контролирующий протекание метаболического пути, - наличие субстратов, и главным образом - наличие первого субстрата. Чем больше концентрация исходного субстрата, тем выше скорость метаболического пути. Другой параметр, лимитирующий протекание метаболического пути, - наличие регенерированных коферментов. Например, в реакциях дегидрирования коферментом дегидрогеназ служат окисленные формы NAD+, FAD, FMN, которые восстанавливаются в ходе реакции. Чтобы коферменты вновь участвовали в реакции, необходима их регенерация, т.е. превращение в окисленную форму.
3. Регуляция каталитической активности ферментов Важнейшее значение в изменении скорости метаболических путей играет регуляция каталитической активности одного или нескольких ключевых ферментов данного метаболического пути. Это высокоэффективный и быстрый способ регуляции метаболизма.
Основные способы регуляции активности ферментов:
аллостерическая регуляция;
регуляция с помощью белок-белковых взаимодействий;
регуляция путём фосфорилирования/дефосфорилирования молекулы фермента;
регуляция частичным (ограниченным) протеолизом.
36.Исследования на целых организмах, органах, срезах тканей, гомогенатах, субклеточных структурах и на молекулярном уровне
В основе биохимической методологии лежит фракционирование, анализ, изучение структуры и свойств отдельных компонентов живого вещества. Методы биохимии преимущественно формировались в XX веке; наиболее
