
БХ
.pdf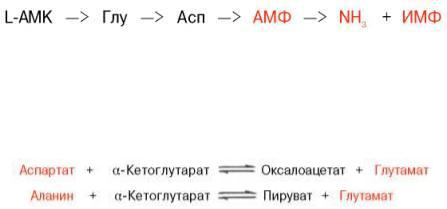
процессах трансаминирования послужили предметом детального исследования роли этих ферментов в обмене аминокислот. Ранее было указано, что при физиологических значениях рН средыактивность оксидазы L-
аминокислот резко снижена. Учитывая это обстоятельство, а также высокую скорость протекания реакциитрансаминирования, А.Е. Браунштейн выдвинул гипотезу о возможности существования в животных тканях непрямого путидезаминирования аминокислот через реакции трансаминирования, названного им трансдезаминированием. Основой для выдвижения этой гипотезы послужили также данные Г. Эйлера о том, что в
животных тканях из всех природных аминокислот с высокой скоростью дезаминируется только L- глутаминовая кислота в реакции, катализируемой высокоактивной и специфической глутамат-дегидрогеназой. Согласно гипотезе, получившей экспериментальное подтверждение, все или почти все природные аминокислоты (исключение составляет метионин) сначала реагируют с α- кетоглутаровой кислотой в реакции трансами-нирования с образованием глутаминовой кислоты и
соответствующей кетокислоты. Образовавшаяся глутаминовая кислота затем подвергается непосредственному окислительному дезаминированию под действием глу-таматдегидрогеназы. Суммарная реакция при этом следующая:
R,—CH(NH2)—COOH + НАД++H20-> R,—CO—СООН + НАДН2 + NH3.
Поскольку обе реакции (трансаминирование и дезаминирование глу-таминовой кислоты) являются обратимыми, создаются условия для синтеза по существу любой аминокислоты, если в организме имеются соответствующие α- кетокислоты. Известно, что организмживотных и человека не наделен способностью синтеза углеродных скелетов (α- кетокислот), так называемых незаменимыхаминокислот; этой способностью обладают только растения и многие микроорганизмы. Механизм, при помощи которого в живых организмах осуществляется синтез природных аминокислот из α-кетокислот и аммиака, был назван А.Е. Браунштейном трансреаминированием.
Сущность его сводится к восстановительному аминированию α-кетоглутаровойкислоты с образованием глутаминовой кислоты (реакцию катализирует НАДФ-зависимая глута-матдегидрогеназа, работающая в режиме синтеза) и к последующему трансаминированию глутамата с любой α-кетокислотой. В результате образуется L-аминокислота, соответствующая исходной кетокислоте, и вновь освобождается α-кетоглутаровая кислота, которая может акцептировать новуюмолекулу аммиака. Таким образом, трансаминазы катализируют опосредованное через глутаматдегидрогеназу дезаминирование природных аминокислот и биосинтез аминокислот .
Получены доказательства существования в организме теплокровных животных еще одного механизма непрямого (опосредованного) дезаминирования L-аминокислот, при котором Глу, Асп и АМФ выполняют роль системы переноса NН2-группы; гидролитическоедезаминирование АМФ приводит к образованию инозинмонофосфата (ИМФ) и аммиака:
Возможно, что в аналогичной системе в качестве промежуточного переносчика NH2-группы вместо АМФ участвует НАД.
Клиническое значение определения активности трансаминаз. Широкое распространение и высокая активность трансаминаз в органах и тканях человека, а также сравнительно низкие
величины активности этих ферментов в крови послужили основанием для определения уровня ряда трансаминаз в сыворотке крови человека при органических и функциональных поражениях разных органов. Для клинических целей наибольшее значение имеют две трансаминазы – аспартат-аминотрансфераза A AT) и аланин-аминотрансфераза АлАТ), катализирующие соответственно следующие обратимые реакции:
В сыворотке крови здоровых людей активность этих трансаминаз в тысячи раз ниже, чем в паренхиматозных органах. Поэтому органические поражения при острых и хронических заболеваниях, сопровождающиеся деструкцией клеток, приводят к выходу трансаминаз из очага поражения в кровь. Так, уже через 3–5 ч после развития инфаркта миокарда уровень АсАТ в сыворотке кровирезко повышается (в 20–30 раз). Максимум активности обеих трансаминаз крови приходится на конец первых суток, а уже через 2–3 дня при благоприятном исходе болезни
уровень сывороточных трансаминаз возвращается к норме. Напротив, при затяжном процессе или наступлении повторного инфаркта миокарда наблюдается новый пик повышения активности этих ферментов в крови. Этим объясняется тот факт, что в клинике трансаминазный тест используется не только для постановки диагноза, но и для прогноза и проверки эффективности лечения . При поражениях клеток печени, например при гепатитах, также наблюдается гипертрансаминаземия (за счет преимущественного повышения уровня АлАТ), но она имеет более умеренный и затяжной характер, а повышение активноститрансаминазы в сыворотке крови происходит медленно. При различного рода коронарной недостаточности (стенокардия, пороки сердца и др., кроме инфаркта миокарда) гипертрансаминаземия или не наблюдается, или незначительна. Определение активноститрансаминаз в сыворотке крови при заболеваниях сердца следует отнести к дифференциально-диагностическим лабораторным тестам. Повышение уровня трансаминаз в сыворотке крови отмечено, кроме того, при некоторых заболеваниях мышц, в частности при обширных травмах, гангрене конечностей и прогрессивной мышечной дистрофии.
80. Окислительное дезаминирование аминокислот; глутаматдегидрогеназа. Непрямое дезаминирование аминокислот. Биологическое значение.
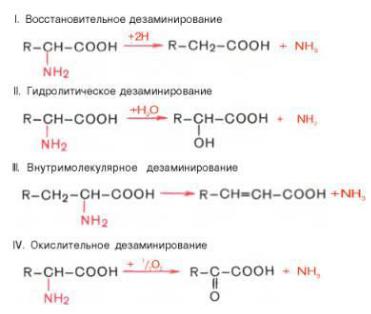
Дезаминирование аминокислот - реакция отщепления α-аминогруппы от аминокислоты, в результате чего образуется соответствующая α-кетокислота (безазотистый остаток) и выделяется молекула аммиака. Аммиак токсичен для ЦНС, поэтому в организме человека и млекопитающих он превращается в нетоксичное хорошо растворимое соединение - мочевину. В виде мочевины, а также в виде солей аммония аммиак выводится из организма. Безазотистый остаток используется для образования аминокислот в реакциях трансаминирования, в процессах глюконеогенеза, кето-генеза, в анаплеротических реакциях для восполнения убыли метаболитов ОПК, в реакциях окисления до СО2 и Н2О.
Существует несколько способов дезаминирования аминокислот:
Окислительное дезаминирование. Наиболее активно в тканях происходит дезаминирование глутаминовой кислоты. Реакцию катализирует фермент глутаматдегидрогеназа коферментом глутаматдегидрогеназы является NAD+. Реакция идёт в 2 этапа. Вначале происходит ферментативное дегидрирование глутамата и образование а-иминоглутарата, затем - неферментативное гидролитическое отщепление иминогруппы в виде аммиака, в результате чего образуется а- кетоглутарат. Окислительное дезаминирование глутамата - обратимая реакция и при повышении концентрации аммиака в клетке может протекать в обратном направлении, как восстановительное шинирование α-кетоглутарата. Глутаматдегидрогеназа очень активна в митохондриях клеток практически всех органов, кроме мышц. Этот фермент - олигомер, состоящий из 6 субъединиц (молекулярная масса 312 кД). Глутаматдегидрогеназа играет важную роль, так как является регуляторным ферментом аминокислотного обмена. Аллостерические ингибиторы глутаматдегидрогеназы (АТФ, ГТФ, NADH) вызывают диссоциацию фермента и потерю глутаматдегидрогеназной активности. Высокие концентрации АДф активируют фермент. Таким образом, низкий энергетический уровень в клетках стимулирует разрушение аминокислот и образованиеα-кетоглутарата, поступающего в ЦТК как энергетический субстрат. Глутаматдегидрогеназа может индуцироваться стероидными гормонами (кортизолом).
Оксидаза L-аминокислот. В печени и почках обнаружен фермент оксидаза L-аминокислот, способный дезаминировать некоторые L-аминокислоты. Коферментом в данной реакции выступает FMN. Однако вклад оксидазы L-аминокислот в дезаминирование, очевидно, незначителен, так как оптимум её действия лежит в щелочной среде (рН 10,0). В клетках, где рН среды близок к нейтральному, активность фермента очень низка.
Оксидаза D-аминокислот также обнаружена в почках и печени. Это FAD-зависимый фермент. Оптимум рН этой оксидазы лежит в нейтральной среде, поэтому фермент более активен, чем оксидаза L-аминокислот. Роль оксидазы D- аминокислот невелика, так как количество D-изомеров в организме крайне мало, потому что в белки пищи и белки тканей человека и животных входят только природные L-аминокислоты. Вероятно, оксидаза D-аминокислот способствует их превращению в соответствующие L-изомеры.
Непрямое дезаминирование трансдезаминирование) Большинство аминокислот не способно дезаминироваться в одну стадию, подобно Глу. Аминогруппы таких аминокислот в результате трансаминирования переносятся на α- кетоглутарат с образованием глутаминовой кислоты, которая затем подвергается прямому окислительному
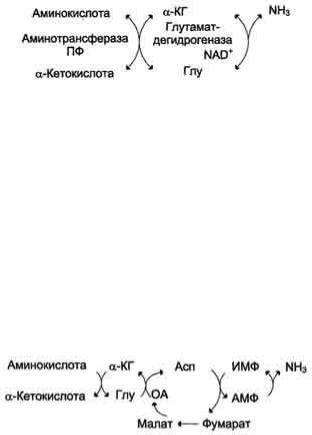
дезаминированию. Такой механизм дезаминирования аминокислот в 2 стадии получил название трансдезаминирования, или непрямого дезаминирования:
Непрямое дезаминирование аминокислот происходит при участии 2 ферментов: аминотрансферазы (кофермент ПФ) и глутаматдегидрогеназы (кофермент NAD+).
Значение этих реакций в обмене аминокислот очень велико, так как непрямое дезаминирование - основной способ дезаминирования большинства аминокислот. Обе стадии непрямого дезаминирования обратимы, что обеспечивает как катаболизм аминокислот, так и возможность образования практически любой аминокислоты из соответствующей α-кетокислоты.
В мышечной ткани активность глутаматдегидрогеназы низка, поэтому в этих клетках при интенсивной физической нагрузке функционирует ещё один путь непрямого дезаминирования с участием цикла ИМФ-АМФ. Вначале происходит перенос аминогруппы аминокислот на аспартат, затем на инозиновую кислоту (ИМФ) и в завершение - дезаминирование АМФ. Представленная схема отражает последовательность реакций непрямого неокислительного дезаминирования:
Можно выделить 4 стадии процесса:
трансаминирование с α-кетоглутаратом, образование глутамата;
трансаминирование глутамата с оксалоацета-том (фермент ACT), образование аспартата;
реакция переноса аминогруппы от аспартата на ИМФ (инозинмонофосфат), образование АМФ и фумарата;
гидролитическое дезаминирование АМФ.
Перенос аминогруппы от аспартата и синтез АМФ происходят следующим образом.
Реакция дезаминирования адениловой кислоты происходит под действием фермента АМФ дезаминазы Этот путь дезаминирования преобладает в мышцах при интенсивной работе, в результате которой накапливается молочная кислота. Выделяющийся аммиак предотвращает закисление среды в клетках, вызванное образованием лактата.
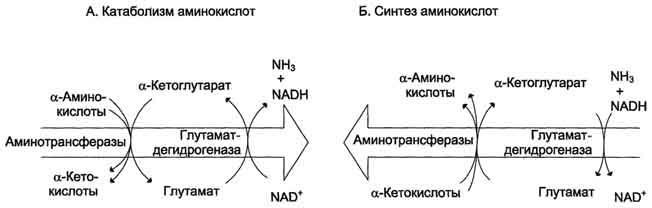
Биологическая роль непрямого дезаминирования. А - при катаболизме почти все природные аминокислоты сначала передают аминогруппу на а-кетоглутарат в реакции трансаминирования с образованием глутамата и соответствующей кетокислоты. Затем глутамат подвергается прямому окислительному дезаминированию под действием глутаматдегидрогена-зы, в результате чего получаются а-кетоглутарат и аммиак; Б - при необходимости синтеза аминокислот и наличии необходимых α-кетокислот обе стадии непрямого дезаминирования протекают в обратном направлении. В результате восстановительного аминирования а-кетоглутарата образуется глутамат, который вступает в трансаминирование с соответствующей α-кетокислотой, что приводит к синтезу новой аминокислоты.
81. Основные источники аммиака в организме. Роль глутамата в обезвреживании и транспорте аммиака. Глутамин как донор амидной группы при синтезе ряда соединений.
Основные источники аммиака
Источник |
Процесс |
Ферменты |
Локализация |
|
процесса |
||||
|
|
|
||
|
|
|
|
|
Аминокислоты |
Непрямое дезаминирование (основной |
Аминотрансферазы, ПФ |
Все ткани |
|
|
путь дезаминирования аминокислот) |
Глутаматдегидрогеназа, NAD+ |
|
|
|
|
|
|
|
|
Окислительное дезаминирование |
Глутаматдегидрогеназа, NAD+ |
Все ткани |
|
|
глутамата |
|
|
|
|
|
|
|
|
|
Неокислительное дезаминирование Гис, |
Гистидаза-Серин, |
Преимущественно |
|
|
Сер, Тре |
треониндегидратазы, ПФ |
печень |
|
|
|
|
|
|
|
Окислительное дезаминирование |
Оксидаза L-аминокислот, FMN |
Печень и почки |
|
|
аминокислот (малозначимый путь |
|
|
|
|
дезаминирования) |
|
|
|
|
|
|
|
|
Биогенные |
Окислительное дезаминирование (путь |
Аминооксидазы, FAD |
Все ткани |
|
амины |
инактивации биогенных аминов) |
|
|
|
|
|
|
|
|
АМФ |
Гидролитическое дезаминирование |
АМФ-дезаминаза |
Интенсивно |
|
|
|
|
работающая мышца |
|
|
|
|
|
Катаболизм аминокислот в тканях происходит постоянно со скоростью 100 г/сут. При этом в результате дезаминирования аминокислот освобождается большое количество аммиака. Значительно меньшие количества его образуются при дезаминировании биогенных аминов и нуклеотидов. Часть аммиака образуется в кишечнике в результате действия бактерий на пищевые белки (гниение белков в кишечнике) и поступает в кровь воротной вены. Концентрация аммиака в крови воротной вены существенно больше, чем в общем кровотоке. В печени задерживается большое количество аммиака, что поддерживает низкое содержание его в крови. Концентрация аммиака в крови в норме редко превышает 0,4-0,7 мг/л (или 25-40 мкмоль/л). В крови и цитозоле клеток при физиологических значениях рН аммиак переходит в ион аммония - NH4+, количество неионизированного NH3 невелико (~ 1%)Высокая интенсивность процессов дезаминирования аминокислот в тканях и очень низкий уровень аммиака в крови свидетельствуют о том, что в клетках активно происходит связывание аммиака с образованием нетоксичных соединений, которые выводятся из организма с мочой. Эти реакции можно считать реакциями обезвреживания аммиака. В разных тканях и органах обнаружено несколько типов таких реакций.Основной реакцией связывания аммиака, протекающей во всех тканях организма, является синтез глутамина под действием глутамин-синтетазы:
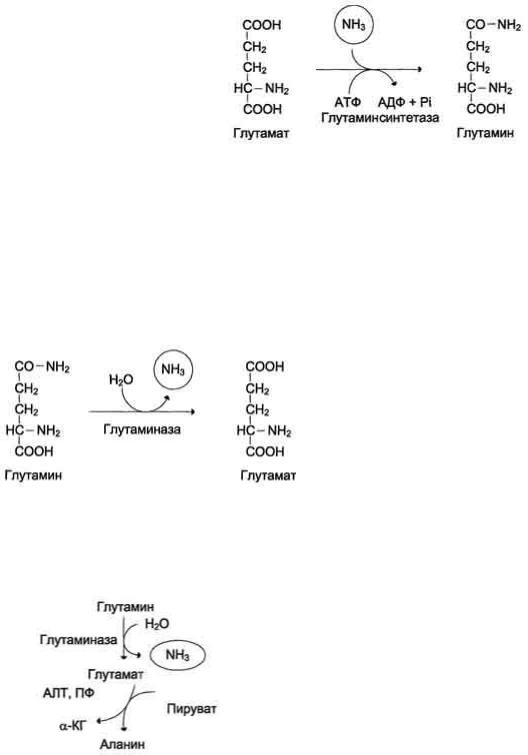
Глутаминсинтетаза локализована в митохондриях клеток, для работы фермента необходим кофактор - ионы Mg2+. Глутаминсинтетаза - один из основных регуляторных ферментов обмена аминокислот и аллостерически ингибируется АМФ, глюкозо-6-фосфатом, а также Гли, Ала и Гис. Глутамин легко транспортируется через клеточные мембраны путём облегчённой диффузии (для глутамата возможен только активный транспорт) и поступает из тканей в кровь. Основными тканями-поставщиками глутамина служат мышцы, мозг и печень. С током крови глутамин транспортируется в кишечник и почки.
В клетках кишечника под действием фермента глутаминазы происходит гидролитическое освобождение амидного азота в виде аммиака:
Образовавшийся в реакции глутамат подвергается трансаминированию с пируватом. ос-Аминогруппа глутаминовой кислоты переносится в состав аланина. Большие количества аланина поступают из кишечника в кровь воротной вены и поглощаются печенью. Около 5% образовавшегося аммиака удаляется в составе фекалий, небольшая часть через воротную вену попадает в печень, остальные ~90% выводятся почками.
В почках также происходит гидролиз глутамина под действием глутаминазы с образованием аммиака. Этот процесс является одним из механизмов регуляции кислотно щелочного равновесия в организме и сохранения важнейших катионов для поддержания осмотического давления. Глутаминаза почек значительно индуцируется при ацидозе, образующийся аммиак нейтрализует кислые продукты обмена и в виде аммонийных солей экскретируется с мочой. Эта реакция защищает организм от излишней потери ионов Na+ и К+, которые также могут использоваться для выведения анионов и утрачиваться. При алкалозе количество глутаминазы в почках снижается. В почках образуется и выводится около 0,5 г солей аммония в сутки. Высокий уровень глутамина в крови и лёгкость его поступления в клетки обусловливают использование глутамина во многих анаболических процессах.
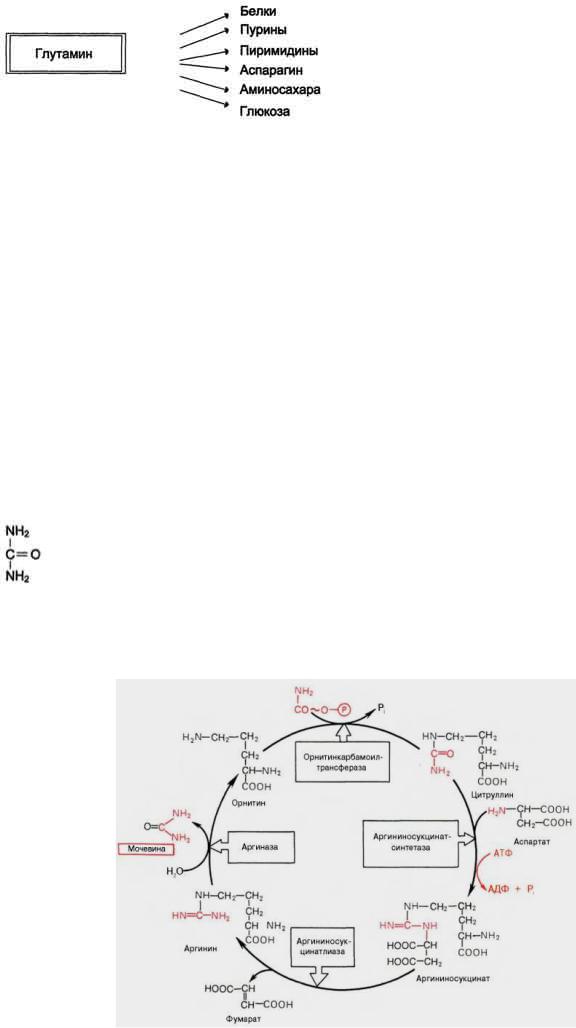
Глутамин - основной донор азота в организме. Амидный азот глутамина используется для синтеза пуриновых и пиримидиновых нуклеотидов, аспарагина, аминосахаров и других соединений
82. Глутаминаза почек; образование и выведение солей аммония. Активация глутаминазы почек при ацидозе.
В почках также происходит гидролиз глутамина под действием глутаминазы с образованием аммиака. Этот процесс является одним из механизмов регуляции кислотно щелочного равновесия в организме и сохранения важнейших катионов для поддержания осмотического давления. Глутаминаза почек значительно индуцируется при ацидозе, образующийся аммиак нейтрализует кислые продукты обмена и в виде аммонийных солей экскретируется с мочой. Эта реакция защищает организм от излишней потери ионов Na+ и К+, которые также могут использоваться для выведения анионов и утрачиваться. При алкалозе количество глутаминазы в почках снижается. В почках образуется и выводится около 0,5 г солей аммония в сутки. Высокий уровень глутамина в крови и лёгкость его поступления в клетки обусловливают использование глутамина во многих анаболических процессах.
83. Биосинтез мочевины. Связь орнитинового цикла с ЦТК. Происхождение атомов азота мочевины. Нарушения синтеза и выведения мочевины. Гипераммонемии.
Мочевина - основной конечный продукт азотистого обмена, в составе которого из организма выделяется до 90%
всего выводимого азота. Экскреция мочевины в норме составляет 25 г/сут. При повышении количества потребляемых с пищей белков экскреция мочевины увеличивается. Мочевина синтезируется только в печени. Поражение печени и нарушение синтеза мочевины приводят к повышению содержания в крови и тканях аммиака и аминокислот (в первую очередь, глутамина и аланина).
Мочевина (карбамид) - полный амид угольной кислоты - содержит 2 атома азота. Источником одного из них является аммиак который в печени связывается с диоксидом углерода с образованием карбамоилфосфата под действием карбамоилфосфатсинтетазы I.
Далее под действием орнитинкарбамоилтрансферазы карбамоильная группа карбамоилфосфата переносится на α-аминокислоту орнитин, и образуется другая α-аминокислота – цитруллин. Следующей реакции
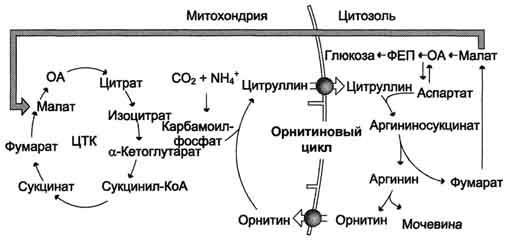
аргининосукцинатсинтетаза связывает цитруллин с аспартатом и образует аргининосукцинат (аргининоянтарную кислоту). Этот фермент нуждается в ионах Mg2+. В реакции затрачивается 1 моль АТФ, но используется энергия двух макроэргических связей. Аспартат - источник второго атома азота мочевины Далее фермент аргининосукцинатлиаза (аргининосукциназа) расщепляет аргининосукцинат на аргинин и фумарат, при этом аминогруппа аспартата оказывается в молекуле аргинина. Аргинин подвергается гидролизу под действием аргиназы, при этом образуются орнитин и мочевина. Кофакторами аргиназы являются ионы Са2+ или Мn2+. Высокие концентрации орнитина и лизина, являющихся структурными аналогами аргинина, подавляют активность этого фермента. Образующийся орнитин взаимодействует с новой молекулой карбамоилфосфата, и цикл замыкается. Первые две реакции процесса происходят в митохондриях гепатоцитов. Затем цитруллин, являющийся продуктом этих реакций, транспортируется в цитозоль, где и осуществляются дальнейшие превращения.
Суммарное уравнение синтеза мочевины:
СО2 + NH3 + Аспартат + 3 АТФ + 2 Н2О → Мочевина + Фумарат + 2 АДФ + Н3Р04) + АМФ + H4P2O7.
Взаимосвязь орнитинового цикла и общего пути катаболизма. Фумарат, образующийся в результате расщепления аргининосукцината, превращается в малат, который затем переносится в митохондрии, включается в ЦТК и дегидрируется с образованием оксалоацетата. Эта реакция сопровождается выделением 3 молекул АТФ, которые и компенсируют затраты энергии на синтез одной молекулы мочевины.
Гипераммониемия Нарушение реакций обезвреживания аммиака может вызвать повышение содержания аммиака в крови - гипераммониемию, что оказывает токсическое действие на организм. Причинами гипераммониемии могут выступать как генетический дефект ферментов орнитинового цикла в печени, так и вторичное поражение печени в результате цирроза, гепатита и других заболеваний. Известны пять наследственных заболеваний, обусловленных дефектом пяти ферментов орнитинового цикла:
Наследственные нарушения орнитинового цикла и основные их проявления
|
Дефект |
|
Клинические |
Метаболиты |
||
Заболевание |
Тип наследования |
|
|
|||
фермента |
проявления |
кровь |
моча |
|||
|
|
|||||
|
|
|
|
|||
|
|
|
|
|
|
|
Гиперам- |
Карбамоил- |
Аутосомно- |
В течение 24-48 ч после рождения кома, |
Глн |
Оротат |
|
мониемия |
фосфат- |
рецессивный |
смерть |
Ала |
|
|
тип I |
синтетаза I |
|
|
NH3 |
|
|
|
|
|
|
|
|
|
Гиперам- |
Орнитин- |
Сцепленный с Х- |
Гипотония, снижение толерантности к |
Глн |
Оротат |
|
мониемия |
карбамоил- |
хромосомой |
белкам |
Ала |
|
|
тип II |
трансфераза |
|
|
NH3 |
|
|
|
|
|
|
|
|
|
Цитрул- |
Аргинино- |
Аутосомно- |
Гипераммониемия тяжёлая у |
Цитруллин |
Цитруллин |
|
линемия |
сукцинат- |
рецессивный |
новорождённых. У взрослых - после |
NH3 |
|
|
|
синтетаза |
|
белковой нагрузки |
|
|
|
|
|
|
|
|
|
|
Аргинино- |
Аргинино- |
Аутосомно- |
Гипераммонимия, атаксия, судороги, |
Аргини- |
Аргини- |
|
сукцина- |
сукцинат- |
рецессивный |
выпадение волос |
носукцинат |
носукци- |
|
|
|
|
|
|
|
|
турия |
лиаза |
|
|
NH3 |
нат, Глн, |
|
|
|
|
|
Ала, Лиз |
|
|
|
|
|
|
Гиперар- |
Аргиназа |
Аутосомно- |
Гипераргининемия |
Apr |
Apr |
гининемия |
|
рецессивный |
|
NH3 |
Лиз |
|
|
|
|
|
Орнитин |
|
|
|
|
|
|
Нарушение орнитинового цикла наблюдается при гепатитах различной этиологии и некоторых других вирусных заболеваниях. Например, установлено, что вирусы гриппа и других острых респираторных вирусных инфекций снижают активность карбамоилфосфатсинтетазы I. При циррозе и других заболеваниях печени также часто наблюдают гипераммониемию. Снижение активности какого-либо фермента синтеза мочевины приводит к накоплению в крови субстрата данного фермента и его предшественников. Так, при дефекте аргининосук-цинатсинтетазы повышается содержание цитруллина (цитруллинемия); при дефекте аргиназы - концентрация аргинина, аргининосукцината, цитруллина и т.д. При гипераммониемиях I и II типа вследствие дефекта орнитинкарбамоилтрансферазы происходит накопление карбамоилфосфата в митохондриях и выход его в цитозоль. Это вызывает увеличение скорости синтеза пиримидиновых нуклеотидов (вследствие активации карбамоилфосфатсинтетазы II), что приводит к накоплению оротата, уридина и урацила и выведению их с мочой. Содержание всех метаболитов повышается, и состояние больных ухудшается при увеличении количества белков в пище. Тяжесть течения заболевания зависит также от степени снижения активности ферментов. Все нарушения орнитинового цикла приводят к значительному повышению в крови концентрации аммиака, глутамина и аланина.
Гипераммониемия сопровождается появлением следующих симптомов:
тошнота, повторяющаяся рвота;
головокружение, судороги;
потеря сознания, отёк мозга (в тяжёлых случаях);
отставание умственного развития (при хронической врождённой форме
Все симптомы гипераммониемии - проявление действия аммиака на ЦНС (см. выше подраздел IV, Б).
Для диагностики различных типов гипераммониемии производят определение содержания аммиака в крови, метаболитов орнитинового цикла в крови и моче, акгивности фермента в биоптатах печени. Основной диагностический признак - повышение концентрации аммиака в крови. Содержание аммиака в крови может достигать 6000 мкмоль/л (в норме - 60 мкмоль/л). Однако в большинстве хронических случаев уровень аммиака может повышаться только после белковой нагрузки или в течение острых осложнённых заболеваний.
84. Обмен безазотистого остатка аминокислот. Гликогенные и кетогенные аминокислоты. Синтез глюкозы из аминокислот. Синтез аминокислот из глюкозы.
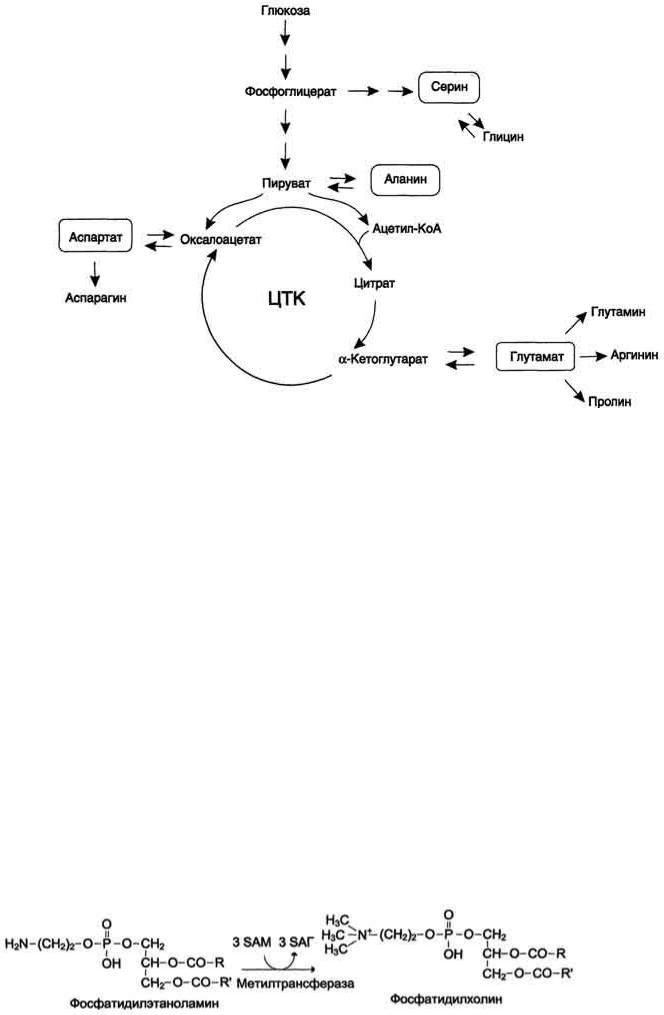
В ходе катаболизма аминокислот происходит отщепление аминогруппы и выделение аммиака. Другим продуктом дезаминирования аминокислот служит их безазотистый остаток в виде α-кетокислот. Катаболизм аминокислот происходит практически постоянно. За сутки в норме в организме человека распадается примерно 100 г аминокислот, и такое же количество должно поступать в составе белков пищи. Большая часть безазотистых остатков аминокислот превращается в пируват либо непосредственно (Ала, Сер), либо в результате более сложного пути, превращаясь вначале в один из метаболитов ЦТК. Затем в реакциях цитратного цикла происходит образование оксалоацетата, который превращается в фосфоенолпируват. Из фосфоенолпирувата под действием пируваткиназы образуется пируват. Пируват подвергается окислительному декарбоксилированию и превращается в ацетил-КоА, который окисляется в ЦТК до СО2 и Н2О с выделением энергии. Такой путь проходят преимущественно аминокислоты пищи. При недостатке глюкозы в организме фосфоенолпируват включается в глюконеогенез. Это происходит при голодании, длительной физической работу при сахарном диабете и других тяжёлых хронических заболеваниях, сопровождающихся распадом собственных белков организма. Скорость глюконеогенеза из аминокислот регулируется гормонами. Так, под действием глюкагона увеличивается активность регуляторных ферментов процесса, а кортизол индуцирует синтез ферментов глюконеогенеза в печени. Активация глюконеогенеза из аминокислот происходит и при преимущественно белковом питании. Катаболизм всех аминокислот сводится к образованию шести веществ,
вступающих в общий путь катаболизма: пируват ацетил-КоА α-кетоглутарат сукцинил-КоА фумарат оксалоацетат.

Аминокислоты, которые превращаются в пируват и промежуточные продукты ЦТК (α-КГ, сукцинил-КоА, фумарат) и образуют в конечном итоге оксалоацетат, могут использоваться в процессе глюконеогенеза. Такие аминокислоты относят к группе гликогенных аминокислот.
Некоторые аминокислоты в процессе катаболизма превращаются в ацетоацетат (Лиз, Лей) или ацетил-КоА (Лей) и могут использоваться в синтезе кетоновых тел. Такие аминокислоты называют кетогенными.
Ряд аминокислот используется и для синтеза глюкозы, и для синтеза кетоновых тел, так как в процессе их катаболизма образуются 2 продукта - определённый метаболит цитратного цикла и ацетоацетат (Три, Фен, Тир) или ацетил-КоА (Иле). Такие аминокислоты называют смешанными, или гликокетогенными.
В условиях голодания часть белков мышечной ткани распадается до аминокислот, которые далее включаются в процесс катаболизма. Аминокислоты, которые при катаболизме превращаются в пируват или метаболиты цитратного цикла, могут рассматриваться как потенциальные предшественники глюкозы и гликогена и носят название гликогенных. Например, окса-лоацетат, образующийся из аспарагиновой кислоты, является промежуточным продуктом как цитратногр цикла, так и глюконеогенеза.
Из всех аминокислот, поступающих в печень, примерно 30% приходится на долю аланина. Это объясняется тем, что при расщеплении мышечных белков образуются аминокислоты, многие из которых превращаются сразу в пируват или сначала в оксалоацетат, а затем в пируват. Последний превращается в аланин, приобретая аминогруппу от других аминокислот. Аланин из мышц переносится кровью в печень, где снова преобразуется в пируват, который частично окисляется и частично включается в глюкозонеогенез. Следовательно, существует следующая последовательность событий (глюкозо-аланиновый цикл): глюкоза в мышцах → пируват в мышцах → аланин в мышцах → аланин в печени → глюкоза в печени → глюкоза в мышцах. Весь цикл не приводит к увеличению количества глюкозы в мышцах, но он решает проблемы транспорта аминного азота из мышц в печень и предотвращает лактоацидоз.
В организме человека возможен синтез восьми заменимых аминокислот: Ала, Асп, Асн, Сер, Гли, Глу, Глн, Про. Углеродный скелет этих аминокислот образуется из глюкозы. α-аминогруппа вводится в соответствующие α- кетокислоты в результате реакций трансаминирования. ниверсальным донором α-аминогруппы служит глутамат.
Путём трансаминирования α-кетокислот, образующихся из глюкозы, синтезируются аминокислоты.
85. Трансметилирование. Метионин и S-аденозилметионин. Синтез креатина, адреналина и фосфатидилхолинов
Метионин - незаменимая аминокислота. Она необходима для синтеза белков организма, участвует в реакциях дезаминирования, является источником атома серы для синтеза цистеина. Метионил-тРНК участвует в инициации процесса трансляции. Метальная группа метионина - мобильный одноуглеродный фрагмент, используемый для синтеза ряда соединений. Перенос метильной группы метионина на соответствующий акцептор называют реакцией трансметилирования, имеющей важное метаболическое значение. Метальная группа в молекуле метионина прочно связана с атомом серы, поэтому непосредственным донором этого одноутлеродного фрагмента служит активная форма аминокислоты.
Реакция активация метионина Активной формой метионина является S-аденозилметионин (SAM) - сульфониевая форма аминокислоты, образующаяся в результате присоединения метионина к молекуле аденозина. Аденозин образуется при гидролизе АТФ. Эту реакцию катализирует фермент метионин аденозилтрансфераза, присутствующий во всех типах клеток. Структура (-S+-CH3) в SAM - нестабильная группировка, определяющая высокую активность метильной группы (отсюда термин "активный метионин"). Эта реакция уникальна для биологических систем, так как, по-видимому, является единственной известной реакцией, в результате которой освобождаются все три фосфатных остатка АТФ. Отщепление метильной группы от SAM и перенос её на соединение-акцептор катализируют ферменты метилтрансферазы. SAM в ходе реакции превращается в S-аденозилгомоцистеин (SAT)
Примеры реакций трансметилирования
Синтез фосфатидилхолина из фосфатидилэтиноламина
Фосфатидилхолины (лецитины) - наиболее распространённая группа глицерофосфолипидов, участвующих в образовании мембран клеток и липопротеинов, в составе которых осуществляется транспорт липидов
