
химия
.docx1) Адсорбционная хроматография — вид хроматографии, основанный на способности твёрдого вещества — неподвижной фазы — сорбировать примеси, находящиеся в подвижной фазе. При этом эффективность разделения примесей пропорциональна их величинам адсорбции при условиях эксперимента. Процесс взаимодействия может сопровождаться химическим взаимодействием примесей с неподвижной фазой, то есть хемосорбцией. Устанавливается динамическое равновесие, вследствие чего молекулы разделяемой смеси часть времени находятся в НФ, а часть - в ПФ. Вдоль хроматографической системы движутся только те молекулы, которые находятся в ПФ. Разные вещества обладают различным сродством к ПФ и НФ. Вещество, сильнее взаимодействующее с НФ, будет медленнее двигаться через хроматографическую систему по сравнению с веществом, слабее взаимодействующим с НФ. Для разделения разных молекул НФ должна обладать хотя бы одним из их основных свойств:1) физически сорбировать вещества, находящиеся в ПФ; 2) химически сорбировать вещества, находящиеся в ПФ; 3) растворять разделяемые вещества; 4) иметь пористую структуру и поэтому удерживать одни вещества и не задерживать другие, в зависимости от их размеров или формы.
Тонкослойная хроматография (ТСХ) основана на различии в скорости перемещения компонентов анализируемой смеси вдоль тонкого слоя сорбента в потоке растворителя. Тонкий слой сорбента в ТСХ может выполнять функцию адсорбента, ионита, носителя жидкой фазы. Адсорбционная ТСХ основана на сорбции растворенного вещества поверхностью сорбента.
Распределительная ТСХ основана на распределении вещества между двумя несмешивающимися жидкостями, в которых оно растворяется. При этом одна из жидкостей удерживается твердым носителем. Ионообменная ТСХ основана на образовании ионных соединений между растворенными веществами и заряженными группами сорбента. Выбор сорбента и элюента в ТСХ зависит от вида хроматографии. В адсорбционной ТСХ в качестве сорбентов применяют силикагели, оксид алюминия, целлюлозу, которые наносят тонким слоем на стеклянную пластинку или алюминиевую фольгу. Некоторые фирмы выпускают готовые пластинки с адсорбентом. В распределительной ТСХ применяют двухфазную систему, в которой разделяемые вещества обладают необходимым коэффициентом распределения. Для анализа методом ионообменной ТСХ используют специальные сорта ионообменной целлюлозы, а также иониты на основе сефадексов - сшитых декстранов. Они обладают свойствами молекулярных сит. Метод ТСХ позволяет разделять смеси аминокислот, белков, нуклеотидов, липидов, смеси моно- и олигосахаридов. В настоящее время ТСХ занимает одно из ведущих мест среди методов разделения биоорганических веществ.
Для количественной оценки подвижности вещества в хроматографической системе используют коэффициент подвижности Rf, равный отношению расстояния l, пройденного веществом (мм), к расстоянию, пройденному растворителем L (мм). Коэффициент подвижности Rf можно определить экспериментально: на хроматограмме измеряют расстояние l от линии старта вещества до центра пятна и расстояние от линии старта до линии финиша растворителя – L. Величина Rf характеризует положение зоны вещества на хроматограмме. Обычно коэффициент подвижности лежит в пределах Rf = 0-1. Оптимальное значение составляет 0,3 – 0,7. Условия хроматографирования подбираются так, чтобы величина Rf отличалась от нуля и единицы. Для воспроизводимости и строго постоянных условий хроматографирования Rf = const. Разделение веществ практически возможно, если Rf (I) – Rf (II) ≥ 0,1.
Степень разделения веществ в колонке определяется расстоянием между максимумами двух соседних пиков и шириной хроматографической полосы. Расстояние между максимумами зависит от селективности адсорбента по отношению к разделяемым веществам, а ширина полосы - от эффективности колонки, которая определяется характером упаковки частиц адсорбента, вязкостью элюента, размыванием в соединительных узлах и детекторе. Высокоэффективная колонка способна разделять вещества и при малой селективности адсорбента.
2) Бумажная хроматография основана на различии в скорости перемещения компонентов анализируемой смеси по бумаге в потоке растворителя. В бумажной хроматографии используют специальную бумагу, которая содержит только целлюлозные волокна. Она может служить неподвижной фазой или носителем неподвижной фазы. В распределительной бумажной хроматографии неподвижная фаза – адсорбированная бумагой вода, а подвижная фаза – органический растворитель. Скорость перемещения компонентов смеси зависит от коэффициентов их распределения между фазами. В адсорбционной бумажной хроматографии разделение компонентов смеси происходит благодаря различию в их сорбируемости адсорбентом – бумагой. В качестве подвижной фазы используются смеси органических растворителей с водой. В ионообменной бумажной хроматографии используют бумагу, пропитанную ионообменной смолой. Скорость перемещения компонентов смеси в этом случае зависит от констант ионного обмена. Осадочная бумажная хроматография осуществляется на бумаге, пропитанной раствором реагента-осадителя, образующего с разделяемыми веществами малорастворимые соединения. Скорость движения компонентов определяется константами растворимости этих соединений. В лигандообменной бумажной хроматографии бумагу предварительно обрабатывают растворами ионов металлов, например Са2+, при разделении аминов и аминокислот. При этом компоненты перемещаются в зависимости от констант устойчивости их комплексных соединений с ионами металлов. С помощью бумажной хроматографии можно разделять и анализировать практически все классы химических соединений, в том числе аминокислоты, сахара, стероиды, витамины, антибиотики.
3) Ионообменная хроматография основана на различной способности разделяемых ионов к ионному обмену с фиксированными ионами сорбента, образующимися в результате диссоциации ионогенных групп сорбента. Для разделения катионов используют катиониты, анионов – аниониты. Элюентом в первом случае служит раствор кислоты, во втором – раствор щелочи. Ионообменная хроматография применяется для разделения катионов и анионов, аминов, аминокислот. Высокоэффективная ионнообменная хроматография смесей нуклеотидов, нуклеозидов, пуриновых и пиримидиновых оснований и их метаболитов в биологических жидкостях (плазма крови, моча, лимфа) используется для диагностики заболеваний. Белки и нуклеиновые кислоты разделяют с помощью ионнообменной хроматографии на гидрофильных высокопроницаемых ионитах на основе целлюлозы, декстранов, синтетических полимеров, широкопористых силикагелей. Иониты — твердые нерастворимые вещества, способные обменивать свои ионы на ионы из окружающего их раствора. Катиониты - представляют собой нерастворимые многоосновные кислоты, способные к обмену катионов. В них катион водорода при адсорбции замещается на катионы металла R(COOH)n R(COO-)n + nH+ ; или R(SO3H)n R(SO)n + nH+. 3Н+-форму и только после этого медленно пропускают очищаемую водную систему, из которой катионит адсорбирует катионы металла, например,[Kat]Hn + 0,5nCa2+ [Kat] 0,5nCa + nH+Аниониты - представляют собой нерастворимые многоатомные основания, способные к обмену анионовR(NH3OH)n R(NH3)n + nOH–[An](OH)n + nCl– [An]Cln + nOH–Перед применением аниониты промывают щелочью, переводя их в ОН– – форму, и после этого используют для очистки водных систем от анионов. Амфолиты - иониты, у которых активная группа в зависимости от рН раствора может вести себя как кислотная или как основная. Основные физико-химические характеристики ионитов К основным характеристикам ионитов относятся: обменная емкость, кислотно-основные свойства, химическая стойкость, набухаемость. Обменная емкость ионитов определяется числом функциональныхгрупп в ионите, приходящихся на единицу массы сухой смолы. Обменную емкость ионитов выражают в ммолях извлекаемых из раствора ионов в расчете на I г сухого ионита. Обменная емкость современных ионитов составляет 3-10 ммоль/г. Обменная емкость зависит от характера функциональных групп ионита, природы обменивающихся ионов, концентрации вещества в растворе и его рН. Катиониты широко применяются для уменьшения жесткости воды путем связывания катионов кальция и магния, содержащихся в природных водах. Перед применением катионит промывают кислотой, переводя их в Обычно это синтетические органические смолы, имеющие кислотные или щелочные группы. Иониты разделяются на катиониты, поглощающие катионы, и аниониты, поглощающие анионы. Полная обменная емкость ( ПОЕ ) определяется числом функциональных групп, способных к ионному обмену, в единице массы воздушно-сухого или набухшего ионита и выражается в мг-экв/г или мг-экв/л. Она является постоянной величиной, которую указывают в паспорте ионита, и не зависит от концентрации или природы обменивающегося иона.
4) ГАЗОАДСОРБЦИОННАЯ ХРОМАТОГРАФИЯ (ГАХ), вид газовой хроматографии, в к-ром неподвижной фазой служит твердое тело (адсорбент). Применяется для анализа и препаративного разделения газовых и жидких смесей, а также летучих твердых тел. Жидкости и твердые в-ва перед вводом в хроматографич. колонку переводят в парообразное состояние. В случае твердых нелетучих или термически нестабильных в-в анализируют газообразные продукты их термич. распада (пиролитич. хроматография) или летучие и термически стабильные производные (реакционная хроматография).
ГАЗО-ЖИДКОСТНАЯ ХРОМАТОГРАФИЯ (ГЖХ,газожидко-твердофазная хроматография),
вид хроматографии,
в к-рой подвижной фазой служит газ,
а неподвижной - жидкость,
нанесенная тонким слоем (![]() 100
нм) на твердый носитель;
вариант газовой
хроматографии.
Неподвижная жидкая фаза (НЖФ) должна
быть термически стабильной, химически
устойчивой, иметь
небольшую вязкость. Газо-жидкостную хроматографию применяют
для разделения и анализа соед., к-рые
могут быть переведены в парообразное
состояние без разложения, а также для
определения таких физ.-хим. характеристик
в-ва,
как константа распределения, константа комплексообразования,
теплота растворения,
коэф.активности и
др. Газо-жидкостная хроматография используется
также для исследования кинетики
жидкофазных р-ций, протекающих в
хроматографич. колонке между
летучим реагентом и
нелетучим в-вом, растворенным в жидкой
фазе.
100
нм) на твердый носитель;
вариант газовой
хроматографии.
Неподвижная жидкая фаза (НЖФ) должна
быть термически стабильной, химически
устойчивой, иметь
небольшую вязкость. Газо-жидкостную хроматографию применяют
для разделения и анализа соед., к-рые
могут быть переведены в парообразное
состояние без разложения, а также для
определения таких физ.-хим. характеристик
в-ва,
как константа распределения, константа комплексообразования,
теплота растворения,
коэф.активности и
др. Газо-жидкостная хроматография используется
также для исследования кинетики
жидкофазных р-ций, протекающих в
хроматографич. колонке между
летучим реагентом и
нелетучим в-вом, растворенным в жидкой
фазе.
5) В тетради по лекциям…
6) Электролитическая подвижность ионов (u) – это средняя скорость направленного движения ионов в растворе при напряженности электрического поля 1 В/м. Величина электролитической подвижности ионов в растворах зависит от: Природы иона: чем меньше истинный радиус иона, тем больше его эффективный радиус в растворе электролита, который определяется степенью его гидратации (сольватации), тем ниже подвижность. Степень гидратации будет тем больше, чем больше плотность заряда на поверхности иона электролита. Скорость движения многозарядных ионов мало отличается от скорости движения однозарядных, что обусловлено большей степенью гидратации многозарядных вследствие большей плотности заряда на их поверхности. Природы растворителя: а) чем больше его полярность (выше диэлектрическая постоянная), тем больше степень гидратации, тем меньше электролитическая подвижность; б) чем больше вязкость среды, тем больше сопротивление движению иона, тем меньше подвижность. Ионной силы раствора: чем больше ионная сила раствора, тем сильнее межионное взаимодействие, тем меньше подвижность. Температуры раствора: с увеличением температуры уменьшается вязкость среды и степень сольватации (гидратации) в связи с чем увеличивается электролитическая подвижность. Концентрации ионов. При повышении концентрации электролита увеличивается ионная сила раствора, и скорость движения ионов уменьшается за счет возрастающих межионных взаимодействий. Концентрация ионов зависит от силы электролита. В растворах сильных электролитов при разбавлении (концентрация ионов в единице объема раствора уменьшается) снижается межионное взаимодействие и подвижность ионов увеличивается. В растворах слабых электролитов подвижность их ионов мало зависит от разбавления, так как концентрация ионов в этих растворах невелика.
7) Удельная электрическая проводимость (k , каппа) – количество электричества, переносимое ионами, содержащимися в растворе, через поперечное сечение раствора площадью 1 м2, при напряженности однородного электрического поля 1 В,м за 1 с. (k=1/p) В аналитической практике удельная электрическая проводимость выражается в См/см. Физический смысл – это количество электричества, перенесенное всеми ионами через поперечное сечение раствора площадью 1 м2 на расстояние 1 м за секунду при Е = 1 В/м. Удельная электрическая проводимость зависит от природы электролита, его концентрации (разведения), скорости движения ионов и температуры. Чем выше заряд иона, тем большее количество электричества переносит данный ион соответствующему электроду.
8)
Молярная
электрическая проводимость ( с)
– это электрическая проводимость 1
моль электролита, находящегося в
растворе между параллельными электродами
с расстоянием между ними 1 м при
напряженности электрического поля 1
В/м.
с)
– это электрическая проводимость 1
моль электролита, находящегося в
растворе между параллельными электродами
с расстоянием между ними 1 м при
напряженности электрического поля 1
В/м.
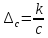 ,где
с
–
молярная концентрация электролита,
моль/м3. Молярная электрическая
проводимость при разбавлении может
только возрастать, так как при постоянном
количестве растворенного вещества у
слабых электролитов увеличивается
общее число ионов за счет возрастания
степени диссоциации (закон Оствальда),
а у сильных электролитов за счет
уменьшения межионного взаимодействия.
При бесконечном разведении молярная
электрическая проводимость перестает
зависеть от концентрации и достигает
максимального значения, называемого
предельной молярной электрической
проводимостью (
,где
с
–
молярная концентрация электролита,
моль/м3. Молярная электрическая
проводимость при разбавлении может
только возрастать, так как при постоянном
количестве растворенного вещества у
слабых электролитов увеличивается
общее число ионов за счет возрастания
степени диссоциации (закон Оствальда),
а у сильных электролитов за счет
уменьшения межионного взаимодействия.
При бесконечном разведении молярная
электрическая проводимость перестает
зависеть от концентрации и достигает
максимального значения, называемого
предельной молярной электрической
проводимостью ( о).
о).
9)
Предельная
молярная электрическая проводимость
ионов ( о) – молярная электрическая проводимость
электролита в бесконечном разбавленном
растворе. Бесконечное
разведение –
это такое разведение, при котором у
сильных электролитов межионное
взаимодействие практически отсутствует,
а у слабых – степень диссоциации
достигает своего максимального значения
для данного электролита, однако, у
слабых электролитов степень диссоциации
не достигает единицы. Молярная
электрическая проводимость при данном
разведении (
о) – молярная электрическая проводимость
электролита в бесконечном разбавленном
растворе. Бесконечное
разведение –
это такое разведение, при котором у
сильных электролитов межионное
взаимодействие практически отсутствует,
а у слабых – степень диссоциации
достигает своего максимального значения
для данного электролита, однако, у
слабых электролитов степень диссоциации
не достигает единицы. Молярная
электрическая проводимость при данном
разведении ( с)
всегда меньше
с)
всегда меньше
 о.
Отношение этих величин характеризует:
а) для сильных электролитов - коэффициент
электрической проводимости:
о.
Отношение этих величин характеризует:
а) для сильных электролитов - коэффициент
электрической проводимости: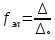 Закон
независимого движения ионов Кольрауша
При
бесконечном разведении межионные
взаимодействия в растворе практически
отсутствуют, поэтому ионы переносят
электричество независимо друг от друга
пропорционально заряду, подвижности
и концентрации ионов. Предельная
молярная электрическая проводимость
ионов о – количество электричества,
переносимое 1 моль ионов данного вида
в бесконечно разбавленном растворе за
1 секунду через поперечное сечение
раствора площадью 1 м2 при напряженности
однородного электрического поля 1 В/м.
Предельная
молярная электрическая проводимость
данного
электролита равна сумме предельных
молярных проводимостей ионов, входящих
в его состав.
Закон
независимого движения ионов Кольрауша
При
бесконечном разведении межионные
взаимодействия в растворе практически
отсутствуют, поэтому ионы переносят
электричество независимо друг от друга
пропорционально заряду, подвижности
и концентрации ионов. Предельная
молярная электрическая проводимость
ионов о – количество электричества,
переносимое 1 моль ионов данного вида
в бесконечно разбавленном растворе за
1 секунду через поперечное сечение
раствора площадью 1 м2 при напряженности
однородного электрического поля 1 В/м.
Предельная
молярная электрическая проводимость
данного
электролита равна сумме предельных
молярных проводимостей ионов, входящих
в его состав.
 о(KtnAnm)
= n
о(KtnAnm)
= n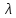 о(Ktm+)
+ m
о(Ktm+)
+ m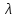 o(Ann–),
o(Ann–),
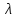 о(Ktm+) – предельная молярная проводимость
катиона, о(Ann–) – предельная молярная
проводимость аниона. Закон Кольрауша
можно выразить через предельные
подвижности ионов:
о(Ktm+) – предельная молярная проводимость
катиона, о(Ann–) – предельная молярная
проводимость аниона. Закон Кольрауша
можно выразить через предельные
подвижности ионов:
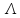 о
= F
о
= F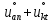 ,
где
,
где
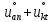 – предельные электрические подвижности
ионов, F
– число
Фарадея.
– предельные электрические подвижности
ионов, F
– число
Фарадея.
10) Кондуктометрические методы анализа. Кондуктометрия – это физико-химический метод анализа, основанный на измерении электрической проводимости жидких сред. Различают прямую кондуктометрию и кондуктометрическое титрование (косвенная кондуктометрия). Прямая кондуктометрия основана на том, что в области разбавленных и умеренно концентрированных растворов электрическая проводимость растет с увеличением концентрации электролита. Кондуктометрическое измерение содержания электролитов проводится с помощью калибровочного графика зависимости электрической проводимости раствора от концентрации тех или иных электролитов. В связи с относительно близкими значениями подвижностей ионов кондуктометрические измерения позволяют получить информацию только об общей концентрации ионов в растворе. Преимущества – быстрота проведения анализа и возможность автоматизации. Прямая кондуктометрия применяется для определения: – суммарного содержания электролитов в различных биологических средах; – основности органических кислот; – растворимости и константы растворимости малорастворимых соединений; – кислотности различных растворов, в том числе биологических жидкостей; – минерализации почв и грунта. Прямая кондуктометрия применяется также для контроля качества воды, поэтому современные установки для перегонки или деминерализации воды снабжаются кондуктометрическими датчиками (кондуктометрами). Кондуктометрическое титрование – титриметрический метод анализа, в котором точка эквивалентности определяется по изменению электрической проводимости раствора электролита в процессе титрования. Преимуществом кондуктометрического титрования является: – возможность использовать реакции, при которых вещества реагируют не в стехиометрических отношениях. В кондуктометрическом титровании используются химические реакции, в ходе которых достаточно заметно изменяется электрическая проводимость раствора или резкое изменение электрической проводимости после точки эквивалентности. К таковым относятся реакции: кислотно-основного взаимодействия (нейтрализации); комплексообразования, осаждения, окислительно-восстановительные. Наибольшее распространение получили методы кондуктометрического титрования, основанные на использовании кислотно-основных реакций. Использование кондуктометрии в медицине. К биологическим средам могут быть отнесены сыворотка и плазма крови, моча, желудочный сок, спинномозговая жидкость, пот, слюна, цитоплазма клеток и т.п. Эти жидкости являются проводниками II рода, так как обладают ионной проводимостью. Методы кондуктометрии эффективны при экспрессной оценке клинического состояния организма.
11) К биологическим средам могут быть отнесены сыворотка и плазма крови, моча, желудочный сок, спинномозговая жидкость, пот, слюна, цитоплазма клеток и т.п. Эти жидкости являются проводниками II рода, так как обладают ионной проводимостью. Методы кондуктометрии эффективны при экспрессной оценке клинического состояния организма. Например, в норме удельная электрическая проводимость мочи равна 1,65–2,29 См м–1. При заболеваниях почек (нефрит, нефросклероз, гломерулонефрит) величина удельной электрической проводимости уменьшается до 0,85–1,38 См м–1, что объясняется уменьшением концентрации хлорида натрия и увеличением концентрации белка в моче. При сахарном диабете электрическая проводимость мочи понижается (0,9–1,44 См м–1) вследствие повышения содержания неэлектролита сахара и уменьшения концентрации электролитов. Электрическая проводимость желудочного сока зависит от концентрации свободной НСl. При 18оС удельная электрическая проводимость менее 0,8 См м–1 указывает на бескислотность, значения в пределах (0,8–1 См м–1) – на гипокислотность, (1–1,25 См м–1) – на нормальную кислотность, выше 1,25 См м–1 – на гиперкислотность. Для нормальной плазмы крови человека к=1,40 См м–1. Уменьшение электрической проводимости крови наблюдается при пневмонии, диабете, кетонурии, уремии, гепатите. При воспалительных процессах на первой стадии происходит увеличение сопротивления тканей за счет набухания клеток и уменьшения объема межклеточных пространств вследствие осмоса. Электрическая проводимость крови изменяется в процессе свертывания, то есть при изменении ее агрегатного состояния. При появлении в крови фибрина и затем кровяного сгустка электрическая проводимость падает до тех пор, пока не начинается ретракция и фибринолиз, сопровождающиеся выделением сыворотки из сгустка. При этом происходит некоторое увеличение электрической проводимости.
12) Электролиты в организме. Слюна как раствор электролитов Электролиты входят в состав всех клеток и тканей организма, составляя более 4% их массы. Они играют очень важную роль в поддержании осмотического давления, которое влияет на распределение в клетках воды и растворенных веществ, обеспечивая, таким образом, целый ряд жизненных функций, например, форму и тургор клеток, эластичность тканей, транспорт веществ и др. Кроме пассивного транспорта, каким является осмос, в организме имеет место активный транспорт, то есть перемещение ионов против градиента концентраций. Катионы натрия, калия, кальция, анионы хлора участвуют в возникновении мембранных потенциалов клеток, проводимости нервных волокон. Электролитный обмен тесно связан с обменом органических веществ. В значительной степени это обусловлено влиянием электролитов на степень диссоциации, гидратацию, растворимость, устойчивость многих внутриклеточных и внеклеточных белков. Большое значение при этом имеет валентность и химическая природа ионов. Этими факторами определяется также способность ионов взаимодействовать с ВМС-белками и нуклеиновыми кислотами, то есть их участие в формировании определенных конформаций полимеров Минеральные ионы поступают в организм с пищей и питьем, а гидрокарбонат-анион НСО3–, органические ионы являются, главным образом, продуктами метаболизма. Слюна (saliva) – секрет слюнных желез, выделяющийся в полость рта. В полости рта находится биологическая жидкость, называемая ротовой жидкостью, которая, кроме секрета слюнных желез, включает микро- флору и продукты их жизнедеятельности, содержимое пародонтальных карманов, отслоившийся эпителий, распад мигрирующих в полость рта лейкоцитов, остатки пищевых продуктов и др. В сутки у взрослого чело- века выделяется 1500 – 2000 мл слюны. Однако скорость секреции неравномерная и зависит от ряда факторов: возраста (после 55–60 лет слюноотделение замедляется); нервного возбуждения; пищевого раздражения; сна/бодрствования (во время сна слюны выделяется в 8–10 раз меньше, чем в период бодрствования). Слюна также является раствором электролитов. Буферная емкость слюны – это способность слюны нейтрализовать кислоты и щелочи. Установлено, что прием в течение длительного времени углеводистой пищи снижает, а прием высокобелковой – повышает буферную емкость слюны. Высокая буферная емкость слюны – фактор, повышающий устойчивость зубов к кариесу. Концентрация водородных ионов (pH). В среднем pH слюны в полости рта в нормальных условиях находится в пределах 6,5–7,5, т.е. является нейтральной. Установлены незначительные колебания pH в течение дня и ночи (снижение в ночное время). Наиболее сильным дестабилизирующим pH фактором слюны является кислотообразующая активность микрофлоры полости рта, которая особенно усиливается после приема углеводистой пищи. "Кислая" реакция ротовой жидкости наблюдается очень редко, хотя локальное снижение pH – явление закономерное и обусловлено жизнедеятельностью микрофлоры зубного налета, кариозных полостей, осадке слюны.
13)
Электродный
потенциал,
возникающий на границе металл-раствор,
содержащий катионы этого металла.
Электродные
потенциалы Электрод
состоит из металла (электронного
проводника) и раствора соли этого
металла (ионного проводника). При
контакте некоторых металлов с водой
происходит гидратация расположенных
на поверхности катионов металла
полярными молекулами воды. Выделяющаяся
при этом энергия гидратации (Ег)
расходуется на разрыв связи ионов с
кристаллической решеткой металла (Ем).
Если Ег>Ем,
то расположенные на поверхности катионы
переходят в водную фазу. Металлическая
пластинка при этом приобретает
отрицательный заряд, а прилегающий
слой воды – положительный. На границе
раздела металл-вода возникает ДЭС. Если
Ег<
Ем,
то катионы металла (Pt, Pd и т.д.) не перейдут
в водную фазу, ДЭС не возникнет. Если
металл опустить в раствор соли этого
металла, то ионы металла будут переходить
из водной фазы в металлическую, теряя
при этом гидратную оболочку, и входить
в состав кристаллической решетки. В то
же время молекулы воды, адсорбируясь
и ориентируясь определенным образом
на границе раздела фаз, будут
взаимодействовать с ионами, находящимися
в металле, и вырывать их из металлической
решетки. Энергетическое состояние
ионов в растворе и металле неодинаково,
поэтому в первый момент после установления
контакта ионы металла переходят из
металла в раствор и в обратном направлении
с разной скоростью. Основную роль при
этом играет соотношение энергии связи
иона в кристаллической решетке металла
и энергии гидратации иона молекулами
воды. Стандартный
электродный потенциал Стандартный
электродный потенциал возникает на
границе металл–раствор при активности
потенциалопределяющих ионов в растворе
1 моль/л и Т
=
298 К. Абсолютное значение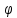 измерить или рассчитать невозможно.
Определяют
измерить или рассчитать невозможно.
Определяют
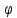 о
относительно стандартного электрода.
По Международному соглашению в качестве
стандартного электрода используют
стандартный водородный электрод.
о
относительно стандартного электрода.
По Международному соглашению в качестве
стандартного электрода используют
стандартный водородный электрод.
