
БІЛКИ
.doc
БІЛКИ
Найважливішими
біомолекулами є білки. В
1838 р. голландський вчений Мюльдервідобразив їх
значення в назві “протеїни” (від
грецького "протос" – первинний).
На білки припадає не менше 50 % сухої маси
клітини. За хімічною будовою білки –
це біополімери, які складаються із
залишків амінокислот, з’єднаних
пептидними зв’язками. Для хімічного
складу білків характерний постійний
середній вміст нітрогену - біля 16%.
Білки
виконують важливі біологічні
функції: а)
каталітичну - найсуттєвішу, так як
переважна більшість перетворень в
організмі здійснюється тільки під
впливом каталізаторів – ферментів, які
є білками; б) структурну - білки у тварин
утворюють рогові покриви, є основою
сполучення між клітинами (на структурний
білок сполучної тканини колаген припадає
третина всіх білків організму за масою);
в) рухову (скорочувальні білки у всіх
живих організмів побудовані і функціонують
за спільним принципом, наприклад, актин
і міозин у м’язовому волокні); г)
транспортну - переносять гази (гемоглобін,
міоглобін), залишки жирних кислот
(альбумін крові), здійснюють активний
транспорт багатьох речовин через
мембрану; д) регуляторну - швидкість
біохімічних перетворень регулюють
зокрема гормони гіпофізу, підшлункової
залози, які є білками або похідними
амінокислот, нейроолігопептиди
забезпечують в головному мозку складні
психічні і фізіологічні явища (пептид
страху, пам’яті тощо), білки є регуляторами
зчитування спадкової інформації з ДНК,
рецепторами мембран, які забезпечують
трансформацію і передачу в клітину
інформації (гормонального сигналу); е)
захисну - антитіла, які виробляються у
відповідь на появу чужорідних молекул,
зв’язують і знешкоджують їх - білки,
серед них - інтерферон – єдиний відомий
білок, який знешкоджує чужорідну
нуклеїнову кислоту; токсини, наприклад
бутулізму є захисними молекулами для
організму, який їх виділяє; є) енергетичну
- при повному окисненні 1 г білка
виділяється біля 17 кДж енергії, проте
білки не відкладаються про запас, а при
їх розщепленні вивільняється токсичний
продукт – аміак, на детоксикацію якого
витрачається енергія. Половина з
амінокислот, які утворюють білки, в
організмі людини не синтезується і
повинна поступати з їжею, тому використання
білків в енергетиці є для організму
вимушеним, пов’язаним із незбалансованим
вмістом в їжі амінокислот, необхідних
для побудови білків.
Таким чином, білки
забезпечують більшість життєвих проявів.
Найпростішим живим організмом, який
здатний реалізувати свою спадкову
інформацію, є вірус – комплекс нуклеїнової
кислоти і білка (вірус біологи жартома
називають кепською новиною у білковому
конверті).
5.1. Амінокислоти
До складу
білків входять a-амінокислоти, тобто
такі, в яких аміногрупа розташована
біля другого атома С. Між аміно- і
карбоксильною групами знаходиться
тільки один a-С атом. В процесах обміну
речовин утворюються і інші види
амінокислот.Наприклад, g-аміномасляна
кислота (ГАМК) - є медіатором
центральної нервовоїсистеми.
Відомо
20 a-амінокислот, які генетично кодуються,
і декілька їх похідних, що утворюються
шляхом ферментативної модифікації.
Загальну формулу a-амінокислоти можна
зобразити так:
 де
R- вуглеводневий радикал. Радикал може
бути аліфатичний або циклічний, містити
різні функціональні групи. Одна
із двадцяти a-амінокислот (пролін) є не
аміно-, а імінокислотою, тому що її
атом азоту входить до складу циклу.
Амінокислоти можна класифікувати за
різними ознаками. Для вивчення білків
зручний поділ за полярністю радикалів
на неполярні, полярні незаряджені та
полярні заряджені (позитивно або
негативно) (Табл. 5.1.) Подані тривіальні
назви амінокислот є найбільш вживаними.
В схемах амінокислоти та їх залишки
позначаються скорочено першими трьома
буквами назви.
Таблиця 5.1. Класифікація
амінокислот за полярністю радикалу*
Неполярний
радикал
де
R- вуглеводневий радикал. Радикал може
бути аліфатичний або циклічний, містити
різні функціональні групи. Одна
із двадцяти a-амінокислот (пролін) є не
аміно-, а імінокислотою, тому що її
атом азоту входить до складу циклу.
Амінокислоти можна класифікувати за
різними ознаками. Для вивчення білків
зручний поділ за полярністю радикалів
на неполярні, полярні незаряджені та
полярні заряджені (позитивно або
негативно) (Табл. 5.1.) Подані тривіальні
назви амінокислот є найбільш вживаними.
В схемах амінокислоти та їх залишки
позначаються скорочено першими трьома
буквами назви.
Таблиця 5.1. Класифікація
амінокислот за полярністю радикалу*
Неполярний
радикал
 Аланін
(Aла, Ala, A) Валін (Вал, Val, V)
Ізолейцин (Ілей, Ile, I)
Аланін
(Aла, Ala, A) Валін (Вал, Val, V)
Ізолейцин (Ілей, Ile, I)
 Лейцин
(Лей, Leu, L) Метіонін (Мет, Met, M)
Пролін (Про, Pro, P)
Лейцин
(Лей, Leu, L) Метіонін (Мет, Met, M)
Пролін (Про, Pro, P)
 Фенілаланін
(Фен, Phe, P) Триптофан (Три,
Trp, W)
Полярний незаряджений
радикал
Фенілаланін
(Фен, Phe, P) Триптофан (Три,
Trp, W)
Полярний незаряджений
радикал
 Гліцин
(Глі, Gly, G) Серин (Сер, Ser, S)
Цистеїн (Цис, Cys, C)
Гліцин
(Глі, Gly, G) Серин (Сер, Ser, S)
Цистеїн (Цис, Cys, C)
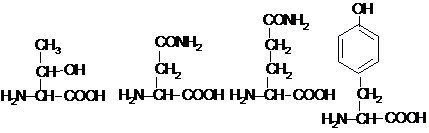 Треонін
Аспарагін
Глутамін
Тирозин
(Тре, Thr, T)
(Асн, Asn, N)
(Глн, Gln, Q) (Тир,
Tyr, Y)
Полярний заряджений
радикал
Треонін
Аспарагін
Глутамін
Тирозин
(Тре, Thr, T)
(Асн, Asn, N)
(Глн, Gln, Q) (Тир,
Tyr, Y)
Полярний заряджений
радикал
 Аспарагінова
кислота (Aсп, Asp, D) Глутамінова кислота
(Глу, Glu, E)
Аспарагінова
кислота (Aсп, Asp, D) Глутамінова кислота
(Глу, Glu, E)
 Лізин
(Ліз, Lys, K) Аргінін (Арг, Arg, R)
Гістидин (Гіс, His, H)
* - в дужках подаються
скорочені українська і англійська назви
і міжнародний символ
Кожна амінокислота,
крім гліцину, містить один чи більше
асиметричних атомів карбону, тобто
проявляє оптичну активність. За абсолютною
конфігурацією амінокислоти в організмах
належать до L-ряду. Лише у складі пептидів
деяких мікроорганізмів зустрічаються
D-амінокислоти, наприклад в токсині
бутулізму.
Амінокислоти - слабкі
електроліти. Вони містять групи як
кислотного, так і основного характеру,
тобто є біполярними йонами. Їх заряд
залежить від кількості цих груп і рН
середовища:
рН
<7 рН »7 рН >7
Лізин
(Ліз, Lys, K) Аргінін (Арг, Arg, R)
Гістидин (Гіс, His, H)
* - в дужках подаються
скорочені українська і англійська назви
і міжнародний символ
Кожна амінокислота,
крім гліцину, містить один чи більше
асиметричних атомів карбону, тобто
проявляє оптичну активність. За абсолютною
конфігурацією амінокислоти в організмах
належать до L-ряду. Лише у складі пептидів
деяких мікроорганізмів зустрічаються
D-амінокислоти, наприклад в токсині
бутулізму.
Амінокислоти - слабкі
електроліти. Вони містять групи як
кислотного, так і основного характеру,
тобто є біполярними йонами. Їх заряд
залежить від кількості цих груп і рН
середовища:
рН
<7 рН »7 рН >7
![]() катіон
біполярний йон
аніон
Сумарнй заряд певної амінокислоти
при певному значенні рН обчислюють за
константами дисоціації (рК) всіх її
функціональних груп. Значення рН, при
якому сумарний заряд амінокислоти
рівний 0, називається її
ізоелектричною точкою (рІ).Для
0,1 М розчинів аланіну рІ становить
6,02, для глутамінової кислоти - 3,22;
лізину - 9,74.
Кислотно-основні властивості амінокислот
зумовлюють їх буферну здатність
при рНблизькому до рК їх функціональних
груп. У складі білків з усіх амінокислот
найбільше значення мають
буферні властивості гістидину,
оскільки лише його радикал має значення
рК близьке до рН міжклітинної рідини
та крові (?7,4). Білок еритроцитів
гемоглобін має великий вміст
гістидину, що дуже важливо для його
функції.
Амінокислоти проявляють
спільні хімічні властивості,
пов’язані з наявністю карбоксильної та
аміногруп, а також індивідуальні,
зумовлені функціональними групами
радикалу. Останні використовуються
для ідентифікації окремих амінокислот.
Наприклад, взаємодія з азотною кислотою,
характерна для похідних бензолу,
використовується для визначення
фенілаланіну (ксантопротеїнова реакція),
а взаємодія сульфідів з йонами свинцю
- для визначення цистеїну (реакція
Фоля).
Для a-аміногрупи амінокислот
характерна чутлива реакція
з нінгідриновимреактивом: При
нагріванні a-амінокислот з
надлишком нінгідринового реактиву
утворюється розчинний продукт лілового
кольору. Імінокислота пролін
дає знінгідрином продукт жовтого
кольору.
Індивідуальні амінокислоти
визначають за продуктами
взаємодії їх a-аміногруп
із2,4-динітрофторбензолом (ДНФБ,
реактивом Сенгера) у слаболужному
середовищі. Утворені ДНФ-похідні
ідентифікують хроматографічно.
5.2.
Пептидний зв'язок. Пептиди
Амінокислоти
здатні до конденсації при
взаємодії карбоксильної групи
однієїамінокислоти та аміногрупи -
іншої:
катіон
біполярний йон
аніон
Сумарнй заряд певної амінокислоти
при певному значенні рН обчислюють за
константами дисоціації (рК) всіх її
функціональних груп. Значення рН, при
якому сумарний заряд амінокислоти
рівний 0, називається її
ізоелектричною точкою (рІ).Для
0,1 М розчинів аланіну рІ становить
6,02, для глутамінової кислоти - 3,22;
лізину - 9,74.
Кислотно-основні властивості амінокислот
зумовлюють їх буферну здатність
при рНблизькому до рК їх функціональних
груп. У складі білків з усіх амінокислот
найбільше значення мають
буферні властивості гістидину,
оскільки лише його радикал має значення
рК близьке до рН міжклітинної рідини
та крові (?7,4). Білок еритроцитів
гемоглобін має великий вміст
гістидину, що дуже важливо для його
функції.
Амінокислоти проявляють
спільні хімічні властивості,
пов’язані з наявністю карбоксильної та
аміногруп, а також індивідуальні,
зумовлені функціональними групами
радикалу. Останні використовуються
для ідентифікації окремих амінокислот.
Наприклад, взаємодія з азотною кислотою,
характерна для похідних бензолу,
використовується для визначення
фенілаланіну (ксантопротеїнова реакція),
а взаємодія сульфідів з йонами свинцю
- для визначення цистеїну (реакція
Фоля).
Для a-аміногрупи амінокислот
характерна чутлива реакція
з нінгідриновимреактивом: При
нагріванні a-амінокислот з
надлишком нінгідринового реактиву
утворюється розчинний продукт лілового
кольору. Імінокислота пролін
дає знінгідрином продукт жовтого
кольору.
Індивідуальні амінокислоти
визначають за продуктами
взаємодії їх a-аміногруп
із2,4-динітрофторбензолом (ДНФБ,
реактивом Сенгера) у слаболужному
середовищі. Утворені ДНФ-похідні
ідентифікують хроматографічно.
5.2.
Пептидний зв'язок. Пептиди
Амінокислоти
здатні до конденсації при
взаємодії карбоксильної групи
однієїамінокислоти та аміногрупи -
іншої:
 Утворена
сполука називається пептидом, а зв'язок
- пептидним. При сполученнідвох
амінокислот утворюється дипептид, трьох
- трипептид, а багатьох - поліпептид.
Пептидний зв'язок міцний, він піддається
гідролізу тільки при тривалому кип'ятіннів
кислому або лужному середовищі. В
пептиді виділяють N-кінець, на
якому знаходиться вільна аміногрупа,
та С-кінець, на якому міститься
незаміщенакарбоксильна група. Називаючи
пептид, назвам всіх амінокислот,
крім С-кінцевої,дають суфікс -ил або -іл, а
назву останньої не змінюють,
наприклад, гліцил-аланін,серил-тирозил-аргінін.
Пептидний зв'язок
має специфічну просторову форму.
Неподілена пара електронів азоту
взаємодіє з p-електронами
карбонільної групи,
утворюючи делокалізованусистему
електронів, розподілену між атомами О,
С і N. Тому зв'язок С-О слабший, ніж
подвійний, а зв'язок С-N міцніший, ніж
одинарний. Навколо зв'язку С-N неможливе
вільне обертання груп, оскільки він не
одинарний. В одній площинізнаходяться
атоми С, N, О, Н і a-вуглецеві атоми.
Причому атоми О і N знаходяться в
транс-положенні. Вільно обертатися
можуть лише радикали навколо a-вуглецевих
атомів. Така будова пептидного зв’язку
обмежує можливості просторовихконформацій пептидів.
Утворена
сполука називається пептидом, а зв'язок
- пептидним. При сполученнідвох
амінокислот утворюється дипептид, трьох
- трипептид, а багатьох - поліпептид.
Пептидний зв'язок міцний, він піддається
гідролізу тільки при тривалому кип'ятіннів
кислому або лужному середовищі. В
пептиді виділяють N-кінець, на
якому знаходиться вільна аміногрупа,
та С-кінець, на якому міститься
незаміщенакарбоксильна група. Називаючи
пептид, назвам всіх амінокислот,
крім С-кінцевої,дають суфікс -ил або -іл, а
назву останньої не змінюють,
наприклад, гліцил-аланін,серил-тирозил-аргінін.
Пептидний зв'язок
має специфічну просторову форму.
Неподілена пара електронів азоту
взаємодіє з p-електронами
карбонільної групи,
утворюючи делокалізованусистему
електронів, розподілену між атомами О,
С і N. Тому зв'язок С-О слабший, ніж
подвійний, а зв'язок С-N міцніший, ніж
одинарний. Навколо зв'язку С-N неможливе
вільне обертання груп, оскільки він не
одинарний. В одній площинізнаходяться
атоми С, N, О, Н і a-вуглецеві атоми.
Причому атоми О і N знаходяться в
транс-положенні. Вільно обертатися
можуть лише радикали навколо a-вуглецевих
атомів. Така будова пептидного зв’язку
обмежує можливості просторовихконформацій пептидів.
 Наявність
пептидного зв'язку визначають біуретовою реакцією,
характерною для амідів, зокрема,
для біурету: Першим біуретову реакцію
пептидів вивчавО. Я. Данилевський. Суть
її полягає у взаємодії пептидноі групи
з йонами міді (II) в лужному середовищі з
утворенням розчинного комплексу
фіолетового кольору. Ця реакція дуже
чутлива і використовується як для
якісного, так і для кількісного визначення
пептидів.
Відомо багато пептидів, які
виконують важливі біологічні функції.
Наприклад, глутатіон
(g-глутаміл-цистеїніл-гліцин, g-глу-цис-глі,
GSH). Цей пептид, на відміну від білків,
містить g-амінокислотний залишок. Він
викликає величезний інтерес біологів
і медиків, оскільки є найбільш поширеною
низькомолекулярною речовиною в клітині,
виконує біля ста функцій в
життєдіяльності майже всіх істот.
Він бере участь в захисті клітин від
токсичних хімічних речовин, продуктів
радіоактивного розпаду, впливає на
активність багатьох ферментів і стан
субклітинних структур. Переважно його
дія пов'язана із взаємоперетворенням
двох форм - окисненої і відновленої:
2GSH
®GSSG + 2H
Пептидну природу має багато
гормонів. Характеристика деяких
з них подана в таблиці 5.2.
Наявність
пептидного зв'язку визначають біуретовою реакцією,
характерною для амідів, зокрема,
для біурету: Першим біуретову реакцію
пептидів вивчавО. Я. Данилевський. Суть
її полягає у взаємодії пептидноі групи
з йонами міді (II) в лужному середовищі з
утворенням розчинного комплексу
фіолетового кольору. Ця реакція дуже
чутлива і використовується як для
якісного, так і для кількісного визначення
пептидів.
Відомо багато пептидів, які
виконують важливі біологічні функції.
Наприклад, глутатіон
(g-глутаміл-цистеїніл-гліцин, g-глу-цис-глі,
GSH). Цей пептид, на відміну від білків,
містить g-амінокислотний залишок. Він
викликає величезний інтерес біологів
і медиків, оскільки є найбільш поширеною
низькомолекулярною речовиною в клітині,
виконує біля ста функцій в
життєдіяльності майже всіх істот.
Він бере участь в захисті клітин від
токсичних хімічних речовин, продуктів
радіоактивного розпаду, впливає на
активність багатьох ферментів і стан
субклітинних структур. Переважно його
дія пов'язана із взаємоперетворенням
двох форм - окисненої і відновленої:
2GSH
®GSSG + 2H
Пептидну природу має багато
гормонів. Характеристика деяких
з них подана в таблиці 5.2.
Таблиця 5.2. Деякі гормони пептидної природи
|
Назва |
Кількість а.к. залишків |
Місце утворення |
Дія |
|
Окситоцин |
9 |
Гіпофіз |
Скорочення гладких м'язів, впливає на протікання родів і лактацію |
|
Вазопресин |
9 |
Гіпофіз |
Контролюєводний обмін в організмі |
|
Адренокортикотропнийгормон (АКТГ) |
39 |
Гіпофіз |
Регулюєсинтез стероїдних гормонів в корінаднирників |
|
Соматотропін (гормон росту) |
190 |
Гіпофіз |
Стимулює ріст кісток, скелету |
|
Інсулін |
51 |
Підшлункова залоза |
Регулюєобмін речовин |
|
Глюкагон |
29 |
Підшлункова залоза |
Регулює обмін речовин, антагоніст інсуліну |
|
Паратгормон |
84 |
Паращитовидна залоза |
Підвищує рівень кальцію в крові |
|
Кальцитонін |
32 |
Щитовидна залоза |
Зменшує рівень кальцію в крові, стимулює остеогенез |
Останні десятиліття
інтенсивно вивчаються нейроолігопептиди
(НОП) - невеликіпептиди (5-9 амінокислотних
залишків), які виробляються в
головному мозку і регулюють психічну
діяльність (викликають страх, роздратування,
біль, виділяються під
час сну). Наприклад, мет-енкефалін (тир-глі-глі-фен-мет) виникає в
нервовій тканині і послаблює больові відчуття,
зв’язується з тими ж рецепторами, що і
антибіотик морфін, і діє більш
ефективно.
Пептидом є антибіотик
граміцидин, який змінює проникність
біологічних мембран для низькомолекулярних
речовин.
5.3. Структура білків
За
хімічною будовою білки є поліпептидами.
Внаслідок взаємодії функціональних
груп поліпептиду між собою і з оточуючим
середовищем він набуває специфічноїпросторової форми.
Тільки в цій формі він є біологічно
активним. Для спрощення опису
просторової форми білкових молекул
користуються поняттям про
рівніструктурної організації (Ліндерстрем-Ланг).
Первинна
структура
Первинна структура білків
- це порядок розташування амінокислотних
залишків в нерозгалуженому поліпептидному ланцюгу:
 В
ланцюгу білка чергуються пептидні групи
і a-вуглецеві атоми. Амінокислотні
радикали не беруть участі в
утворенні зв’язків на цьому рівні.
Однак порядок їх розташування
має вирішальне значення для
просторової форми молекули. Дипептид,
який складається з двох різних амінокислот
(А і Б), може мати дві різніпослідовності "АБ" і
"БА". Для трьох амінокислот число
варіантів складає 6. Із 20 різних
амінокислот можна побудувати 10130 різних
послідовностей по 100 залишків в кожній.
Уявимо, що хоч по одній із таких молекул
є в природі. Скручені в
компактні клубочки, вони зайняли
б 1027 (тисяча квадрильйонів) об'ємів
Всесвіту. Зрозуміло, що лише мала частка
можливих комбінацій послідовностей
використовується
природою.
Розшифровка амінокислотної послідовності стала
дуже важливим етапом у вивченнібілків.
Першим дослідженим білком став інсулін
- гормон підшлункової залози (Ф. Сенгер,
1945 – 1954 р.р.). Як показав Сенгер, молекула
бичачого інсуліну, складається з двох
ланцюгів: А (21 амінокислотний залишок)
і В (30 амінокислотних залишків), з’єднаних
між собою дисульфідними містками
між залишками цистеїну. Ще один такий
місток утворюється всередині ланцюга
А:
В
ланцюгу білка чергуються пептидні групи
і a-вуглецеві атоми. Амінокислотні
радикали не беруть участі в
утворенні зв’язків на цьому рівні.
Однак порядок їх розташування
має вирішальне значення для
просторової форми молекули. Дипептид,
який складається з двох різних амінокислот
(А і Б), може мати дві різніпослідовності "АБ" і
"БА". Для трьох амінокислот число
варіантів складає 6. Із 20 різних
амінокислот можна побудувати 10130 різних
послідовностей по 100 залишків в кожній.
Уявимо, що хоч по одній із таких молекул
є в природі. Скручені в
компактні клубочки, вони зайняли
б 1027 (тисяча квадрильйонів) об'ємів
Всесвіту. Зрозуміло, що лише мала частка
можливих комбінацій послідовностей
використовується
природою.
Розшифровка амінокислотної послідовності стала
дуже важливим етапом у вивченнібілків.
Першим дослідженим білком став інсулін
- гормон підшлункової залози (Ф. Сенгер,
1945 – 1954 р.р.). Як показав Сенгер, молекула
бичачого інсуліну, складається з двох
ланцюгів: А (21 амінокислотний залишок)
і В (30 амінокислотних залишків), з’єднаних
між собою дисульфідними містками
між залишками цистеїну. Ще один такий
місток утворюється всередині ланцюга
А:
 Методичні
основи аналізу первинної структури,
розроблені Ф. Сенгером, полягають в
дії на чистий білок різних факторів
(кислот, ферментів), які специфічногідролізують лише
певні пептидні зв'язки (Табл.). В
кожному випадку одержується декілька
пептидів, для яких визначити склад і
послідовність амінокислотних залишків
легше, ніж для великої молекули.
Співставлення послідовностей коротких
фрагментів дозволяє виявити місця
перекривання. N-кінцеві залишки
амінокислот визначаються за
допомогою динітрофторбензолу.
Таблиця
5.3.
Фактори, які викликають специфічний
гідроліз пептидних зв’язків
Методичні
основи аналізу первинної структури,
розроблені Ф. Сенгером, полягають в
дії на чистий білок різних факторів
(кислот, ферментів), які специфічногідролізують лише
певні пептидні зв'язки (Табл.). В
кожному випадку одержується декілька
пептидів, для яких визначити склад і
послідовність амінокислотних залишків
легше, ніж для великої молекули.
Співставлення послідовностей коротких
фрагментів дозволяє виявити місця
перекривання. N-кінцеві залишки
амінокислот визначаються за
допомогою динітрофторбензолу.
Таблиця
5.3.
Фактори, які викликають специфічний
гідроліз пептидних зв’язків
|
Фактор |
Зв’язок -СН(R1)-CO-?-NH-CH(R2)- |
|
Фермент трипсин |
R1 – ліз, арг |
|
Фермент хімотрипсин |
R1 - фен, тир, три |
|
Фермент пепсин |
R2 – фен, три, асп, тир, лей, глу |
|
Бромціан |
R1 - мет |
|
Фермент карбоангідраза |
R2 – С-кінцевий залишок |
Пояснимо цей підхід
на простому прикладі. Нехай при
гідролізі пентапептидуневідомої
будови трипсином (а) і хімотрипсином
(б) одержали два різних набори
фрагментів: а) H2N-лей-фен-глі-СООН і H2N-ала-ліз-СООН; б)
H2N ала-ліз-лей-фен-СООН і глі. Як
видно, спільною послідовністю є
-лей-фен-. Вона не може бути N кінцевою,
так як розташовується в кінці пептиду
(б). Зіставимо результати двох
дослідів:
H2N-ала-ліз-СООН +
H2N-лей-фен-глі-СООН
H2N ала-ліз-лей-фен-СООН
+ глі
Отже, структура пентапептиду
така: H2N ала-ліз-лей-фен-глі-СООН.
Зараз
.первинна структура білків визначається
з використанням автоматичного приладу
- секвенатора, в якому від поліпептидного
ланцюга послідовно відщеплюються
N-кінцеві амінокислоти та ідентифікуються.
Для цього визначення не можна
використовувати реактив Сенгера, так
як при його дії гідролізується весь
ланцюг. Тому застосовують фенілізотіоціанат
(реактив Едмана), який, на відміну від
реактиву Сенгера, дозволяє відщеплювати
послідовно кожну кінцеву амінокислоту
у вигляді фенілтіогідантоїнового
похідного, не руйнуючи всього ланцюга,
і визначати її хроматографічно.
На
наш час з’ясована первинна структура
більше двох тисяч природних білків. При
порівнянні первинних структур гомологічних
білків, тобто тих, які виконують однакові
функції у різних видів організмів,
виявилось, що вони подібні за величною
і в багатьох положеннях містять однакові
(інваріантні) залишки амінокислот. Поряд
з цим, інші залишки (варіабельні) можуть
істотно відрізнятись у різних видів.
Це свідчить про вирішальну роль
інваріантних ділянок для просторової
структури і біологічної функції
білків-гомологів. Крім того, виявилось,
що ступінь відмінності в первинній
структурі гомологічних білків пропорційний
ступеню філогенетичної відмінності
між видами. Таким чином, порівняння
первинної структури гомологічних білків
можна використовувати для побудови
еволюційного дерева, яке відображає
послідовність появи і розвитку організмів
(рис. 5.1.)
Вторинна структура
Вивчення
просторової структури білків стало
можливим завдяки рентгеноструктурному
аналізу. Оскільки білки кристалізуються,
їх підготовка до цього аналізу є значно
простішою, ніж для нуклеїнових кислот.
На
рентгенограмах кристалів білків
спостерігаються спіралізовані ділянки.
Утворення їх можливе завдяки водневим
зв'язкам, які виникають між пептидними
групами: При транс-розташуванні атомів
гідрогену і оксигену в пептидній групі
кожна така група може утворювати по два
водневих зв’язки:
 Вторинна
структура білка -
це регулярна укладка поліпептидного
ланцюга, стабілізована водневими
зв'язками між пептидними групами.
Щільність упаковки цієї структури така
ж, як і у кристалів. Тому білки називають
аперіодичними кристалами. Для різних
білків ступінь і характер спіралізації
відрізняються. Л.Поллінг і Р.Корі. на
підставі власних даних про будову
пептидного зв’язку запропонували у
1951 році дві структурні моделі, які
одержали підтвердження в просторово-структурних
дослідженнях: модель a-спіралі і
b-структури (паралельних і антипаралельних
складчастих шарів). В різних білках було
показано існування одного з цих типів
вторинної структури, або їх
поєднання.
a-спіраль можна уявити як
ланцюг, закручений навколо уявного
циліндра (рис 5.2.). В білках виявлено
правозакручену спіраль. Водневі з’язки
утворюються між пептидними групами
через три залишки, причому кожна пептидна
група утворює по два водневих зв’язки
(за рахунок і оксигену, і гідрогену).
Таким чином a-спіраль вся пронизана
водневими зв’язками. Висота одного
витка спіралі - 0,54 нм і на нього припадає
З,б амінокислотних залишки. В b-структурі
водневі зв’язки утворюються між різними
ланцюгами (паралельний складчастий
шар), або різними ділянками одного
ланцюга (антипаралельний складчастий
шар) (рис. 5.3.)
Величина радикалів,
їх полярність і порядок розташування
визначають особливості спіралізації.
Спіралізація порушується в місцях
поєднання однойменно заряджених або
просторово громіздких радикалів. Так,
a-спіраль стабілізують ала, вал, лей,
фен, три, мет, гіс, глн і дестабілізують
глі, глу, асп, іле, тир, ліз, арг, тре, асн,
сер.
Наявність проліну завжди веде до
переривання спіралі (точка згину), так
як його залишок не містить при атомі
нітрогену гідрогену, здатного утворювати
водневий зв’язок. Для білка сполучної
тканини колагену , в первинній структурі
якого майже кожний третій залишок є
проліном, характерний особливий тип
вторинної структури (колагенова спіраль)
(рис. 5.7.).
b-структуру утворюють
поліпептиди, до складу яких входять, як
правило, неполярні амінокислоти з
невеликими радикалами. Вони не заважають
утворенню шарової структури. В місцях
розташування залишку гліцину, який не
має радикалу, ланцюг може змінювати
напрямок на 180°, що веде до утворення
антипаралельних фрагментів. Спіралізуватись
може до 75% всього поліпептидного
ланцюга.
Для характеристики рівня
структурної організації, що виникає
внаслідок поєднання в білку різних
типів спіралей інколи вводять
термін "зверхвторинна
структура".
Є білки, для яких просторова укладка
закінчується на рівні зверхвторинної
структури. Це нитчасті - фібрилярні
білки (1). Проте більшість білків зазнає
ще більш компактної укладки і набуває
близької до кулястої форми. Такі білки
називаються глобулярними (2):
Вторинна
структура білка -
це регулярна укладка поліпептидного
ланцюга, стабілізована водневими
зв'язками між пептидними групами.
Щільність упаковки цієї структури така
ж, як і у кристалів. Тому білки називають
аперіодичними кристалами. Для різних
білків ступінь і характер спіралізації
відрізняються. Л.Поллінг і Р.Корі. на
підставі власних даних про будову
пептидного зв’язку запропонували у
1951 році дві структурні моделі, які
одержали підтвердження в просторово-структурних
дослідженнях: модель a-спіралі і
b-структури (паралельних і антипаралельних
складчастих шарів). В різних білках було
показано існування одного з цих типів
вторинної структури, або їх
поєднання.
a-спіраль можна уявити як
ланцюг, закручений навколо уявного
циліндра (рис 5.2.). В білках виявлено
правозакручену спіраль. Водневі з’язки
утворюються між пептидними групами
через три залишки, причому кожна пептидна
група утворює по два водневих зв’язки
(за рахунок і оксигену, і гідрогену).
Таким чином a-спіраль вся пронизана
водневими зв’язками. Висота одного
витка спіралі - 0,54 нм і на нього припадає
З,б амінокислотних залишки. В b-структурі
водневі зв’язки утворюються між різними
ланцюгами (паралельний складчастий
шар), або різними ділянками одного
ланцюга (антипаралельний складчастий
шар) (рис. 5.3.)
Величина радикалів,
їх полярність і порядок розташування
визначають особливості спіралізації.
Спіралізація порушується в місцях
поєднання однойменно заряджених або
просторово громіздких радикалів. Так,
a-спіраль стабілізують ала, вал, лей,
фен, три, мет, гіс, глн і дестабілізують
глі, глу, асп, іле, тир, ліз, арг, тре, асн,
сер.
Наявність проліну завжди веде до
переривання спіралі (точка згину), так
як його залишок не містить при атомі
нітрогену гідрогену, здатного утворювати
водневий зв’язок. Для білка сполучної
тканини колагену , в первинній структурі
якого майже кожний третій залишок є
проліном, характерний особливий тип
вторинної структури (колагенова спіраль)
(рис. 5.7.).
b-структуру утворюють
поліпептиди, до складу яких входять, як
правило, неполярні амінокислоти з
невеликими радикалами. Вони не заважають
утворенню шарової структури. В місцях
розташування залишку гліцину, який не
має радикалу, ланцюг може змінювати
напрямок на 180°, що веде до утворення
антипаралельних фрагментів. Спіралізуватись
може до 75% всього поліпептидного
ланцюга.
Для характеристики рівня
структурної організації, що виникає
внаслідок поєднання в білку різних
типів спіралей інколи вводять
термін "зверхвторинна
структура".
Є білки, для яких просторова укладка
закінчується на рівні зверхвторинної
структури. Це нитчасті - фібрилярні
білки (1). Проте більшість білків зазнає
ще більш компактної укладки і набуває
близької до кулястої форми. Такі білки
називаються глобулярними (2):
 Фібрилярні
білки виконують структурні функції,
забезпечують міцність. Вони містять
переважно гідрофобні радикали невеликих
розмірів, які не заважають утворенню
численних поперечних зшивок між
ланцюгами. Це можуть бути водневі зв'язки
між пептидними групами (в b-структурі).
Часто зверхвторинні структури утримуються
більш міцними зв'язками, наприклад,
ковалентними дисульфідними між залишками
цистеїну паралельних a-спіралізованих
ланцюгів (1).
Особливо багато дисульфідних
зв'язків в a-кератинах рогових утворів.
В фібрилярному білку колагені - між
спіралізованими ланцюгами зшивки
утворюються водневими а також ковалентними
зв'язками за рахунок модифікованих
залишків лізину (2). В еластичній сполучній
тканині міститься білок еластин, в якому
поперечні зв’язки між ланцюгами здійснює
десмозин. Він може об’єднувати не два,
а три і чотири ланцюги, утворюючи сітчасту
структуру, яка розтягується у всіх
напрямках. Десмозин утворюється чотирма
радикалами лізину: з відщепленням
частини аміногруп (3):
Фібрилярні
білки виконують структурні функції,
забезпечують міцність. Вони містять
переважно гідрофобні радикали невеликих
розмірів, які не заважають утворенню
численних поперечних зшивок між
ланцюгами. Це можуть бути водневі зв'язки
між пептидними групами (в b-структурі).
Часто зверхвторинні структури утримуються
більш міцними зв'язками, наприклад,
ковалентними дисульфідними між залишками
цистеїну паралельних a-спіралізованих
ланцюгів (1).
Особливо багато дисульфідних
зв'язків в a-кератинах рогових утворів.
В фібрилярному білку колагені - між
спіралізованими ланцюгами зшивки
утворюються водневими а також ковалентними
зв'язками за рахунок модифікованих
залишків лізину (2). В еластичній сполучній
тканині міститься білок еластин, в якому
поперечні зв’язки між ланцюгами здійснює
десмозин. Він може об’єднувати не два,
а три і чотири ланцюги, утворюючи сітчасту
структуру, яка розтягується у всіх
напрямках. Десмозин утворюється чотирма
радикалами лізину: з відщепленням
частини аміногруп (3):
 Третинна
структура
Третинна структура – це
трьохмірна укладка поліпептидного
ланцюга, яка стабілізується
внутрішньомолекулярними взаємодіями
радикалів амінокислотних залишків.
Внаслідок вільного обертання навколо
a-вуглецевих атомів радикали можуть
по-різному орієнтуватись в просторі,
утворюючі зв’язки із спорідненими
групами і забезпечуючи термодинамічно
вигідну укладку молекули.
В глобулярних
білках поліпептидний ланцюг містить
багато гідрофільних полярних радикалів,
які орієнтуються назовні глобули, до
оточуючого водного середовища, утворюючі
водневі зв’язки з молекулами води.
Гідрофобні радикали переважно занурюються
всередину глобули, уникаючи контактів
із водним середовищем, і утворюють між
собою гідрофобні зв’язки. Оскільки
кожний радикал є полярним (гідрофільним)
, або неполярним (гідрофобним), то водневі
і гідрофобні зв’язки відіграють
вирішальну роль в формуванні глобули.
Утворена компактна кулеподібна структура
стабілізується більш міцними йонними
та дисульфідними зв’язками:
Третинна
структура
Третинна структура – це
трьохмірна укладка поліпептидного
ланцюга, яка стабілізується
внутрішньомолекулярними взаємодіями
радикалів амінокислотних залишків.
Внаслідок вільного обертання навколо
a-вуглецевих атомів радикали можуть
по-різному орієнтуватись в просторі,
утворюючі зв’язки із спорідненими
групами і забезпечуючи термодинамічно
вигідну укладку молекули.
В глобулярних
білках поліпептидний ланцюг містить
багато гідрофільних полярних радикалів,
які орієнтуються назовні глобули, до
оточуючого водного середовища, утворюючі
водневі зв’язки з молекулами води.
Гідрофобні радикали переважно занурюються
всередину глобули, уникаючи контактів
із водним середовищем, і утворюють між
собою гідрофобні зв’язки. Оскільки
кожний радикал є полярним (гідрофільним)
, або неполярним (гідрофобним), то водневі
і гідрофобні зв’язки відіграють
вирішальну роль в формуванні глобули.
Утворена компактна кулеподібна структура
стабілізується більш міцними йонними
та дисульфідними зв’язками:

Зв’язки у третинній структурі білка: 1 – водневі, 2 – йонні, 3 – дисульфідні, 4 – гідрофобні. В компактній глобулі поруч опиняються групи, які в поліпептидному ланцюгу розташовані на значній відстані. Вони утворюють області з просторовою і хімічною специфічністю і забезпечують виконання певних функцій молекули. Такі відносно структурно і функціонально автономні фрагменти третинної структури називаютьсядоменами (рис. 5.4.). Домени виділяються при обережному розщепленні білків і зберігають характерні властивості цілого білку. Перша модель третинної структури була створена для міоглобіну кашалота в 1957 році Дж. Кендрю із співробітниками (Англія) і удостоєна Нобелівської премії в 1962 p. Виявилось, що поліпептидний ланцюг міоглобіну, утворений з 153 амінокислотних залишків, має 8 відносно прямолінійних спіралізованих ділянок, розділених між собою згинами (рис 5.5.). Укладка молекули міоглобіну така компактна, що всередині може розміститись лише чотири молекули води. Таким чином, з усіх можливих конформацій внаслідок вільного обертання амінокислотних радикалів і транс-розташування атомів в пептидних групах, поліпептидний ланцюг укладається в енергетично найбільш вигідну, найменш напружену. Для кожного індивідуального ланцюга з певною амінокислотною послідовністю в фізіологічних умовах клітини реалізується лише одна конформація, в якій він проявляє біологічну активність. Отже просторова форма білкових молекул однозначно визначається їх первинною структурою. Значення способу укладки поліпептидного ланцюга яскраво проявляється на прикладі відкриття молекулярної мішені сметрельної хвороби коров’ячого сказу – інфекційної енцефалопатії, яка проявляється через віддалений час (більше року) після ураження і не має видових бар’єрів. Доведено (Prusiner at.al., 1982), що збудник хвороби має унікальну природу – це білок, названий “пріон”, який складається лише з одного поліпептидного ланцюга (Mr – 27 – 30 кД). Білок з ідентичною первинною структурою закодований в нормальному генотипі і повсемісно знайдений в досліджуваних організмах. Відмінність між нормальним білком і пріоном виявляється на рівні просторової структури. Дослідження, проведені в 1990 – 1993 р.р.(Pan et al), показали, що нормальний білок має енергетично вигідну конформацію, в якій на ?-спіраль припадає біля 40% ланцюга, а на ?-антипаралельні складки – лише 7% (всього 8 залишків в двох коротких фрагментах), тоді як молекула пріону на 50% утворена ?-структурою і тільки на 20% - ?-спіраллю. Відповідно нормальний білок є розчинним, а його токсичний варіант нерозчинний і утворює аморфні агрегати. Незрозуміло, чому токсичність пріону проявляється саме у центральній нервовій системі, тоді як нормальний аналог поширений повсемісно, які причини і механізм трансформації білка. На даному етапі можна лише узагальнити, що сучасні методи дослідження дозволили відкрити принципово новий механізм перенесення інфекції, який може бути застосований до хвороб, відомих досить довгий час.
Гомологічні білки, які виконують однакову функцію у різних організмів, дещо відрізняють
за
амінокислотним складом. Однак, як
правило, ці відмінності не позначаються
на характері зв’язків і тому вони мають
однакову доменну будову.
Однак, є
випадки, коли заміна лише одного залишку
у великій молекулі істотно позначається
на її функції. Наприклад, у хворих на
серповидноклітинну анемію, при якій
еритроцити крові мають неправильну
форму, що приводить до порушення
кровопостачання, причиною аномалії є
заміна в молекулі гемоглобіну: в двох
b-ланцюгах негативно зарядженого залишку
глутамінової кислоти в положенні № 6
на гідрофобний залишок валіну. Ця
аномалія є результатом мутації і
передається по спадковості.
Існування
чисельних амінокислотних послідовностей
в природі визначає різноманітність
форм білкових молекул. Таким чином, вже
на найнижчому рівні організації -
молекулярному - обумовлюється морфологічна
багатоманітність форм.
Укладка
поліпептидного ланцюга в просторову
структуру відбувається дуже швидко.
Якби поліпептид із ста амінокислотних
залишків згортався в просторі шляхом
“проб і помилок”, це зайняло би не менш,
ніж 1050 років. В дійсності час укладки
такої молекули при 370 становить біля
п’яти секунд.
Четвертинна структура
Велика
кількість білків складається більше,
як з одного поліпептидного ланцюга.
Четвертинна структура характеризує
спосіб об’єднання поліпептидних
ланцюгів в молекулі такого білку.
Наявність четвертинної структури у
того чи іншого білка можна прогнозувати
за його кількісним складом. Як правило,
окремі поліпептидні ланцюги містять
від 100 до 300 залишків амінокислот і мають
молекулярну масу 12000 - 36000. Якщо молекулярна
маса більша 50000, то можна вважати, що
білок складається з декількох
поліпептидів.
Білки, які мають
четвертинну структуру, називаються
олігомерами або мультимерами, а ланцюги,
з яких вони утворені, - протомерами або
субодиницями.
Вперше четвертинна
структура була встановлена для білка
гемоглобіну на основі рентгеноструктурного
аналізу М. Перутцем та співробітниками
(Англія). Робота тривала біля 25 років і
була удостоєна Нобелівської премії у
1962 p.
Гемоглобін складається з чотирьох
субодиниць (рис. 5.6.). Кожна субодиниця
утворена поліпептидним ланцюгом і
залізопорфіриновим комплексом. Ланцюги
попарно однакові: два a- , які складаються
з 141 амінокислотного залишка і два
b-ланцюги – з 146 залишків. Кожний ланцюг
має третинну структуру, подібну до
міоглобіну. Ланцюги об’єднуються
попарно, утворюючи контакти за рахунок
переважно гідрофобних радикалів.
Багато
олігомерів складається з двох - дванадцяти
ланцюгів. Однак відомі і значно більші
молекули - білок вірусу тютюнової мозаїки
містить біля 2200 поліпептидних
ланцюгів.
Четвертинну структуру мають
білки, які виконують складні біологічні
функції і активність яких залежить від
дії регулюючих факторів. Відокремлені
ланцюги таких білків втрачають свою
функцію, або систему її регуляції. Отже,
олігомерні білки мають кооперативну
узгодженість дії окремих протомерів.
Таким
чином, порядок утворення білкової
глобули можна уявити схематично так:
первинна структура ® вторинна структура
(a-спіралі і b-складчасті шари) ®
зверхвторинна структура (суперспіраль,
система регулярно розташованих шарів)
® домен (автономна компактна система,
яка об’єднує декілька сусідніх
структурних сегментів) ® третинна
структура ® четвертинна структура.
Багато білків функціонують лише в складі
надмолекулярних комплексів з іншими
білками, ліпідами, мембранами. Тому
деякі автори виділяють п"ятеринну
структуру білка як спосіб його включення
в надмолекулярні структури.
Фізико-хімічні
властивості білків
Властивості білків
визначаються хімічним складом, розмірами
і формою молекули. Білки мають молекулярну
масу від
6 тисяч до мільйону і більше (для
6ілків-олігомерів).
Розчинність.
Фібрилярні білки не розчиняються у
воді, так як містять переважно гідрофобні
радикали, рівномірно розташовані вздовж
витягнутої молекули. Глобулярні білки
утворюють гідрофільні колоїди з розміром
частинок 1-100 нм, в яких молекули води
оточують глобули гідратними оболонками
і взаємодіють з полярними групами на
їх поверхні.
Дія дегідратуючих речовин
порушує стабільність білкових колоїдів
і викликає їх коагуляцію. Тому, наприклад,
вживання алкоголю приводить до порушення
функцій ферментів травного тракту.
Нейтральні солі у великих концентраціях
також викликають коагуляцію білкових
колоїдів та їх осадження (висолювання
білків).
Внаслідок великого розміру
білкові молекули не проходять через
напівпроникні мембрани. Це дозволяє
очистити білок від низькомолекулярних
домішок. Суміш в мішечку з напівпроникною
оболонкою поміщають в посудину з
проточною водою і витримують у ньому
протягом кількох діб. Цей метод
називається діалізом.
Молекули
білка мають заряд,
який визначається кількістю дисоційованих
амінокислотних радикалів при певному
рН. Значення рН, при якому сумарний заряд
білкової молекули дорівнює нулю,
називається ізоелектричною
точкою білка
(рІ), а відповідний стан білка
- ізоелектричним
станом. В
ізоелектричному стані молекули білка
найлегше злипаються - коагулюють.
В
більшості біологічних рідин підтримується
рН біля 7. В цьому діапазоні йонізовані
всі амінокислотні радикали кислотного
і основного типу. Навіть невеликі зміни
рН істотно впливають на ступінь їх
йонізації, а отже, на зв’язки, які вони
утворюють і, як наслідок, на функцію
білків. Наприклад, при пониженні рН на
0,5 одиниць послаблюється сила скорочень
м’язових білків, гемоглобін втрачає
здатність зв’язувати кисень.
Властивість
білкових молекул зв’язувати йони
гідрогену робить їх найбільш важливими
буферними системами організмів. За
фізіологічних значень рН найбільш
ефективно протидіють зміні кислотності
радикали гістидину, так як їх рК близьке
до 7:
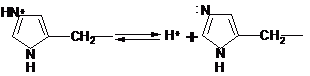 Жоден
інший амінокислотний радикал не підходить
на цю роль. Гемоглобін крові зв’язує
за рахунок гістидинових радикалів біля
20 % загальної кількості йонів водню, які
поступають в кров.
Суміш різних білків
можна розділити в електричному полі за
напрямком і швидкістю переміщення
молекул з різним зарядом. Цей метод
називається електрофорезом.
При
повільному концентруванні білки
утворюють кристали характерної форми.
Цю властивість використовують для
виділення індивідуальних білків.
Наявність
реакційно здатних функціональних груп,
стабілізація просторової структури
слабкими взаємодіями, а також великі
розміри молекул роблять білки дуже
чутливими до дії зовнішніх факторів.
Порушення унікальної природної
конформації молекули, що відбувається
внаслідок розриву нековалентних зв’язків
і приводить до втрати біологічної
активності, називається денатурацією.
Розглянемо
дію головних денатуруючих факторів.
Вплив
температури. Білки
переважно втрачають свою конформацію
при температурі вище 50-60°С, хоч відомі
термофільні бактерії, білки яких
витримують і вищі температури. Найбільш
чутливі до підвищення температури
водневі зв’язки. При температурі нижче
25° послаблюються гідрофобні взаємодії.
В межах фізіологічних температур зміна
просторової структури приводить лише
до зміни біологічної активності, а не
до її втрати. Особливу чутливість до
зміни температури проявляє білок
сполучної тканини колаген, який
денатурує при температурі на 20-30° меншій,
ніж більшість білків, і лише на 1-2° вищій
від температури тіла. Колаген дощових
черв’яків, які живуть при 20°С, денатурує
при 22°С, колаген коропа з теплих водойм
(температура води 28 – 300 С) - при
29-32°С. Така подібність температури
тіла і денатурації колагену має
пристосувальне значення. Стан молекул
на межі денатурації полегшує розщеплення
їх в процесі обміну і покращує їх
взаємодію при утворенні фібрил та їх
скороченні.
Денатуровані білки,
втрачаючи впорядковану будову, зменшують
розчинність у воді, так як збільшується
кількість гідрофобних радикалів, які
контактують з водним оточенням (на схемі
O – гідрофільні, а V – гідрофобні
радикали):
Жоден
інший амінокислотний радикал не підходить
на цю роль. Гемоглобін крові зв’язує
за рахунок гістидинових радикалів біля
20 % загальної кількості йонів водню, які
поступають в кров.
Суміш різних білків
можна розділити в електричному полі за
напрямком і швидкістю переміщення
молекул з різним зарядом. Цей метод
називається електрофорезом.
При
повільному концентруванні білки
утворюють кристали характерної форми.
Цю властивість використовують для
виділення індивідуальних білків.
Наявність
реакційно здатних функціональних груп,
стабілізація просторової структури
слабкими взаємодіями, а також великі
розміри молекул роблять білки дуже
чутливими до дії зовнішніх факторів.
Порушення унікальної природної
конформації молекули, що відбувається
внаслідок розриву нековалентних зв’язків
і приводить до втрати біологічної
активності, називається денатурацією.
Розглянемо
дію головних денатуруючих факторів.
Вплив
температури. Білки
переважно втрачають свою конформацію
при температурі вище 50-60°С, хоч відомі
термофільні бактерії, білки яких
витримують і вищі температури. Найбільш
чутливі до підвищення температури
водневі зв’язки. При температурі нижче
25° послаблюються гідрофобні взаємодії.
В межах фізіологічних температур зміна
просторової структури приводить лише
до зміни біологічної активності, а не
до її втрати. Особливу чутливість до
зміни температури проявляє білок
сполучної тканини колаген, який
денатурує при температурі на 20-30° меншій,
ніж більшість білків, і лише на 1-2° вищій
від температури тіла. Колаген дощових
черв’яків, які живуть при 20°С, денатурує
при 22°С, колаген коропа з теплих водойм
(температура води 28 – 300 С) - при
29-32°С. Така подібність температури
тіла і денатурації колагену має
пристосувальне значення. Стан молекул
на межі денатурації полегшує розщеплення
їх в процесі обміну і покращує їх
взаємодію при утворенні фібрил та їх
скороченні.
Денатуровані білки,
втрачаючи впорядковану будову, зменшують
розчинність у воді, так як збільшується
кількість гідрофобних радикалів, які
контактують з водним оточенням (на схемі
O – гідрофільні, а V – гідрофобні
радикали):
 Таке
явище ми спостерігаємо, наприклад, при
варінні яєць.
Вплив
рН середовища. При
екстремальних значеннях рН білки
денатурують внаслідок зміни заряду
функціональних груп. Однак осадження
білку при цьому не спостерігається,
оскільки молекули мають значний
однойменний заряд і взаємно
відштовхуються.
Денатуруючу дію на
білки мають також деякі речовини з тих,
що утворюють з ними солі. Це трихлороцтова
та хлорна кислоти, катіони важких металів
(Pb2+, Cu2+ та інші). При їх дії спостерігається
осадження білків.
При денатурації
первинна структура білків не порушується
і в деяких випадках денатурований білок
відтворює свого природну конформацію
- відбувається ренатурація. Отже
денатурація може бути необоротна і
оборотна.
5.5. Класи білків.
Структурно-функціональна характеристика
окремих представників
За складом
білки поділяють на прості,
які складаються лише з амінокислотнїних
залишків, і складні, які
містять, крім білка, компонент небілкової
природи.
Серед простих білків виділяють
групи, представники яких мають подібний
склад, молекулярну масу, властивості і
функцію: альбуміни, глобуліни, гістони,
протаміни тощо.
Складні білки поділяють
на групи залежно від природи їх небілкової
частини:
глікопротеїни -
багато білків сполучної тканини, крові,
зовнішньої поверхні клітинних
мембран;
ліпопротеїни –
форма транспорту ліпідів в крові,
інтегральні білки мембран,
нуклеопротеїни -
хромосоми, рибосоми;
фосфопротеїни -
поживний білок молока казеїн;
металопротеїни -
містять безпосередньо атоми металу, а
не металоорганічні комплекси типу гему.
До них належать металоферменти, форми
запасання і транспорту металу феритин
(Fe), церулоплазмін (Cu), металотіонеїн
(Zn, Cu, Cd));
хромопротеїни –
містять забарвлену органічну групу
(гем, рибофлавін).
Особливості хімічного
складу і будови білків реалізуються у
виконанні ними певних біологічних
функцій. З’ясуємо цю залежність на
прикладі окремих функцій білків.
Структурні
білки. Колаген є у всіх багатоклітинних
організмах, крім рослин. У людини на
його долю припадає біля 5 % маси тіла і
третина маси всіх білків організму. Це
позаклітинний білок з унікальними
властивостями. Його молекула витримує
навантаження, вага якого в десятки тисяч
разів більша від ваги білкової молекули.
Тобто ці молекули міцніші, ніж сталевий
дріт. Колаген бере участь у формуванні
організму. Він визначає напрямок і
швидкість росту клітинних елементів у
організмі під час його росту і зберігає
та підтримує набуту форму протягом
життя.
Колаген має особливу структуру,
яка не зустрічається в інших білках. В
його поліпептидному ланцюгу майже
кожний третій залишок - це гліцин. Також
багато проліну і оксипроліну (останній
не зустрічається більше ні в яких
білках). В колагені також міститься
лізин та його модифікація
оксилізин:
Таке
явище ми спостерігаємо, наприклад, при
варінні яєць.
Вплив
рН середовища. При
екстремальних значеннях рН білки
денатурують внаслідок зміни заряду
функціональних груп. Однак осадження
білку при цьому не спостерігається,
оскільки молекули мають значний
однойменний заряд і взаємно
відштовхуються.
Денатуруючу дію на
білки мають також деякі речовини з тих,
що утворюють з ними солі. Це трихлороцтова
та хлорна кислоти, катіони важких металів
(Pb2+, Cu2+ та інші). При їх дії спостерігається
осадження білків.
При денатурації
первинна структура білків не порушується
і в деяких випадках денатурований білок
відтворює свого природну конформацію
- відбувається ренатурація. Отже
денатурація може бути необоротна і
оборотна.
5.5. Класи білків.
Структурно-функціональна характеристика
окремих представників
За складом
білки поділяють на прості,
які складаються лише з амінокислотнїних
залишків, і складні, які
містять, крім білка, компонент небілкової
природи.
Серед простих білків виділяють
групи, представники яких мають подібний
склад, молекулярну масу, властивості і
функцію: альбуміни, глобуліни, гістони,
протаміни тощо.
Складні білки поділяють
на групи залежно від природи їх небілкової
частини:
глікопротеїни -
багато білків сполучної тканини, крові,
зовнішньої поверхні клітинних
мембран;
ліпопротеїни –
форма транспорту ліпідів в крові,
інтегральні білки мембран,
нуклеопротеїни -
хромосоми, рибосоми;
фосфопротеїни -
поживний білок молока казеїн;
металопротеїни -
містять безпосередньо атоми металу, а
не металоорганічні комплекси типу гему.
До них належать металоферменти, форми
запасання і транспорту металу феритин
(Fe), церулоплазмін (Cu), металотіонеїн
(Zn, Cu, Cd));
хромопротеїни –
містять забарвлену органічну групу
(гем, рибофлавін).
Особливості хімічного
складу і будови білків реалізуються у
виконанні ними певних біологічних
функцій. З’ясуємо цю залежність на
прикладі окремих функцій білків.
Структурні
білки. Колаген є у всіх багатоклітинних
організмах, крім рослин. У людини на
його долю припадає біля 5 % маси тіла і
третина маси всіх білків організму. Це
позаклітинний білок з унікальними
властивостями. Його молекула витримує
навантаження, вага якого в десятки тисяч
разів більша від ваги білкової молекули.
Тобто ці молекули міцніші, ніж сталевий
дріт. Колаген бере участь у формуванні
організму. Він визначає напрямок і
швидкість росту клітинних елементів у
організмі під час його росту і зберігає
та підтримує набуту форму протягом
життя.
Колаген має особливу структуру,
яка не зустрічається в інших білках. В
його поліпептидному ланцюгу майже
кожний третій залишок - це гліцин. Також
багато проліну і оксипроліну (останній
не зустрічається більше ні в яких
білках). В колагені також міститься
лізин та його модифікація
оксилізин:
 оксипролін
оксилізин
Первинну структуру цього
білка можна записати так: - (-глі-Х-У-)n -,
де Х - найчастіше пролін, а У - оксипролін.
Ланцюг колагену закручується в спіраль,
на кожен виток якої припадає три
амінокислотних залишки. Таку спіраль
називають малою. Мала спіраль скручується
у велику, на виток якої припадає 30
амінокислотних залишків. Три великі
паралельні спіралі утворюють суперспіраль,
в якій вони щільно упаковані одна
відносно одної навколо спільної осі
(рис 5.7.)
Паралельні ланцюги з’єднуються
між собою водневими зв’язками і хімічно
модифікованими залишками лізину. Кінці
поліпептидних ланцюгів відрізняються
складом від основної частини, вони не
спіралізовані, тому молекула нагадує
за формою гантель з витягнутою центральною
частиною і кулястими кінцями.
Молекули
укладаються в пучки із зміщеними
ступінчасто головками ("голова до
хвосту") вздовж фібрили (рис. 5.7.). Між
молекулами також утворюються міцні
поперечні зшивки. Завдяки цим зшивкам
і скрученості спіралі фібрили колагену
деформуються. Оксилізин, як складник
колагену, може сполучатись із залишками
вуглеводів (гексоз). За рахунок оксипроліну
на поверхні колагену фіксуються молекули
води, які утворюють тримірний каркас.
Фібрили об’єднуються у волокна, які
укладаються по-різному в різних тканинах
і у різних організмів. При старінні
організму кількість поперечних зшивок,
а отже, і жорсткість структури колагену,
зростає. Це погіршує якість сполучної
тканини, наприклад, робить більш ламкими
кістки, менш прозорою рогівку ока.
При
кип’ятінні м’язової тканини (м’яса)
частина пептидних зв’язків у колагені
піддається гідролізу. При цьому
утворюється суміш пептидів, що називається
желатином. Тривалість приготування
м’ясних страв визначається умовами
руйнування волокон колагену.
При
розгляді вторинної структури білків
згадувались і інші структурні білки. В
таблиці 5.4. узагальнені дані про їх
структуру та властивості.
оксипролін
оксилізин
Первинну структуру цього
білка можна записати так: - (-глі-Х-У-)n -,
де Х - найчастіше пролін, а У - оксипролін.
Ланцюг колагену закручується в спіраль,
на кожен виток якої припадає три
амінокислотних залишки. Таку спіраль
називають малою. Мала спіраль скручується
у велику, на виток якої припадає 30
амінокислотних залишків. Три великі
паралельні спіралі утворюють суперспіраль,
в якій вони щільно упаковані одна
відносно одної навколо спільної осі
(рис 5.7.)
Паралельні ланцюги з’єднуються
між собою водневими зв’язками і хімічно
модифікованими залишками лізину. Кінці
поліпептидних ланцюгів відрізняються
складом від основної частини, вони не
спіралізовані, тому молекула нагадує
за формою гантель з витягнутою центральною
частиною і кулястими кінцями.
Молекули
укладаються в пучки із зміщеними
ступінчасто головками ("голова до
хвосту") вздовж фібрили (рис. 5.7.). Між
молекулами також утворюються міцні
поперечні зшивки. Завдяки цим зшивкам
і скрученості спіралі фібрили колагену
деформуються. Оксилізин, як складник
колагену, може сполучатись із залишками
вуглеводів (гексоз). За рахунок оксипроліну
на поверхні колагену фіксуються молекули
води, які утворюють тримірний каркас.
Фібрили об’єднуються у волокна, які
укладаються по-різному в різних тканинах
і у різних організмів. При старінні
організму кількість поперечних зшивок,
а отже, і жорсткість структури колагену,
зростає. Це погіршує якість сполучної
тканини, наприклад, робить більш ламкими
кістки, менш прозорою рогівку ока.
При
кип’ятінні м’язової тканини (м’яса)
частина пептидних зв’язків у колагені
піддається гідролізу. При цьому
утворюється суміш пептидів, що називається
желатином. Тривалість приготування
м’ясних страв визначається умовами
руйнування волокон колагену.
При
розгляді вторинної структури білків
згадувались і інші структурні білки. В
таблиці 5.4. узагальнені дані про їх
структуру та властивості.
