
методичка
.pdf
При наличии в осадке (полученном при действии на раствор группового реагента - НС1) катионов Hg22+ добавление NH3-H2O вызывает почернение осадка вследствие образования ртути:
Анализ смеси катионов II аналитической группы.
Из растворов эта группа выделяется с помощью разбавленной серной кислоты. Берут 30 капель исследуемого раствора, приливают 20 капель 1N раствора H2SO4. Наличие белого осадка свидетельствует о присутствии в растворе катионов данной группы. Центрифугированием разделяют осадок и раствор, центрифугат проверяют на полноту осаждения.
Так как сульфаты практически не растворяются в кислотах и щелочах, их переводят в карбонаты. К осадку добавляют большой избыток насыщенного раствора карбоната натрия и кипятят 30 минут. Полученный осадок карбонатов промывают холодной водой до нейтральной реакции центрифугата, растворяют в 2N растворе уксусной кислоты и в растворе открывают катионы II аналитической группы.
Берут 6-7 капель полученного раствора, приливают 4-5 капель раствора ацетата натрия для поддержания определенного значения рН, затем 5-6 капель дихромата калия. В присутствии катиона Ва2+ выпадает светло-желтый осадок хромата бария:
Катион Ва2+ мешает обнаружению катионов Са2+ и Sr2+ , поэтому от него освобождаются, добавляя к центрифугату избыток дихромата калия в присутствии ацетата натрия. Осадок отделяют, центрифугат проверяют на полноту осаждения. В свободном от катионов Ва2+ центрифугате открывают катионы Са2+ и Sr2+. Для этого делят центрифугат на две части, в одной определяют катионы Са2+, в другой Sr2+. Для определения катиона Sr2+ в пробирку приливают гипсовую воду ( насыщенный раствор CaSO4), кипятят
раствор в течении 20 минут. Так как, ПРSrSO4 <ПРCASO4 , то при наличии Sr2+ образуется белый осадок SrSO4:
Катион Sr2+ можно обнаружить, используя реакцию окрашивания пламени горелки в карминово-красный цвет.
При обнаружении катионов Sr2+, от них освобождаются, так как они мешают открытию Са2+. Для этого ко второй части центрифугата приливают раствор сульфата аммония, выпавший осадок отделяют, в центрифугате определяют присутствие катиона Са2+ с помощью оксалата аммония или гексацианоферрата (II) калия. В обоих случаях образуются белые осадки, растворимые в соляной и азотной кислотах:
Анализ смеси катионов III аналитической группы.
11

Групповым реагентом этой группы катионов являются щелочи, образующие гидроксиды, растворимые в избытке реактива.
Ход анализа катионов этой группы распадается на три стадии: Выделение и определение катионов А13+ и Sn2+.
Выделение и открытие катионов Zn2+. Открытие катионов Cr3+, As3+.
К 20 каплям исследуемого раствора, оставшегося после отделения I и II групп, приливают такое же количество 25% раствора аммиака и 10% раствора пероксида водорода:
Осадок А1(ОН)з и Sn(OH)4 отделяют центрифугированием. Центрифугат пипеткой, переносят в чистую пробирку и оставляют для дальнейшего исследования, а осадок растворяют в 2N растворе соляной кислоты и, разделив на две части, открывают А13+ и Sn4+. Al3+ открывают капельной реакцией с ализарином (1,2 диоксиантрахинон); на полоску фитровальной бумажки наносят 3-4 капли раствора, 1-2 минуты держат над открытой склянкой с концентрированным раствором аммиака для осаждения гидроксида аммония. На полученное пятно наносят каплю спиртового раствора ализарина - получают красно-фиолетовое окрашивание. Далее подсушивают бумажку над пламенем горелки (осторожно, чтобы не сжечь). Появление розово-красного пятна говорит о присутствии катиона А13+. Катион Sn4+ открывают, восстановив его до Sn2+ : к раствору, содержащему Sn4+, приливают 4 капли 2N раствора соляной кислоты, бросают в раствор порошок металлического Mg (на кончике шпателя), нагревают на водяной бане в течении 4-5 минут. К полученному раствору приливают 7-8 капель 2N раствора NaOH:
При наличии осадка смесь отцентрифугировать. В центрифугате содержится тетрагидроксостаннат(П) натрия. Берут 5-6 капель центрифугата, приливают такое же количество нитрата висмута (III). В присутствии Sn2+ выпадает черный осадок висмута:
Катион Sn + определяется в исходном растворе этим же способом до начала осаждения катионов.
Далее анализируют центрифугат, содержащий анионы CrO42-, AsO43- и катион [Zn(NH3)4]2+. Для этого его нейтрализуют 2N раствором уксусной кислоты до
12

нейтральной реакции, нагревают на водяной бане в течение 3-5 минут, добавляют 5-6 капель насыщенного раствора Na2CO3 для осаждения катиона Zn2+ в виде основного карбоната:
Полученный осадок отделяют центрифугированием и растворяют в нескольких каплях 2N раствора уксусной кислоты. В полученном растворе катион цинка можно обнаружить реакциями с серовоодородной водой или гексацианоферратом (II) калия: берут 6-7 капель раствора, содержащего основной карбонат цинка, приливают 3 капли раствора ацетата натрия (для создания нейтральной или слабощелочной среды) и приливают 2-3 капли реагента. Выпадение белого осадка говорит о наличии катиона Zn2+.
Центрифугат, оставшийся после отделения основного карбоната цинка, может содержать хромат и арсенат-ионы. Для открытия катиона Сг3+ к 6 каплям центрифугата приливают такое же количество 10% раствора пероксида водорода, 3 капли концентрированного раствора серной кислоты, 3 капли смеси изоамилового спирта с эфиром, быстро взбалтывают. Если верхний слой окрашивается в синий цвет, значит в исследуемом растворе присутствуют катионы Сг3+:
Надо иметь в виду, что данная реакция протекает только в кислой среде при рН=2-3.
Пероксид хрома CrO5 и надхромовая кислота Н2СrО6 в водных растворах неустойчивы, поэтому реакцию проводят в присутствии смеси эфира со спиртом.
Далее открывают катионы As3+, которые находятся в растворе в виде AsO43-- иона.
В пробирку помещают приблизительно 2г металлического цинка, приливают 5мл 5N раствора соляной кислоты и 10 капель оставшегося центрифугата. Отверстие пробирки закрывают фильтрованой бумагой, пропитанной 0,IN раствором нитрата серебра. При наличии ионов AsO43-появляется черное пятно:
Анализ смеси катионов IV аналитической группы.
В отдельных пробах анализируемого раствора открывают катионы Fe2+ и Fe3+ : в две пробирки берут по 5 капель исследуемого раствора, в одну
13

приливают 2 капли гексацианоферрат (Ш) калия, в другую - гексацианоферрат (II) калия.
-в присутствии катиона Fe2+ образуется темно-синий осадок «турнбуллева синь».
-в присутствии катиона Fe3+ образуется темно-синий осадок «берлинская
лазурь».
Специфической реакцией на катион Fe3+ является реакция с роданидом калия
(или аммонием). Берут три капли исследуемого раствора, приливают две капли роданида калия (или аммония). В присутствии катиона Fe3+ образуется кроваво-красное окрашивание:
Далее проводят определение катионов Bi3+ и Sb3+ ; берут 10-12 капель исследуемого раствора, разводят в 5 раз дистиллированной водой. Появление белого осадка основных солей, образовавшихся в результате гидролиза, свидетельствует о присутствии данных катионов. Раствор центрифугируют, осадок оставляют, центрифугат переносят в другую пробирку и сохраняют. Осадок обрабатывают раствором винной кислоты, в которой растворяются основные соли сурьмы, в осадке остаются .-основные соли висмута. Раствор центрифугируют, центрифугат переносят в чистую пробирку, приливают к нему 5 капель раствора тиосульфата натрия. Появление красного осадка говорит о наличии катиона Sb3+ :
Осадок, содержащий соли Bi3+ , растворяют в концентрированной соляной кислоте, берут 6-7 капель раствора, приливают 3 капли раствора KJ. В присутствии катиона Bi3+ образуется черный осадок BiJ3, который растворяется в избытке иодида калия с образованием тетраиодовисмутата (III) калия оранжевого цвета:
Центрифугат, освобожденный от ионов сурьмы и висмута, обрабатывают раствором 2N NaOH до слабощелочной реакции, добавляют 10-12 капель 10% раствора пероксида водорода, нагревают и отделяют осадок. Осадок обрабатывают хлоридом аммония (берут на кончике шпателя) для отделения солей Mg2+. Раствор центрифигируют, центрифугат отделяют и в нем определяют наличие катиона Mg2+. К шести-семи каплям центрифугата прилить такое же количество насыщенного раствора гидрофосфата натрия Na2HPO4 и 2N раствора соляной кислоты и медленно, по капле, 2N раствора аммиака до образования кристаллического белого осадка
14

Mg(NH4)PO4 (HC1 добавляется для растворения осадка, образующегося до прибавления раствора аммиака):
Далее осадок, оставшийся после отделения катионов Mg2+, растворяют в 2N растворе соляной кислоты и в растворе открывают катион Мn2+ : берут 1 мл 50% раствора персульфата аммония (раствор можно заменить кристаллами), приливают 8-10 капель 2N раствора азотной кислоты и 4-5 капель раствора нитрата серебра. Смесь нагревают почти до кипения, но не кипятят. В горячий раствор добавляют 6-8 капель раствора, содержащего катионы Мп2+, и нагревают 2 минуты при температуре 50°С.
В присутствии катиона Мп2+ получается розовая окраска раствора вследствие образования марганцевой кислоты:
Анализ смеси катионов V аналитической группы.
Катионы данной группы образуют гидроксиды, растворимые в кислотах, в избытке аммиака, но не растворимые в щелочах. Анализ смеси катионов можно провести дробным путем. В отдельных порциях раствора открывают:
1.Катион Сu2+ — к 4-5 каплям раствора прилить 2-3 капли 2N раствора
аммиака. К образовавшейся суспензии добавтть еще несколько капель раствора аммиака. В присутствии катиона Сu2+ появляется интенсивная темносиняя окраска раствора:
2.Катион Cd2+ — сероводород осаждает этот ион из нейтральных и слабо кислых растворов в виде желтого осадка сульфида кадмия. Проверить рН раствора. Если значение рН лежит в пределах 6-8, взять 4-5 капель исследуемого раствора, прилить 2-3 капли свежеприготовленной
сероводородной воды. Выпадение желтого осадка говорит о присутствии
Cd2+:
3. Катион Hg2+ открывают реакцией с иодидом калия - к 4-5 каплям исследуемого раствора приливают 3-4 капли раствора иодида калия. Выпадение красного осадка, а затем его растворение в избытке KJ и
получение прозрачного бесцветного раствора говорит о наличии катиона Hg2+:
4. Катион Со2+ открывают реакцией с роданидом калия или аммония: к 4-5 каплям исследуемого раствора KCNS или NH4CNS приливают 1мл насыщенного раствора KCNS или NH4CNS в ацетоне. В присутствии катиона
15
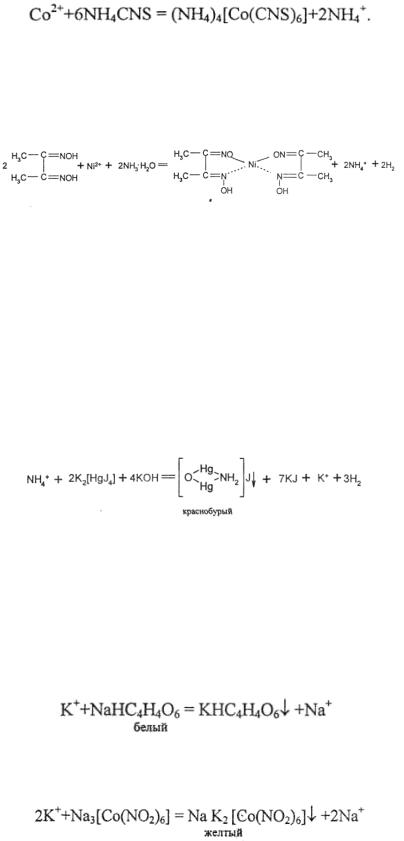
Со2+ образуется гексароданидокобальтат (II) аммония или калия, устойчивый в 50% растворе ацетона или в смеси амилового спирта с эфиром.
5. Катион Ni2+ открывают реакцией с диметилглиоксимом (реактив Чугаева) к 4-5 каплям исследуемого раствора приливают такое же количество 1% спиртового раствора диметилглиоксима и раствор 2N аммиака до слабощелочной реакции. В присутствии Ni2+ образуется ало-красный диметилглиоксимат никеля:
Открытию Ni2+ мешают катионы Fe2+ и Fe3+. Поэтому при обнаружении последних, их переводят в гидроксиды, а образовавшийся гидроксид никеля переводят в раствор, используя раствор аммиака.
Анализ смеси катионов VI аналитической группы.
Группа не имеет группового реагента, большинство соединений катионов Na+,K+, NH4+ хорошо растворяются в воде.
Сначала открывают катион аммония, т.к. он с катионом калия дает аналогичные реакции. К 4-5 каплям исследуемого раствора приливают 5-8 капель дистиллированной воды и 3-4 капли реактива Несслера (смесь тетраиодогидраргирумата (II) калия с гидроксидом калия), в присутствии катиона аммония выпадает красно-бурый осадок:
Если в растворе будут обнаружены катионы аммония, от них освобождаются, упаривая часть раствора. Полноту удаления катиона аммония проверяют реактивом Несслера.
После удаления катиона аммония открывают катион калия: к 4-5 каплям раствора приливают такое же количество раствора гидротартрата натрия. Для ускорения процесса кристаллизации следует раствор тщательно перемешать, потирая стеклянной палочкой о стенку пробирки. Выпадение белого осадка говорит о присутствии катиона К+:
Можно использовать для этой же цели гексанитритокобальтат (III) натрия, который с катионом К+ образует желтый осадок, хорошо растворимый в кислотах и щелочах:
Анализ смеси анионов.
16

Для анализа смеси анионов существуют разнообразные классификации, основанные на реакциях осаждения, разложения, комплексообразования, окисления — восстановления. Анионы делятся на 3; 5 и более аналитических групп. В настоящем пособии рассматривается метод разделения анионов на три аналитические группы, использующий различную растворимость солей бария и серебра.
I.Анализ смеси анионов I аналитической группы.
Вначале проводят пробу на присутствие анионов данной группы: к 4-5 каплям нейтрального или слабощелочного раствора прибавляют такое же количество раствора хлорида бария. Выпадение белого осадка свидетельствует о наличии анионов данной группы. Далее делают анализ анионов этой группы:
1а. Обнаружение сульфат-иона: к 4 каплям исследуемого раствора прилить такое же количество раствора хлорида бария. Содержимое пробирки отцентрифугировать. К осадку прилить 4 капли разбавленного раствора хлороводородной кислоты. Если осадок не растворился, значит в растворе присутствует анион SO42-.
1б. Можно проделать аналогичную реакцию с ацетатом свинца, который в присутствии SO42--иона образует белый осадок сульфата свинца, растворимый в щелочах и ацетате аммония:
2а. Обнаружение сульфит - иона. Бромная и йодная вода в присутствии SO32-- иона обесцвечиваются. Реакцию следует проводить в слабокислом растворе. В пробирку поместить 4-5 капель йодной или бромной воды, 2-3 капли хлороводородной кислоты до создания слабокислой среды и прилить 4-5 капель исследуемого раствора. В присутствии аниона SO32- идет обесцвечивание:
17

2б. Можно провести реакцию с перманганатом калия: взять в пробирку 2 капли раствора перманганата калия, подкислить 2 каплями 2N раствора серной кислоты и внести 3-4 капли исследуемого раствора. В присутствии SO32-- иона идет обесцвечивание перманганата калия.
Проведению данных реакций мешают анионы S2- и NO2-. Об удалении этих ионов из раствора см. ниже.
3. Обнаружение карбонат - иона. Важнейшей реакцией на анион СО32- является реакция разложения карбонатов разбавленными кислотами, в результате чего выделяется оксид углерода (IV), вызывающий помутнение насыщенных растворов Са(ОН)2 или Ва(ОН)2. Для проведения опыта взять две конические пробирки, соединить их газоотводной трубкой. В одну налить насыщенный раствор Са(ОН)2 или Ва(ОН)2, в другую 10 капель исследуемого раствора и 5-6 капелб 1N раствора НС1. Появление помутнения в первой пробирке говорит о наличии в исследуемом растворе ионов СО32-:
При избытке СО2 появившееся помутнение может исчезнуть :
Проведению реакции мешают анионы SO32- т.к. они образуют CaSO3 осадок белого цвета:
Поэтому при обнаружении в растворе ионов SO32- их окисляют до SO42- ионов: берут 1мл исследуемого раствора, приливают такое же количество 10% раствора пероксида водорода:
4а. Обнаружение фосфат - ионов. Для определения этих ионов используют молибденовую жидкость — раствор (NH4)2MoO4 в разбавленной азотной кислоте. В пробирку вносят 10 капель раствора молибдата аммония и столько же капель 2N раствора HNO3 на кончике микрошпателя кристаллы NH4NO3 или NH4Cl. К смеси прибавляют 4-5 капель исследуемого раствора, примешивают и нагревают на водяной бане до 40-50°С для ускорения образования осадка. В присутствии иона РО43- образуется желтый осадок, имеющий состав (NH4)3H4[P(Mo2O7)6]. Проведению данной реакции мешают сильные восстановители (SO32-, S2- и др.), т.к. они восстанавливают молибден Мо6+ в низшие степени окисления, в результате чего раствор окрашивается в синий цвет. Восстановители можно окислить, предварительно нагрев раствор с несколькими каплями 6N раствора НNО3.
4б. Фосфаты щелочных металлов в растворе подвергаются гидролизу с образованием гидрофосфатов. Анион НРО42- в растворе определяется с
18

помощью магнезиальной смеси (смесь растворов MgCl2; NH4C1; NH4OH), которая в присутствии НРО42- - иона образует белый кристаллический осадок. Берут 4-5 капель раствора MgCl2, прибавляют 4 капли 2N раствора хлорида аммония, 3 или более капель 2N раствора NH4OH (до щелочной реакции). При этом может произойти помутнение раствора вследствие образования гидроксида магния, который следует перевести в раствор добавлением нескольких капель раствора хлорида аммония.
Далее прибавляют 4-5 капель исследуемого раствора и тщательно перемешивают, потирая стеклянной палочкой о стенки пробирки. Осадок образуется медленно.
5а. Обнаружение силикат-ионов.
Разбавленные кислоты образуют с солями кремневой кислоты белый студенистый осадок Н2SiO3(гель). Осадок образуется при нагревании и тщательном перемешивании.
5б. Кремневую кислоту при нагревании выделяют и соли аммония (идет совместный гидролиз двух солей, который усиливается в результате связывания катионами аммония образующихся гидроксогрупп). Берут 5 капель исследуемого раствора, приливают такое же количество насыщенного раствора хлорида аммония и 3-4 капли воды. Смесь хорошо перемешивают и нагревают на водяной бане.
П. Анализ смеси анионов II аналитической группы.
1а. Вначале делают пробу на присутствие анионов данной группы: к 4-5 каплям исследуемого раствора прибавляют 1-2 капли 2N раствора азотной кислоты и 4-5 капель раствора нитрата серебра. В присутствии анионов I группы выпадают осадки: AgCl - белого цвета, AgBr - бледно-желтого, AgJ - желтого, AgS - черного.
Хлорид серебра, в отличие от бромида и иодида серебра, растворяется в растворе карбоната аммония. Этим пользуются для обнаружения иона Сl- в присутствии ионов Вr- и I-: в пробирку вносят 5-6 капель исследуемого раствора, 2 капли 2N раствора азотной кислоты и по каплям раствор нитрата серебра до полного осаждения ионов. Центрифугированием отделяют осадок от раствора, промывают горячей дистиллированной водой и прибавляют 8-10 капель 3N раствора карбоната аммония, тщательно перемешивая. Если после этого в растворе остался осадок, центрифугированием отделяют его. В центрифугате определяют присутствие анионов Сl-, прибавляя к одной части его раствор бромида калия, а к другой - 2N раствор азотной кислоты до .кислой реакции раствора. В присутствии аниона Сl- в первой пробирке выпадает желтый осадок AgBr, а во второй - белый осадок AgCl.
19

1б. Если анионы Вr- и I- в растворе отсутствуют, анион Сl- определяется с помощью той же, реакции, что и катион серебра. Обнаружение хлор - иона проводится в одной и той же пробирке в три этапа:
а) получение осадка хлорида серебра:
б) Растворение хлорида серебра в растворе NH4OH:
в) обработка раствора, содержащего хлориддиамминсеребра 2N раствором' азотной кислоты: в присутствии аниона Сl- образуется белый осадок хлорида серебра или наблюдается появление белой мути:
2а. Обнаружение бромид - иона проводится со свежеприготовленной хлорной водой: в пробирку берут 4-5 капель исследуемого раствора, приливают 3-4 капли 2N раствора серной кислоты, 3 капли толуола или хлороформа и 3 капли хлорной воды, пробирку тщательно встряхнуть. В присутствии бромидиона органический растворитель окрашивается в желтый цвет:
За. Хлорная вода является реагентом и на иодид-ион (опыт выполняется как и 2а). В присутствии аниона I- органический растворитель окрашивается в розовый цвет.
Для проведения опыта можно использовать бромную воду.
4а Обнаружение сульфид-иона. Сульфид-ион с ионами серебра образует осадок Ag2S черного цвета, который растворяется в азотной кислоте при нагревании: берут 4-5 капель исследуемого раствора, приливают такое же количество раствора нитрата серебра. Выпадение черного осадка говорит о присутствии в растворе сульфид-иона:
К осадку приливают 4-5 капель 2N раствора азотной кислоты и нагревают. Идет реакция, в результате которой образуется сера.
4б. С солями кадмия сульфид-ион образует осадок сульфида кадмия желтого цвета. Берут 4-5 капли исследуемого раствора (рН=6-7). Приливают такое же количество хлорида или сульфата кадмия:
20
