
- •Экзаменационный билет №25
- •1. На малом фармацевтическом предприятии было получено 94,8 кг «Пасты салицилово-цинковой» по рабочей прописи:
- •3. К антисептическим и вяжущим лекарственным средствам растительного происхождения относят сырье зверобоя, змеевика и др.
- •4. Какими критериями должна руководствоваться аптека при выборе поставщика данной фармацевтической продукции? в каких документах в аптеке будет отражена операция поступления товаров? Ответ
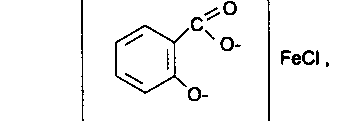
- •5. Обнаружение кислоты салициловой в приведенной лекарственной форме проводят и помощью раствора железа (III) хлорида после растворения мази в спирте, при этом появляется сине-фиолетовое окрашивание:
- •6. Существует практическое применение продуктов клеточного синтеза, полученных в результате биотехнологии.
5. Обнаружение кислоты салициловой в приведенной лекарственной форме проводят и помощью раствора железа (III) хлорида после растворения мази в спирте, при этом появляется сине-фиолетовое окрашивание:
Чем обусловлен результат реакции? Может ли образоваться иное окрашивание? Если да, то отчего это зависит?
Приведите другие способы идентификации кислоты салициловой. Напишите схемы реакций.
Рассмотрите возможные методы количественного определения препарата, объяснив их суть.
Ответ
Кислота салициловая


Лекарственные препараты имеют характерные спектры поглощения в УФ-области. Например, 0,007% раствор кислоты ацетилсалициловой в хлороформе имеет максимум при длине волны 278 нм;
Растворимость
Нерастворимы в воде кислоты (бензойная, салициловая), их эфиры.
Растворимы в воде соли щелочных металлов (натрия бензоат, натрия салицилат, натрия n-аминосалицилат),
Ароматические кислоты взаимодействуют со щелочами, а также (в отличие от фенолов) — с гидрокарбонатами щелочных металлов. В медицине применяются натриевые соли бензойной и салициловой кислот.
С солями тяжелых металлов изучаемые вещества образуют окрашенные осадки или окрашенные комплексы различного состава. Кислотные формы предварительно переводят в хорошо диссоциируемую соль путем добавления эквивалентного количества щелочи. Необходимо избегать избытка реактива, так как гидроксид тяжелого металла маскирует окраску комплекса:
Часто окраска и состав комплекса зависят от соотношения реактива и препарата, а также от рН среды.
При рН 2,0-3,0 образуется окрашенный в фиолетовый цвет моносалицилат который разрушается при добавлении кислоты хлороводородной; при добавлении кислоты уксусной окраска сохраняется. При рН 3,0-8,0 образуется дисалицилат красного цвета, а при рН 8,0-10,0 образуется трисалицилат желтого цвета:
Реакции используются -для открытия примеси кислоты салициловой, натрия салицилата и фенола в фенилсалицилате. Последний практически нерастворим в воде, поэтому указанные примеси открываются в водной вытяжке, полученной из препарата.
Примесь свободной кислоты салициловой в кислоте ацетилсалициловой определяется по образованию окрашенного комплекса с ионами железа (III).
Реакции электрофильного замещения

Кислота салициловая, являясь полифункциональным соединением, вступает в реакции, которые характерны для фенолов:
Образование азокрасителя сопровождается чаще всего появлением красного окрашивания или красного осадка. У кислоты салициловой и ее соли наблюдается желтое окрашивание, переходящее в розовое.
Соль диазония из-за нестойкости готовят непосредственно перед проведением реакции, Образование арилметанового красителя происходит в присутствии реактива Марки, при этом концентрированная H2S04 на 1-й стадии является водоотнимающим агентом, а на 2-й — окислителем:

Реакции конденсации и окисления

Количественное определение
Количественное определение ароматических кислот проводят методом алкалиметрии с индикатором фенолфталеином. В результате реакции образуется соль сильного основания и слабой органической кислоты. Такая соль легко гидролизуется, поэтому окраска индикатора может измениться до наступления точки эквивалентности. Для подавления гидролиза в анализе используют спирт.

Титрование проводят в присутствии эфира для удаления из ре акционной смеси образующейся кислоты.
