- •Экзаменационный билет №26
- •1. Фармацевтической фабрике было предложено освоить производство мази серной простой по прописи:
- •3. К противопаразитарным лекарственным средствам относят корневища с корнями чемерицы.
- •4. По каким принципам будет проведено сегментирование рынка мази серной простой? Предложите алгоритм процедуры позиционирования данного лекарственного средства. Ответ
- •1. Хлориды:
- •2. Сульфиты, сульфаты.
- •6. На фармацевтическом рынке имеется большое количество полусинтетических пенициллинов.
1. Хлориды:
к водному р-ру ЛП прибавляют азотную к-ту и выпаривают досуха на водяной бане.
При этом происходит разрушение ЛП в кислой среде с образование свободной серы и оксида серы(4):
Na2S2O3+2HNO3=>2NaNO3 + SO2 + S + H2O
*без стадии разрушения ЛП р-ция с серебра нитратом проходила бы… (см р-цию подлинности 2).
Остаток обрабатывают водой, фильтруют (для освобождения от осадка свободной серы). Фильтрат должен выдерживать испытание на хлориды.
К фильтрату доб развед азотную к-ту (вспомагательный реактив, в кот не растворяются галогениды серебра) и р-р нитрата серебра. Образуется белый творожистый осадок хлорида серебра.
![]()
Осадок растворим (в отл от бромидов и йодидов) в рре с образованием комплексного соединения:
![]()
2. Сульфиты, сульфаты.
К водному р-ру ЛП прибавляют р-р йода до желтоватого окрашивания р-ра (йод не должен обнаруживать кислой р-ции). Затем добавляют р-р нитрата бария. Р-р должен оставаться прозрачным.
Сначала при добавлении йода к ЛП происходит обесцвечивание йода:
2Na2S2O3 + I2 = Na2S4O6 + 2NaI
Затем при дальнейшем добавлении йода будет наблюдаться желтая окраска. Но если в ЛП содержится примесь сульфитов, то избыток йода будет с ней реагировать и желтой окраски не будет (HI дает кислую реакцию):
Na2SO3 + I2 + H2O = HI + Na2SO4
Затем в том же р-ре определяют сульфаты (те которые были в ЛП и которые образовались в предыдущей р-ции с йодом):
Na2SO4 + Ba(NO3)2 = 2NaNO3 + BaSO4 (осадок в виде белой мути)
3. Кроме этого определяют прозрачность и цветность р-ра, щелочность, примеси сульфидов, кальция, тяж мет, железа, мышьяка, селена
КО: Йодометрия, метод основан на способности препарата к окислению, fэкв=1 (т.к. по уравнению электронного баланса 2 молекулы тиосульфата отдает 2 электрона)
2Na2S2O3 + I2 = Na2S4O6 + 2NaI
2S2O3 2- - 2e = S4O6 2- 1
I2 0 + 2e = 2I- 1
Т-нт 0,1Н р-р йода, индикатор-крахмал
С%=(V*k*T*100)/a
Т=0,02482г/мл, вещества д.б. 99,0-102,0%
6. На фармацевтическом рынке имеется большое количество полусинтетических пенициллинов.
• Определите целесообразность увеличения номенклатуры полусинтетических пенициллинов на примере цефамицина, имипенема, монобактама-азтреонама.
Ответ
Антибиотики – низкомолекулярные (менее 2000 г/моль) вещества природного или полусинтетического происхождения. Оказывают подавляющее действие на рост и размножение бактерий, при этом относительно мало или вовсе не повреждающие клетки макроорганизма. Как лекарственные препараты антибиотики используются для терапии заболеваний, вызванных главным образом бактериальными инфекциями.
В настоящее время одной из важных задач биотехнологии является поиск новых антибиотиков, что связано с несколькими причинами:
1) рост числа бактерий, вызывающих инфекционные заболевания;
2) появление микроорганизмов, устойчивых (резистентных) к широко используемым антибиотикам;
3) использование антибиотиков в пищевой промышленности (как консерванты);
4) использование антибиотиков в научных исследованиях.
β-Лактамные антибиотики широкий класс антибиотиков, содержащий –лактамную структуру (-лактам – циклический четырехчленный амид). Включает в себя производные пенициллина (пенамы), цефалоспорина (цефемы), монобактамы и карбапенемы.
|
|
|
-Лактам (стрелкой указана связь, гидролиз которой катализируется -лактамазой) |
Действие большинства –лактамов заключается в ингибировании биосинтеза пептидогликанов, белково-полисахаридных комплексов, необходимых для структурной целостности клеточной стенки бактерий, особенно грамположительных.
Ключевой шаг биосинтеза пептидогликанов катализируется транспептидазами, известными как пенициллин связывающие белки (penicillin-binding proteins (PBPs)). β-Лактамные антибиотики – аналоги дипептида D-аланил-D-аланина – концевой структуры предшественника NAM/NAG-пептидных субъединиц растущего слоя пептидогликанов. Структурное сходство β-Лактамных антибиотиков и D-аланил-D-аланина позволяет им связываться с PBPs. -Лактамное ядро молекулы необратимо ацилирует гидроксильную группу Ser403 активного центра PBPs, что блокирует транспептидацию пептидогликана, нарушая синтез клеточной стенки бактерий.
Бактерии могут быть устойчивыми к –лактамным антибиотикам за счет наличия –лактамаз – ферментов, катализирующих гидролиз лактамного кольца антибиотика. Гидролиз приводит к инактивации антибиотика, потере антибактериального действия. Преодолеть такую устойчивость возможно с помощью комбинированного препарата - аугментин. Аугментин - комплекс –лактамного антибиотика амоксициллина и ингибитора -лактамазы – калия клавуланата. Клавулановая кислота по химической структуре сходна с бета-лактамными антибиотиками, необратимо связывается с активным центром лактамазы, инактивируя его.
|
|
|
|
Амоксициллин |
Кислота клавулановая |
Таким образом, устойчивость микроорганизмов-патогенов к антибиотикам прежде всего связана с двумя причинами – изменением в структуре пенициллин-связывающих белков (РВРs) и наличием бактериальных -лактамаз.
Целенаправленная трансформация беталактамной молекулы – основа создания новых беталактамов
Действие –лактамных антибиотиков может снижаться за счет изменения в структуре РВРs, сродство антибиотиков к ним уменьшается и отмечается резистентность к «старым» беталактамам. Высокое сродство новых природных и полусинтетических -лактамов к РВРs означает их перспективность для создания лекарственных препаратов.
Далее, при оценке новых -лактамных структур проверяется их устойчивость к действию разных -лактамаз - пенициллаз и цефалоспориназ плазмидного и хромосомного происхождения, выделенных из разных бактерий. С этой целью используются наборы -лактамаз, обладающих разной субстратной специфичностью. Если большинство используемых -лактамаз не инактивирует новую -лактамную структуру, то она признается перспективной.
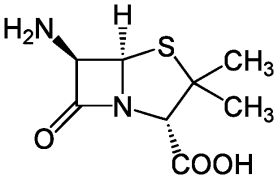
Пенициллины – оптически активные соединения, их химический синтез сложен, так как требует разделения оптических изомеров. Успешное сочетание биосинтеза и органического синтеза позволило получить из бензилпенициллина полусинтетические пенициллины более широкого спектра действия. Исходная (оптически активная) структура для синтеза полусинтетических пенициллинов - 6-аминопенициллановая кислота (6-АПК). 6-АПК образуется при ферментативном гидролизе бензилпенициллина. Биотехнология производства бензилпенициллина при промышленном культивировании плесневого гриба Penicillium chrysogenum хорошо отработана.
Сама по себе 6-АПК не активна. Ацилированием 6-АПК были получены ампициллин, амоксициллин, не чувствительные к распространенным пенициллиназам.
|
|
|
|
Бензилпенициллин |
6-АПК |
Применяемые в медицине полусинтетические цефалоспорины синтезируются на основе общего предшественника - 7-аминоцефалоспорановой кислоты (7-АСА), получаемой из цефалоспорина С, продуцируемого грибом-аскомицетом Acremonium chrysogenum.
|
|
|
|
Цефалоспорин С |
7-АСА |
Наличие метоксигруппы или некоторых других заместителей в 6-положении у пенициллинов и, соответственно, в 7-положении у цефалоспоринов приводит к тому, что многие -лактамазы теряют способность гидролизовать -лактамное кольцо. Такие содержащие метоксигруппу –ОСН3 цефалоспорины относят к группе цефамицинов. Типичными представителями этой группы являются антибиотики цефокситин (Cefoxitin) и цефметазон. Они характеризуются высокой устойчивостью к лактамазам и широким спектром действия, включающим как аэробов, так и анаэробов.
Традиционно –лактамы более активны в отношении грамположительных микроорганизмов. При изменении структуры сконденсированного с беталактамом пяти- или шестичленного кольца получаются «двоюродные братья» пенициллинов, устойчивые к ряду -лактамаз. С этой точки зрения потенциально интересен антибиотик-карбапенем (название карба- указывает, что в тиазолидиновом кольце сера замещена на углерод) тиенамицин (thienamycin). Тиенамицин получают при культивировании Streptomyces cattleya и используют как основу для получения полусинтетических антибиотиков. Имипенем – пример такого полусинтетического антибиотика, имеет очень широкий спектр действия, активен в отношении грамположительных, грамотрицательных бактерий, аэробов и анаэробов. Имипенем используют в редких случаях, преимущественно как внутривенные инъекции в клиниках для терапии серьезных бактериальных инфекций. Ограниченное применение имипенема связано с возможным появлением сверхустойчивых штаммов бактерий.
|
|
|
|
Цефокситин– (цефалоспорин 2-ого поколения) |
Имипенем (карбапенем) |
Имеются указания, что компактность молекулы имипенема и его цвиттерионная (при физиологическом значении рН) структура обеспечивает относительно легкое его проникновение как через катионоселективные, так и через анионоселективные пориновые каналы бактерий.
Немалой ценностью обладают -лактамные структуры, у которых вводимые в ядро молекулы-заместители создают в ней катионный центр. Такие -лактамы высокоактивны против многих кишечных бактерий по причине катионоселективности пориновых каналов у бактерий, вызывающих кишечные инфекции. В качестве примера можно привести структуру молекулы применяемого в клинике -лактама – цефтазидима. Катионный центр цефтазидима - пиридиновая структура. Цефтазидим устойчив к действию лактамаз за счет наличия оксимного фрагмента, причем Z-изомер оксима почти в 20000 раз стабильнее, чем E-изомер.
|
|
|
|
Цефтазидим (цефалоспорин 3-его поколения) |
Азтреонам (монобактам) |
К «нетрадиционным» относят такие -лактамы, в которых -лактамное кольцо не сконденсировано с другим кольцом (пяти- или шестичленным). Такие «монобактамы», устойчивы к некоторым –лактамазам. Наиболее известный монобактам азтреонам – полусинтетический антибиотик, его синтезируют на основе монобактама, получаемого при культивировании Chromobacterium violaceum. Азтреонам высоко эффективен по отношению к грамотрицательным бактериям и почти не оказывает воздействия на грамположительные бактерии и анаэробы.
Следует отметить, что наряду с традиционными способами создания новых антибиотиков (поиск микроорганизмов-продуцентов, модификации природных антибиотиков) все большее место в решении задачи увеличения номенклатуры антибиотиков занимают методы генетической инженерии. Эти методы позволяют создавать рекомбинантные штаммы микроорганизмов как «фабрики» для создания антибиотиков с заданными свойствами.