
|
Филиал федерального государственного бюджетного образовательного учреждения высшего профессионального образования «Уральский государственный университет путей сообщения» в г. Златоусте
|
|
Литий. Его свойства и значение |
|
Реферат по дисциплине Химия |
|
|
|
|
|
|
Выполнен: студентом I курса
группы 12 «М»
Дракус Натальей Владимировной
Преподаватель Химии:
Соловей Ольга Викторовна
|
Златоуст 2014 |
§1. Литий. История открытия 4
§2. Положение в периодической системе 5
§3. Способы получения 6
§4. Физические свойства 8
§5. Химические свойства 9
§6. Применение 11
§7. Биологическое значение 16
Заключение 17
Список литературы 18
Введение
Литий - типичный элемент земной коры (содержание 3,2·10-3% по массе), он накапливается в наиболее поздних продуктах дифференциации магмы - пегматитах. В мантии мало Лития. В биосфере Литий мигрирует сравнительно слабо, роль его в живом веществе меньше, чем остальных щелочных металлов. Из вод он легко извлекается глинами, его относительно мало в Мировом океане. Промышленные месторождения Лития связаны как с магматическими породами (пегматиты, пневматолиты), так и с биосферой (соленые озера).
§1. Литий. История открытия
Когда Дави производил свои знаменитые опыты по электролизу щелочных земель, о существовании лития никто и не подозревал. Литиевая щелочная земля была открыта лишь в 1817 г. талантливым химиком-аналитиком, одним из учеников Берцелиуса Арфведсоном. В 1800 г. бразильский минералог де Андрада е Сильва, совершая научное путешествие по Европе, нашел в Швеции два новых минерала, названных им петалитом и сподуменом, причем первый из них через несколько лет был вновь открыт на острове Уте. Арфведсон заинтересовался петалитом, произвел полный его анализ и обнаружил необъяснимую вначале потерю около 4% вещества. Повторяя анализы более тщательно, он установил, что в петалите содержится "огнепостоянная щелочь до сих пор неизвестной природы". Берцелиус предложил назвать ее литионом (Lithion), поскольку эта щелочь в отличие от кали и натра впервые была найдена в "царстве минералов" (камней); название это произведено от греч.- камень. Позднее Арфведсон обнаружил литиевую землю, или литину, и в некоторых других минералах, однако его попытки выделить свободный металл не увенчались успехом. Очень небольшое количество металлического лития было получено Дэви и Бранде путем злектролиза щелочи. В 1855 г. Бунзен и Маттессен разработали промышленный способ получения металлического лития электролизом хлорида лития. В русской химической литературе начала XIX в. встречаются названия: литион, литин и литий; литиевую землю (щелочь) называли иногда литина.
§2. Положение в периодической системе
Литий (лат. Lithium), Li, химический элемент I группы периодической системы Менделеева, атомный номер 3, атомная масса 6,941, относится к щелочным металлам. Природный Литий состоит из двух стабильных изотопов - 6Li (7,42%) и 7Li (92,58%).
+3)2e )1e
1S22S1
2S1

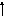
1S2
§3. Способы получения
Соединения Лития получаются в результате гидрометаллургической переработки концентратов - продуктов обогащения литиевых руд. Основной силикатный минерал - сподумен перерабатывают по известковому, сульфатному и сернокислотному методам. В основе первого - разложение сподумена известняком при 1150- 1200 °С:
Li2O·Al2O3·4SiO2 + 8CaCO3 = Li2O·Al2O3 + 4(2CaO· SiO2) + 8CO2
При выщелачивании водой в присутствии избытка извести алюминат Лития разлагается с образованием гидроксида Лития:
Li2O·Al2O3 + CaOH2 = 2LiOH + CaO·Al2O3
По сульфатному методу сподумен (и другие алюмосиликаты) спекают с сульфатом калия:
Li2O·Al2O3·4SiO2 + K2SO4 = Li2SO4 + K2O·Al2O3·4SiO2
Сульфат Лития растворяют в воде и из его раствора содой осаждают карбонат Лития:
Li2SO4+Na2CO3=Li2CO3 + Na2SO4.
По сернокислотному методу также получают сначала раствор сульфата Лития, а затем карбонат Лития; сподумен разлагают серной кислотой при 250-300 °С (реакция применима только для β-модификации сподумена):
β-Li2O·Al2O3·4SiO2 + H2SO4 = Li2SO4 + H2O·Al2O3·4SiO2
Метод используется для переработки руд, необогащенных сподуменом, если содержание в них Li2O не менее 1%. Фосфатные минералы Лития легко разлагаются кислотами, однако по более новым методам их разлагают смесью гипса и извести при 950-1050 °С с последующей водной обработкой и осаждением из растворов карбоната Лития.
Металлический Литий получают электролизом расплавленной смеси хлоридов Лития и калия при 400-460 °С (весовое соотношение компонентов 1:1). Электролизные ванны футеруются магнезитом, алундом, муллитом, тальком, графитом и других материалами, устойчивыми к расплавленному электролиту; анодом служат графитовые, а катодом - железные стержни. Черновой металлический Литий содержит механические включения и примеси (К, Mg, Ca, Аl, Si, Fe, но главным образом Na). Включения удаляются переплавкой, примеси - рафинированием при пониженном давлении. В настоящее время большое внимание уделяется металлотермическим методам получения Лития.
