
- •1.3.Задачи на применение условия выпадения осадка.
- •1.4. Расчет растворимости осадков в присутствии одноименных ионов.
- •1.5.Расчет растворимости осадка в присутствии разноименных ионов ( солевой эффект).
- •1. Расчет констант равновесия окислительно-восстановительных реакций.
- •2.Расчет окислительно-восстановительного потенциала.
- •1.Вычислить константу равновесия окислительно-восстановительной реакции и сделать ввод о ее направлении:
- •2) Вычислить окислительно-восстановительный потенциал:
Метрологические основы аналитической химии.
Пример 1. Определите доверительный интервал среднего арифметического для выборки результатов, полученных при определении содержания массы Na2CO3 в 100 мл раствора соды прямым титрованием его аликвотных частей раствором соляной кистоты в граммах: 0,2031; 0,2033; 0,2015; 0,2048; 0,2020, где число вариант n=5, среднее арифметическое Х=0,2029г, а стандартное отклонение выборки S=0.0013г.
Решение. При вероятности Р=0,95 по табл.1 определяют коэффициент Стьюдента: в данном случае при n=5,t=2.776.
По
формуле находят точность погрешности
среднего арифметического выборки:
![]()
![]() 2.776·0.0013/√5=0.001614.
2.776·0.0013/√5=0.001614.
Поскольку
точность погрешности среднего
арифметического не может быть выше
точности самой величины ![]() ,
после округления получают
,
после округления получают ![]()
Следовательно, доверительный интервал составляет
0,2029±0,0016
или 0,2013<![]() <0,2045
для Р=95%.
<0,2045
для Р=95%.
Таблица 1
Коэффициенты Стьюдента t
|
Число вариант n |
Число степеней свободы f=n-1 |
Значения t при Р | ||
|
0,90 0,95 0,99 | ||||
|
2 |
1 |
6,314 |
12,71 |
65,66 |
|
3 |
2 |
2,920 |
4,303 |
9,925 |
|
4 |
3 |
2,353 |
3,182 |
5,841 |
|
5 |
4 |
2,132 |
2,776 |
4,604 |
|
6 |
5 |
2,015 |
2,571 |
4,034 |
|
7 |
6 |
1,94 |
2,45 |
3,71 |
|
8 |
7 |
1,90 |
2,37 |
3,5 |
|
9 |
8 |
1,86 |
2,31 |
3,36 |
|
10 |
9 |
1,83 |
2,26 |
3,25 |
|
11 |
10 |
1,81 |
2,23 |
3,17 |
|
16 |
15 |
1,75 |
2,13 |
2,95 |
|
21 |
20 |
1,73 |
2,09 |
2,85 |
Пример 2 . Оцените наличие промахов в выборке результатов, приведенных в примере 1.
Решение. Располагают результаты выборки в порядке их возрастания и определяют диапазон выборки:
0,2015; 0,2020; 0,2031; 0,2033; 0,2048;
w=0.2048-0.2015=0.0033.
Поскольку в данной выборке n>3, проверяем на промах наибольшую варианту по уравнению:
Qp=(Xi+1 –Xi)/w , Qp- расчетная величина критерия; Xi+1-подвергаемое сомнению значение; Xi- соседнее с ним значение выборки; w-диапазон выборки.
Qp=(0,2048-0,2033)/0,0033=0,45.
По таблице 2 при Р=0,95 в случае n=5 Qt=0.73
Так как 0,45<0,73 или Qp< Qt ,то проверяемое значение не является промахом. Следовательно, промахи в данной выборке отсутствуют.
Таблица 2
Табличные коэффициенты Qt
|
Число вариант n |
Значение Qt при Р | ||
|
0,90 |
0,95 |
0,99 | |
|
3 |
0,94 |
0,98 |
0,99 |
|
4 |
0,76 |
0,85 |
0,93 |
|
5 |
0,64 |
0,73 |
0,82 |
|
6 |
0,56 |
0,64 |
0,74 |
|
7 |
0,51 |
0,59 |
0,68 |
|
8 |
0,47 |
0,54 |
0,63 |
|
9 |
0,44 |
0,51 |
0,60 |
|
10 |
0,41 |
0,48 |
0,57 |
Пример
3. При кислотно-основном титровании
аликвотных частей того же раствора
соды, что и в примере 1, но выполненном
с применением нового индикатора, была
получена выборка результатов (в граммах):
0,2030; 0,2038; 0,2039; 0,2050. Оцените статистическую
однородность стандартных отклонений
обеих выборок и их средних арифметических
значений, если применение Q-теста
ко вновь полученной выборке показало,
что промахи в ней отсутствуют, а
рассчитанные ее метрологические
характеристики следующие: ![]() 2=0,2039;
S22=67.7·10-8.
2=0,2039;
S22=67.7·10-8.
Решение. 1.Сравнив значения дисперсий рассматриваемых выборок, определяют расчетное значение F-критерия:
Первая выборка результатов : n1=5; X1=0.2029; S12=164.5·10-8.
Вторая
выборка: n2=4;
![]() 1=0.2029;
S22=67.7·10-8.
1=0.2029;
S22=67.7·10-8.
Так как S12> S22, в числитель уравнения Fp= S12/ S22,( S12-большая по значению дисперсия) F-критерия следует поместить значение дисперсии первой выборки результатов:
Fp=164,5·10-8/(67,7·10-8)=2,43.
По таблице 3 с учетом n1=5, a n2=4(соответственно f1=4, f2=3) для Р=0,95 определяют теоретическое значение F-критерия: Fт=9,12.
Поскольку 2,43<9,12 или Fp< Fт, расхождение между дисперсиями данных выборок незначительно, следовательно, обе выборки равнозначны.
Определяем средневзвешенную дисперсию по уравнению
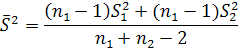
(где индекс 1 относится к числу вариант (n) и дисперсии (S) первой вборки, индекс 2- соответственно ко второй.)
![]()
Рассчитаем t-критерий по уравнению
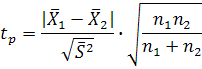
где
![]() --
расчетная величина t-критерия;
n1
n2—число
вариант выборки соответственно с
дисперсией S12
S22.
--
расчетная величина t-критерия;
n1
n2—число
вариант выборки соответственно с
дисперсией S12
S22.
![]() =
=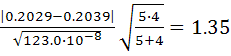
По таблице 1 для Р=0,95 и f=5+4-2=7 находим tт=2,37.
Так как 1,35<2,37 или tp<tт, следовательно, значимого различия между рассматриваемыми величинами средних арифметических значений не существует. Таким образом, применение нового индикатора не приводит к систематическим погрешностям при титровании, т.е. к изменению точности результатов.
Задачи для самостоятельного решения.
1.При определении содержания свинца в сплаве были получены следующие результаты (%): 14,50; 14,43; 14,54; 14,45; 14,44; 14,52; 14,58; 14,40; 14,25; 14,19. Оцените наличие промахов, рассчитайте среднее арифметическое и доверительный интервал.
2.Определите, является ли последний результат промахом:
а)При анализе получены следующие данные о содержании в топазе Al2O3(%): 53,96; 54,15; 54,05; 54,08; 54,32.
б)При анализе получены данные о содержании в апатите Р2О5(%):
35,11; 35,14; 35,18; 35,21; 35,42.
в)При определении гравиметрическим методом сульфат-иона получены следующие данные о содержании SO3(%):15,51; 15,45; 15,48; 15,53; 16,21.
3.Вычислите стандартное отклонение единичного определения и доверительный интервал среднего значения для Р=0,95:
а) При определении ванадия получены следующие результаты (в граммах):
8,00·10-4; 8,40·10-4.
б) В серебряной монете при анализе параллельных проб получено следующее содержание серебра (%): 90,04; 90,12; 89,92; 89,94; 90,08 ; 90,02.
в) При определении сурьмы в сплаве титриметрическим методом получены данные(%): 11,95; 12,03; 11,98; 12,04.
г) При определении концентрации перманганата калия тремя студентами получены следующие результаты (моль/л):
0,1013; 0,1012; 0,1012; 0,1014;
0,1015; 0,1012; 0,1012; 0,1013;
0,1013; 0,1015; 0,1015; 0,1013.
4. Статистически значимо ли различаются результаты приведенных методов анализа:
а) Массовую долю (%) CuO в минерале определили методом иодометрии и методом комплексонометрии. По первому методу получили результаты:
38,20; 38,00; 37,66. По второму: 37,70; 37,65; 37,55.
б) Содержание Fe2O3 в руде определили перманганатометрическим методом и методом комплексонометрии. При этом получили следующие результаты(%): 1)60,12; 61,00; 61,25; 2)58,75; 58,90; 59,50.
5.Студент получил следующие результаты определения концентрации раствора HCl (моль/л): 0,1003; 0,1004; 0,1003; 0,1008. Следует ли исключить выпадающий результат?
6.Определяя константу диссоциации кислоты, химик получил следующие значения: 4,27·10-4; 4,67·10-4; 4,18·10-4. Должен ли он оставить все результаты для дальнейшей обработки?
7. Получены следующие результаты определения меди в латуни (%): 12,29; 12,24; 12,48; 12,20. Решите вопрос об исключении выпадающего результата(Р=0,90).
Кислотно-основное равновесие
Расчет рН раствора по известным равновесным концентрациям растворенных веществ
При решении задач необходимо провести вычисления в следующей последовательности:
1) написать уравнение реакции взаимодействия веществ, при необходимости по ступеням;
2) перевести концентрации всех веществ в молярные;
3) рассчитать количество молей всех веществ;
4) на основании полученных данных определить состав раствора после протекания реакций и выбрать уравнение для расчета рН;
5) рассчитать объем раствора после смешения;
6) рассчитать концентрации веществ в образовавшемся после смешения растворе;
7) вычислить рН раствора.
Пример 1. Вычислить рН раствора, полученного при сливании:
а) 20 мл 0,12 М раствора NaCN и 15 мл 0,09 М раствора HCl.
Решение. Запишем уравнение реакции
NaCN+HCl = СHCN+NaCl
С целью выяснения состава раствора, образовавшегося после сливания, рассчитаем количества веществ в исходных растворах:
n0 (NaCN) =20 · 10-3 · 0.12 = 2.4 · 10-3 моль
n0 (HCl) =15 · 10-3 · 0.09 = 1.35 · 10-3моль.
Так как n0(NaCN) › n0(HCl), то NaCN находится в избытке, следовательно, в образовавшемся после сливания растворе будут находится NaCN и NaCN в следующих количествах:
n1 (NaCN) = n0 (NaCN) -n0 (HCl) = 2,4 ∙10-3 - 1,35 ∙ 10-3 = 1,05 ∙10-3 моль;
n1 (HCN) = n0 (HCl) = 1,35 ∙10-3 моль;
Объем раствора (V) составит 20+15 = 35 мл.
Рассчитаем концентрации веществ в растворе:
С (NaCN) = 1,05 ∙10-3/35 ∙10-3 = 0,03 моль/л;
C (HCN) = 1,35 ∙10-3/35 ∙10-3 = 0,039 моль/л.
Исходя из состава раствора, выбираем формулу для расчета рН буферных растворов:
рН = pKHCN-lg [C(HCN)/C(NaCN)] = 9,3-lg(0,039/0,03) = 9,18.
б) 11,25 мл 0,12 моль/л раствора NaCN и 15,0 мл 0,09 моль/л раствора HCl.
Решение.
n (NaCN) = 11,25 ·10-3·0,12 = 1,35 ·10-3 моль.
n (HCl) = 15,0 ·10-3·0,09 = 1,35 ·10-3 моль.
Так как n (NaCN)= n (HCl), то в образовавшемся после сливания растворе будет находиться только 1,35·10-3 моль HCN.
Объем раствора(V) составит 11,25+15,0=26,25 мл.
Рассчитаем концентрацию HCN в растворе:
С(HCN )= 1,35 ·10-3/26,25 ·10-3=0,051моль/л.
Исходя из состава раствора, выбираем формулу для расчета рН слабых кислот:
рН=1/2рКHCN – 1/2 lg (C(HCN))=1/2 · 9,3 – 1/2 · lg(0,051)=5,3;
в)20,0 мл 0,12 моль/л раствора NaCN и 35,0 мл 0,09 моль/л раствора HCl. Решение:
n0 (NaCN) =20,0 ·10-3 ·0,12=2,4 ·10-3 моль.
n0 (HCl) =35,0 ·10-3 · 0,09=3,15 ·10-3 моль.
n0 (HCl) › n0 (NaCN) , т.е. в избытке HCl, то в образовавшемся после сливания растворе будут находится HCl и HCN в следующих количествах:
n1 (HCl)=35,0·10-3· 0,09 – 20.0·10-3·0,12=0,75·10-3 моль.
n1 (HCN)= 20,0 ·10- 3·0,12=2,4·10-3 моль.
Поскольку сильная кислота HCl подавляет диссоциацию слабой кислоты HCN, то рН определяется только ее концентрацией.
Объем раствора (V)составит 20,0+35,0=55,0 мл.
Рассчитаем концентрацию HCl в растворе:
С(HCl)=0,75·10-3/55,0 C·10-3=0,014 моль/л.
Исходя из состава раствора, выбираем формулу для расчета рН сильных кислот:
рН = - lg(C(HCl)) = - lg(0,014)=1,87.
Пример 2. Вычислить рН раствора, полученного при сливании 10, мл 0,1 моль/л раствора Na2HAsO4 и 16,0 мл 0,1 моль/л раствора HCl.
Решение:
После сливания растворов могут протекать следующие реакции:
Na2HAsO4+HCl=NaH2AsO4+NaCl (1)
NaH2AsO4+HCl=H3AsO4+NaCl (2)
Рассчитаем количества вещества в исходных растворах:
n(Na2HAsO4)=10,0 ·10-3· 0,1 =1,0·10-3 моль.
n(HCl)=16,0·10-3· 0,1=1,6·10-3 моль.
Так как Na2HAsO4 взят в недостатке , то все количество его прореагирует с HCl согласно уравнению (1) , и после протекания реакции (1) в растворе останется 1·10-3 моль NaH2AsO4 и (1,6 -1,0) ·10-3 =0,6·10-3 моль HCl. Аналогично после реакции (2) в растворе будут находится H3AsO4 и NaH2AsO4 в следующих количествах:
n (NaH2AsO4) = 1,0·10-3- 0,6 ·10-3=0,4·10-3 моль
n (H3AsO4) = 0,6·10-3 моль.
Объем раствора после смешения составит 10+16=26 мл, или 26·10-3л. Рассчитаем концентрации компонентов в растворе:
С(NaH2AsO4)=0,4·10-3/26·10-3=0,015 моль/л;
С(H3AsO4)= 0,6·10-3/26·10-3=0,023 моль/л.
Исходя из состава раствора , выбираем формулу для расчета рН буферных растворов:
рН=рК1H3AsO4 - lg(C(H3AsO4) /C(NaH2AsO4))=2,22 – lg(0,023/0,015)=2.03.
Примечание:
Расчет рН растворов кислых солей проводится по следующей формуле:
рН=(рКn+рКn+1)/2
Индивидуальные задания .
Рассчитать рН раствора, полученного после смешения раствора 1 и раствора 2.
|
№ |
Раствор 1 |
Раствор 2 |
|
1. |
20 мл 0,12 М NaOH |
5,2 мл 0,24 М HCl |
|
2. |
20 мл 0,25 М NaOH |
10,2 мл 0,5 М раствора сильной кислоты |
|
3. |
25 мл HNO3с титром 0,006128 г/мл |
0,25 мл 0,1105 н NaOH |
|
4. |
25мл 0, 1120 М КОН |
10,5 мл 0,1396 М HCl |
|
5. |
20 мл 0,175 н H2SO4 |
35 мл NaOH с титром 0,004000 г/мл |
|
6. |
100 мл 0,01 н HCl |
100,1 мл 0,01 н NaOH |
|
7. |
25 мл 0,1 М HNO3 |
15,5 мл 0,11 М NaOH |
|
8. |
20,5 мл 0,102 н NaOH |
15,5 мл 0,1 М H2SO4 |
|
9. |
20,50 мл 0,1 М H3AsO4 |
45 мл 0,1 М КОН |
|
10. |
12 мл 0,3 М НСООН |
15,00 мл 0,10 М NH4OH |
|
11. |
20,5 мл 0,1 М Na2CO3 |
20,25 мл 0,2 М HCl |
|
12. |
18,75 мл 0,112 М Н2C2 O4 |
40,00 мл 0,109 М NaOH |
|
13. |
20,25 мл 0,1 М НСООН |
20,3 мл 0,1005 М КОН |
|
14. |
18,75 мл 0,1 М раствора гидразина |
15,00 мл 0,125 М HCl |
|
15. |
19,25 мл 0,105 н. раствора гидроксиламина |
10,10 мл 0,1 н. HCl |
|
16. |
25 мл 0,02723 М HCl |
20 мл 0,1 М Na2HРО4 |
|
17. |
25 мл 0,1 М Na3 РО4 |
50,0 мл 0,1 М HCl |
|
18. |
20 мл 0,11 М Na2HРО4 |
15 мл 0,05 М H2SO4 |
|
19. |
22,5 мл 0,2 М К2НРО4 |
25 мл 0,2 М H2SO4 |
|
20. |
20 мл 0,1 М КОН |
10,5 мл 0,1 М H2SO4 |
|
21. |
20 мл 0,1 М Са(ОН)2 |
19,75 мл 0,1 HCl |
|
22. |
20 мл 0,15 н. НСООН |
40 мл 0,075 М КОН |
|
23. |
100 мл 0,1 н. раствора одноосновной кислоты (К=1*10-6) |
99,9 мл 0,1 М раствора NaOH |
|
24. |
30 мл 0,15 н. СН3СООН |
60 мл 0,075 М NaOH |
|
25. |
100 мл 0,1 н. НСООН |
99,9 мл 0,1 М NaOH |
|
26. |
20,55 мл 0,1 М NH4OH |
20,86 мл 0,0985 М HCl |
|
27. |
15 мл 0,1 н. Na2В4О7 |
15 мл 0,1 н. HCl |
|
28. |
20 мл 0,1036 М H3 РО4 |
15,82 мл 0,1307 М NaOH |
|
29. |
20 мл 0,1 М H3РО4 |
15,20 мл 0,1280 М NaOH |
|
30. |
17,5 мл 0,12 М H3РО4 |
35 мл 0,12 М КОН |
|
31. |
17,46 мл 0,1 М H3РО4 |
17,80 мл 0,1950 М NaOH |
|
32. |
25 мл 0,12 М H3РО4 |
30,00 мл 0,25 М КОН |
|
33. |
15,05 мл 0,1 М H3РО4 |
45,15 мл 0,1 М NaOH |
|
34. |
25,00 мл 0,1 М Na3 РО4 |
24,5 мл 0,2 М HCl |
|
35. |
24,30 мл 0,12 М Na3 РО4 |
40,52 мл 0,12 М HCl |
|
36. |
20 мл 0,125 М Na2CO3 |
24,00 мл 0,1 М HCl |
|
37. |
19 мл 6,2н СН3СООН |
1 мл 2 н СН3СООNa |
|
38. |
15 мл 0,05 н СН3СООН |
15 мл 0,01 н СН3СООNa |
|
39. |
125 мл 0,2М NH4OH |
125 мл 0,2М NH4Cl |
|
40. |
12 мл 0,2М NH4OH |
12 мл 0,5М NH4Cl |
|
41. |
17 мл 0,2М NH4OH |
17 мл 1М NH4Cl |
|
42. |
50 мл 0,05М NH4OH |
60 мл 0,01н HCl |
|
43. |
15 мл 0,05 н СН3СООН |
20 мл 0,02 н КОН |
|
44. |
25 мл 0,1 н NH4OH |
15 мл 0,1н НNO3 |
Вычислите рН следующих растворов:
0,4% гидроксида натрия, плотность 1,002 г/смЗ;
0,74% гидроксида калия, плотность 1,004 г/смз;
0,1 М азотистой кислоты;
0,2 М цианистоводородной кислоты;
0,01 М муравьиной кислоты;
0,1 М фенола;
0,02 М бензойной кислоты;
0,1 М гидроксиламина;
0,2 М анилина.
Вычислите рН среды в 0,1 М растворах следующих протолитов: цианида калия; сульфита натрия; гидросульфита натрия; карбоната натрия; гидрокарбоната натрия; карбоната аммония; фосфата натрия.
Вычислите рН среды, если навеску 0,05 г нитрата аммония растворили в 100 мл раствора.
Вычислите степень диссоциации в 0,01 М растворах: азотистой кислоты; уксусной кислоты; синильной кислоты; гидроксида аммония; анилина; гидроксиламина.
Вычислите кажущуюся степень диссоциации в 0,5 М растворах: а) соляной кислоты при рН 0,37; б) гидроксида калия при рН 13,5.
Вычислите концентрацию ионов водорода и гидроксила в растворе, рН которого равен: 2; 9; 6.
Вычислите рН смеси, содержащей равные объемы 5% растворов уксусной
кислоты и ее натриевой соли.
Вычислите рН 0,001 М раствора гидроксида аммония в присутствии
0.1М раствора хлорида аммония.
Вычислите рН 0,01 М раствора иодноватистой кислоты (HIO) в
присутствии 0,1 М раствора ее соли (NaIO).
10.Вычислите рН смеси аммиака и хлорида аммония, если она приготовлена
из 0,1 М растворов этих веществ в отношении 1 : 9.
11. Вычислите рН смеси, если к 200 мл 0,1 М раствора NH4 ОН добавить
2,14г хлорида аммония.
12. Какую навеску хлорида аммония следует растворить в 100 смЗ
раствора, чтобы рН раствора был равен 6?
13. В каком объеме следует растворить навеску ацетата натрия 0.03г ,
чтобы получить раствор с рН 8 ?
14. Приготовьте 30 мл буферного раствора с рН 9,0.
15. Сколько грамм безводного ацетата аммония надо добавить к 200 мл 0,1
М раствора уксусной кислоты, чтобы получился буферный раствор с рН
3,87?
16. Вычислите рН 0,0625 М раствора этиламина С2Н5NНзОН, если
подвижность иона С2Н5NНз + равна 58,6, а эквивалентная электрическая
проводимость этого раствора составляет 20,99 Ом-1 см2 .
17. Вычислите рН 0,1 М раствора НI03, если удельная электропроводимость
этого раствора 4,02 Ом·1 см·1, а подвижность иона IO3 - 41 Ом·1 см2.
18. Вычислите константу диссоциации гидроксида аммония, если
эквивалентная электрическая проводимость 0,0082 М раствора NH40H
равна 12,43 Ом·1 см2 .
![]() Равновесие
в системе осадок-раствор.
Равновесие
в системе осадок-раствор.![]()
Гетерогенная система состоит из двух фаз: насыщенного раствора электролита и осадка. В этой системе устанавливается динамическое равновесие:
BaSO4↓↔Ba2++ SO42-
К этой равновесной системе применим закон действия масс, исходя из которого можно сформулировать правило произведения растворимости(ПР):
Произведение концентраций ионов труднорасворимого электролита в его насыщенном растворе есть величина постоянная при данной температуре:
ПРBaSO4=[Ba2+]∙[SO42-]
Если
в формуле имеются стехиометрические
коэффициенты, то они входят
![]() в
уравнение как показатели степени, в
которые необходимо возвести концентрации
ионов, например:
в
уравнение как показатели степени, в
которые необходимо возвести концентрации
ионов, например:
ПРCa3(PO4)2=[Ca2+]3∙[PO43-]2
Произведение растворимости характеризует растворимость вещества: чем больше значение ПР, тем больше растворимость.
При более точных расчетах необходимо вместо концентраций ионов использовать значения активностей, учитывающих электростатические взаимодействия между ионами.
Активности ионов пропорциональны концентрациям:
а =f ∙C.
Здесь f =a/C – коэффициент активности, зависящий от концентраций и зарядов всех ионов в растворе, а также от собственного заряда иона. Для нахождения коэффициентов активности сначала рассчитывают ионную силу раствора I по формуле
![]()
![]()
![]()
Здесь Ci Zi – молярные концентрации и заряды всех ионов в растворе.
Расчет ПР по растворимости.
Пример 1. Вычислить произведение растворимости иодида серебра , если растворимость этой соли при температуре 25◦С равна 2.865 ∙10-6 г/л.
Решение. Химическое равновесие в насыщенном растворе AgI описывается уравнением:
AgI↔Ag++I-
Запишем выражение произведения растворимости для иодида серебра:
ПРAgI=[Ag+]∙[I-]
Вычислим
растворимость иодида серебра (моль/л).
Так как молярная масса
![]() AgI
составляет 234.772 г/моль, то концентрация
AgI
составляет 234.772 г/моль, то концентрация
![]() AgI
в растворе составит
AgI
в растворе составит
[AgI]=2.865∙10-6/234.772=1.22∙10-8моль/л.
При диссоциации каждого моля иодида серебра образуется 1 моль Ag+ и 1 моль I-. Следовательно, их концентрации равны:
[Ag+]=[I-]=[AgI]=1.22∙10-8 моль/л.
Подставляя значения [Ag+] [I-] в уравнение произведения растворимости , получим:
ПРAgI= 1.22∙10-8∙1.22∙10-8=1.5 ∙10-16.
Пример 2. Вычислить произведение растворимости Ag2CrO4 , если в 100 мл насыщенного раствора его содержится 0.002156г.
Решение. Найдем растворимость хромата серебра (моль/л):
в 100 мл насыщенного раствора содержится 0.002156 г соли
в 1000 мл ---------------------------------------------- х г соли
х=1000∙0.002156/100=0.02156 г/л.
Молярная масса Ag2CrO4 равна 331.73 г/моль, тогда растворимость Ag2CrO4 (моль/л) будет
[Ag2CrO4]=0.02156/331.73 моль/л=6.5∙10-5моль/л.
Хромат серебра диссоциирует следующим образом:
Ag2CrO4↓↔2Ag++ CrO42-
Тогда
[Ag+]=2∙6.5∙10-5=1.3∙10-4моль/л;
[CrO42-]=6.5∙10-5 моль/л;
ПР Ag2CrO4=[Ag+]2 [CrO42-]=(1.3∙10-4)2∙6.5∙105≈1.1∙10-11.
Расчет растворимости осадков в воде.
Пример 3. Вычислить растворимость оксалата кальция, массовую концентрацию ионов Са2+ и массу кальция в 100 мл раствора, если произведение растворимости его равно 2.57 ∙ 10-9.
Решение. Химическое равновесие в насыщенном растворе СаС2О4 описывается уравнениями:
СаС2О4↓↔ Са2++ С2О42-
ПР СаС2О4 ↔[Ca2+]∙[C2O42-]
Обозначим растворимость СаС2О4 через х моль/л. При диссоциации х молей СаС2О4 образуется х молей Са2+ и х молей С2О42-. Подставляя эти значения в уравнение произведения растворимости, получим
ПР СаС2О4 =х∙х=2.57∙10-9;
Х2=2.57∙10-9;
Х=![]() =5.07∙10-5моль/л.
=5.07∙10-5моль/л.
Чтобы найти растворимость СаС2О4 (г\л), необходимо молярную растворимость (моль/л) умножить на молярную массу СаС2О4:
5,07·10-5·128,1≈6,5·10-3г/л.
Чтобы найти массовую концентрацию ионов Са2+, нужно умножить молярную растворимость на атомную массу Са2+:
5,07·10-5·40,08≈2·10-3г/л.
Массу кальция в 100мл раствора находим из пропорции:
в1000 мл раствора-- 2·10-3 г кальция,
в100 мл раствора -- х г кальция,
х=2·10-3·100/1000=2·10-4г.
1.3.Задачи на применение условия выпадения осадка.
Пример 4.При какой молярной концентрации хромата натрия начнется выпадение осадка из 0,001М раствора нитрата свинца?
Решение: Составим уравнение диссоциации хромата натрия и нитрата свинца:
Na2CrO4 →2 Na+ + CrO42-
Pb(NO3)2→Pb2+ + 2NO3-
Следовательно, молярные концентрации ионов Pb2+ CrO42- совпадают с молярными концентрациями солей.
Составим уравнение диссоциации хромата свинца :
PbCrO4↓↔ Pb2++ CrO42-
ПР PbCrO4=[Pb2+]·[ CrO42-]=1,8·10-14.
Следовательно, [ CrO42-]=ПР PbCrO4/[Pb2+]=1,8·10-14/0,001=1,8·10-11моль/л.
С Na2CrO4=[ CrO42-]=1,8·10-11моль/л.
Пример 5. Выпадет ли осадок при сливании 100 мл фильтрата, оставшегося от осаждения иодида свинца , с 200 мл 0,1М раствора хромата натрия?
Решение:ПРPbI2=[Pb2+]·[I-]2=1,1·10-9.
Химическое равновесие в насыщенном растворе PbI2 описывается уравнением
PbI2↓↔Pb2++ 2I-
Если растворимость PbI2 равна х моль/л, то [Pb2+]=х моль/л, а [I-]=2х моль/л. Следовательно, ПРPbI2=х·(2х)2=4х3=1,1·10-9;
х=3√1,1·10-9/4=6,5·10-4моль/л.
После сливания растворов объем составит
V=100+200=300 мл,
а концентрация ионов Pb2+ уменьшится :
С ( PbI2) =6,5·10-4·100/300=2,17·10-4моль/л.
Соответственно уменьшится и концентрация иона CrO42-:
С (CrO42-)=0,1·200/300=0,067 моль/л.
Для ответа на вопрос о возможности выпадения осадка найдем произведение концентраций (ПС) ионов Pb2+ и CrO42- и сравним полученное значение с ПР (PbCrO4 )=1,8·10-14:
ПС=2,17·10-4·0,067=1,45·10-5>1,8·10-14.
следовательно, осадок не выпадет.
1.4. Расчет растворимости осадков в присутствии одноименных ионов.
Пример 6. Вычислить концентрацию ионов серебра в насыщенном растворе хлорида серебра, к 1 л которого прибавлено: а) 1·10-4 моль КСl ; б) 0,1 моль КСl.
Решение. а) Хлорид-ионы образуются при диссоциации хлорида серебра и при диссоциации хлорида калия. Тогда будем иметь:
[Ag+]·([Cl-]AgCl+[Cl-]KCl)=ПРAgCl=1,56·10-10
Так как [Ag+]=[Cl-]AgCl, то
[Ag+]2+[Cl-]KCl·[Ag+]-1,56·10-10=0
Подставляя значение концентрации KCl и решая квадратное уравнение, получим:
[Ag+]=-10-4/2+![]() =1,54·10-6моль/л.
=1,54·10-6моль/л.
б) В данном случае значение [Cl-]KCl существенно превышает величину
[Cl-]AgCl , поэтому величиной [Cl-]AgCl можно пренебречь. Тогда будем иметь [Ag+]· [Cl-]KCl=ПР AgCl=1,56·10-10;
[Ag+]= ПР AgCl/[Cl-]KCl=1,56·10-10/0,1=1,56·10-9моль/л.
1.5.Расчет растворимости осадка в присутствии разноименных ионов ( солевой эффект).
Пример 7. Вычислить растворимость хлорида серебра в 0,01М растворе Ca(NO3)2.
Решение. При решении данной задачи необходимо учитывать солевой эффект. Запишем ПРAgCl с учетом коэффициентов активности:
ПРAgCl=aAg+·aCl-=CAg+·fAg+·CCl-·fCl-.
Если обозначить концентрацию хлорида серебра через х моль/л, то можно записать ПРAgCl=х2·fAg+·fCl-.
Для нахождения коэффициентов активности рассчитаем ионную силу 0,1 моль/л раствора Ca(NO3)2.
Запишем уравнение диссоциации нитрата кальция:
Ca(NO3)2↔Ca2++2NO3-
Следовательно,
C(Ca2+)=C(Ca(NO3)2)
C(NO3-)=2C(Ca(NO3)2)
Таким образом,
I=1/2∑(Cizi2)=1/2(0,01·22+0,02·12)=0,03моль/л.
Коэффициент активности рассчитаем по формуле
![]() .
.
Рассчитанная величина f=0,771 для однозарядных ионов Ag+ и Cl- совпадает. Следовательно,
х=![]() /0,771=1,73·10-5моль/л.
/0,771=1,73·10-5моль/л.
Задачи для самостоятельного решения.
1.Вычислить произведение растворимости соли:
а) CaF2, если массовая концентрация насыщенного раствора соли составляет 0,017 г/л.
б)MgNH4PO4, если при анализе 1000мл насыщенного раствора найдено 7.9 мг этой соли.
в)BaCrO4, если массовая концентрация соли в насыщенном растворе составляет 2,7 мг/л.
г) BaCrO4, если 400 мл насыщенного раствора содержат 1,22·10-3г этой соли.
д) MgNH4PO4, если в 400 мл насыщенного раствора содержится 3,4 ·10-3г этой соли.
2.Рассчитать массовую концентрацию соли ВаСО3 в насыщенном растворе.
3.ПР(Са(РО4)2)=2,0·10-29, ПР(Се2(С2О4)3)=2,5·10-29. Вычислить массовую концентрацию катиона в насыщенном растворе каждой из этих солей.
4.Рассчитать массу Pb2+в 10мл насыщенного раствора PbI2, если ПР(PbI2=1,1·10-9.
5.Какая из двух солей более растворима и во сколько раз:
а)BaSO4 BaCO3?
б)PbSO4 PbI2 ?
в)AgCl Ag3PO4?
г)Ce2(C2O4)3 ZnCO3?
д)Ca3(PO4)2 CaCO3?
6.В каком насыщенном растворе и во сколько раз меньше содержится ионов серебра:
а)AgCl AgBr?
б)Ag2CrO4 Ag3PO4?
в)Ag2CO3 AgBO3?
7.ПР иодата серебра равно 3·10-8, а иодата бария—1,5·10-9. В каком из этих насыщенных растворов концентрация иодат-ионов больше и во сколько раз?
8.Образуется ли осадок при смешении:
а)равных объемов 10-3М растворов NaCl и AgNO3?
б)100мл 10-3М раствора PbSO4 и 200мл раствора NaI с концентрацией 0,15 г/л?
в)равных объемов 10-3М растворов SrCl2 и K2SO4?
г)насыщенного раствора CaSO4 с равным объемом раствора (NH4)2C2O4 с концентрацией 2,5·10-2г/л?
д)15мл 0,02М раствора хлорида бария с 5мл 0,01М раствора серной кислоты?
е)0,02н раствора хлорида кальция с равным объемом 0,02н раствора карбоната натрия?
ж)10мл 0,001н раствора хлорида стронция с 1мл 0,001М раствора хромата калия?
9.Вычислить массовую концентрацию насыщенного раствора хромата серебра в воде и в 0,01М растворе K2CrO4.
10.Вычислить молярную растворимость осадка CaC2O4 в 10-4М растворе (NH4)2C2O4.
11.Во сколько раз растворимость хромата бария в воде больше, чем в 0,01М растворе K2CrO4?
12.Во сколько раз растворимость CaC2O4 в 10-2М растворе (NH4)2C2O4 меньше, чем в воде?
13.Как изменится концентрация ионов серебра в литре насыщенного раствора хлорида серебра, если к нему прибавить равный объем 0,005н раствора соляной кислоты?
14. Во сколько раз растворимость оксалата кальция меньше в 0,002М растворе оксалата натрия , чем в воде?
15.сравнить растворимость оксалата кадмия в чистой воде и в 0,05М растворе оксалата натрия.
16.Как изменится растворимость оксалата кальция в воде по сравнению с растворимостью его в 0,1н растворе хлорида натрия?
17. По величине ПР вычислить растворимость хлорида серебра (г/л) в 0,1М растворе нитрата калия с учетом коэффициентов активности.
18.Как изменится растворимость карбоната кальция в воде по сравнению с растворимостью его в 0,1н растворе хлорида калия?
19.Как изменится растворимость сульфата бария в воде по сравнению с растворимостью его в 0,15н растворе иодида натрия?
20.Вычислить растворимость иодида серебра в 1М растворе нитрата алюминия.
21.Как изменится растворимость карбоната бария в воде по сравнению с растворимостью его в 0,3н растворе иодида калия?
22.Смесь 10мл 0,1М раствора хлорида натрия и 1мл 0,01М раствора бромида натрия довели водой до 10л и прибавили 1мл 0,01М раствора нитрата серебра. Будет ли образовываться осадок и какого состава? ПР(AgCl)=1,78·10-10, ПР(AgBr)=5,3·10-13.
23.При каком значении рН начнется образование осадка гидроксида марганца (2) из раствора, в котором концентрация хлорида марганца(2) равнв 10-2 моль/л? При каком значении рН осаждение гидроксида марганца можно считать полным? ПР(Mn(OH)2)=2·10-13.
24.При каком значении рН начнется образование осадка гидроксида алюминия из 2·10-2М раствора хлорида алюминия? ПР(Al(OH)3)=1·10-32.
25.К 10мл насыщенного раствора сульфата кальция прибавили 5мл насыщенного раствора сульфата бария. Определите концентрацию сульфат-ионов в полученном растворе. ПР(CaSO4)=2,5·10-5,ПР(ВаSO4)=1,1·10-10.
26.При получении осадка оксалата кальция к 1л 0,2М раствора хлорида кальция прибавили 400мл 0,2М раствора оксалата аммония. Сколько граммов кальция осталось неосажденными? ПР(CaC2O4)=2·10-9.
27.Как изменится величина ПР сульфата бария, если его растворимость при изменении температуры увеличится в два раза?
Окислительно-восстановительное равновесие.
