
- •По дисциплине « общая химия»
- •Тема №1. Основные классы неорганических соединений. Основные понятия и определения.
- •Названия важнейших кислот и их солей
- •Тема 2 Равновесие в растворах электролитов.
- •Одному ионно-молекулярному уравнению может соответствовать несколько молекулярных уравнений. Ионно-молекулярные уравнения реакций Контрольные задании:
- •Основные классы неорганических соединений Контрольные задании:
- •Тема № 3. Определение молярной массы эквивалента. Закон эквивалентов.
- •Основные понятия и определения.
- •Контрольные задания:
- •Тема № 4. Основные законы химии. Основные понятия и определения.
- •Моль. Закон Авогадро. Мольный объем газа. Контрольные задания:
- •Тема № 5. Строение атома.
- •Основные понятия и определения.
- •Характеристика квантовых чисел:
- •Контрольные задания:
- •Периодический закон и периодическая система элементов д.И. Менделеева. Контрольные задании:
- •Основные понятия и определения.
- •Свойства атомов элементов и периодичность их изменения:
- •Изменение кислотно – основных свойств гидроксидов элементов третьего периода:
- •Контрольные задания.
- •Периодический закон. Периодичность изменения свойств элементов. Контрольные задании:
- •Тема №6. Типы химической связи. Строение молекул. Виды гибридизации.
- •Основные понятия и определения:
- •Классификация типов химических связей:
- •Основные положения метода вс
- •Описание связей в гомоядерных двухатомных молекулах элементов второго периода по методу вс
- •Основные положения метода мо
- •Контрольные задания:
- •Тема № 7. Энергетика химических процессов. Термохимия. Определение тепловых эффектов.
- •Основные понятия и определения:
- •Контрольные задания:
- •Тема №8. Химическая кинетика. Химическое равновесие и способы его смещения.
- •Основные понятия и определения:
- •Химическое равновесие и способы его смещения. Контрольные задания:
- •Смещение химического равновесия
- •Влияние изменений условий на положение химического равновесия:
- •Химическое равновесие
- •Тема №9. Общие свойства растворов. Способы выражения концентрации растворов. Приготовление растворов заданной концентрации.
- •Основные понятия и определения:
- •Способы выражения концентраций:
- •Контрольные задания.
- •Тема №10. Коллигативные свойства растворов. Основные понятия и определения
- •Пример 1. Определите температуру замерзания раствора, содержащего 54 г глюкозы с6н12о6 в 250 г воды. Криоскопическая константа воды равна 1,86.
- •Контрольные задания.
- •Тема №11. Растворы электролитов. Равновесие в растворах электролитов. Ионное произведение воды (рН). Произведение растворимости (пр).
- •Основные понятия и определения:
- •Контрольные задания.
- •Ионное произведение воды
- •Тема №12. Гидролиз солей.
- •Основные понятия и определения:
- •Уравнения для расчета константы, степени гидролиза и рН растворов и гидролизующихся солей:
- •Пример 2. При смешивании растворов а12(sо4 )3 и Na2s каждая из взятых солей гидролизуется необратимо и до конца. Выразите этот совместный гидролиз ионно-молекулярным и молекулярным уравнениями.
- •Контрольные задания:
- •Тема 13.
- •Окислительно-восстановительные реакции. Метод
- •Полуреакций. Направление протекания овр.
- •Основные понятия и определения:
- •Окислители:
- •Восстановители:
- •Окислительно – восстановительные реакции Контрольные задания:
- •Тема №14.
- •Основные понятия и определения:
- •Электрохимические свойства металлов Контрольные задания:
- •Электрохимия Контрольные задания:
- •Электролиз. Контрольные задания:
- •Тема № 15. Комплексные соединения. Изомерия комплексных соединений. Константа нестойкости и константа устойчивости комплексных ионов.
- •Основные понятия и определения:
- •Лиганды:
- •Номенклатура комплексных соединений:
- •Спектрохимический ряд лигандов:
- •Виды изомерии комплексных соединений:
- •Тема № 16. Истоки химических знаний.
- •По дисциплине «общая химия»
- •230028, Г. Гродно, ул. Терешковой, 28
- •230028, Г. Гродно, ул. Терешковой, 28
Характеристика квантовых чисел:
|
Квантовые числа |
Возможные значения |
Число значений |
Определяют |
|
Главное n |
1,2,3… |
|
основной запас энергии электрона, размеры электронного облака, энергетический уровень |
|
Орбитальное l |
0,1,2,3… (n-1) |
n |
форму электронного облака, энергетический подуровень |
|
Магнитное m |
-1,…,0,…,+1 |
2l+1 |
Пространственную ориентацию электронного облака |
|
Спиновое s |
±1/2 |
2 |
Собственный момент количества движения электрона |
Последовательность заполнения электронами АО в соответствии с правилами Клечковского:
|
Тип орбитали |
Главное квантовое число n |
Орбитальное квантовое число l |
n + l |
|
Тип орбитали |
Главное квантовое число n |
Орбитальное квантовое число l |
n + l |
|
1s |
1 |
0 |
1 |
5p |
5 |
1 |
6 | |
|
2s |
2 |
0 |
2 |
6s |
6 |
0 |
6 | |
|
2p |
2 |
1 |
3 |
4f |
4 |
3 |
7 | |
|
3s |
3 |
0 |
3 |
5d |
5 |
2 |
7 | |
|
3p |
3 |
1 |
4 |
6p |
6 |
1 |
7 | |
|
4s |
4 |
0 |
4 |
7s |
7 |
0 |
7 | |
|
3d |
3 |
2 |
5 |
5f |
5 |
3 |
8 | |
|
4p |
4 |
1 |
5 |
6d |
6 |
2 |
8 | |
|
5s |
5 |
0 |
5 |
7p |
7 |
1 |
8 | |
|
4d |
4 |
2 |
6 |
|
|
|
|
Пример 1. Составьте электронную формулу атома элемента с порядковым номером 16. Покажите расположение электронов этого атома по энергетическим ячейкам.
Решение.
Электронные формулы отображают
распределение электронов в атоме по
энергетическим уровням, подуровням
(атомным орбиталям). Электронные
конфигурации обозначаются группами
символов n![]() х,
где n
– главное квантовое число,
х,
где n
– главное квантовое число,
![]() –орбитальное
квантовое число (вместо него указывают
соответствующее буквенное обозначение
s,
p,
d,
f),
х – число электронов в данном подуровне
(орбитали). При этом следует учитывать,
что электрон занимает тот энергетический
подуровень, на котором обладает наименьшей
энергией – меньшей суммой n+
–орбитальное
квантовое число (вместо него указывают
соответствующее буквенное обозначение
s,
p,
d,
f),
х – число электронов в данном подуровне
(орбитали). При этом следует учитывать,
что электрон занимает тот энергетический
подуровень, на котором обладает наименьшей
энергией – меньшей суммой n+![]() (правило Клечковского). Последовательность
заполнения энергетических уровней и
подуровней следующая:
(правило Клечковского). Последовательность
заполнения энергетических уровней и
подуровней следующая:
1s→2s→2p→3s→3p→4s→3d→4p→5s→4d→5p→6s→5d1→ →4f→5d→6p→7s→6d1-2→5f→6d→7p.
Так как число электронов в атоме того или иного элемента равно его порядковому номеру в таблице Менделеева, то для элемента № 16 (сера) электронная формула будет иметь вид: 1s22s22p63s23p4.
Электронная структура атомов может быть изображена также в виде схемы размещения электронов в квантовых (энергетических) ячейках, которые являются схематическими изображениями атомных орбиталей (АО), квантовую ячейку изображают в виде прямоугольника или линейки, а электроны в этих ячейках обозначают стрелками. В каждой квантовой ячейке может быть не более двух электронов с противоположными спинами ↑↓ (принцип Паули).
Орбитали данного подуровня заполняются сначала по одному электрону с одинаковыми спинами, а затем по второму электрону с противоположными спинами (правило Хунда).
Контрольные задания:
Напишите электронные формулы атомов фосфора и меди. Укажите, к какому электронному семейству относится каждый из элементов, и определите число протонов и нейтронов в ядре их атомов.
Укажите последовательность заполнения электронами атомных орбиталей 4d, 5s, 6s, 5р и сформулируйте правило, определяющее эту последовательность.
Напишите электронно- графические формулы атомов элементов с порядковыми номерами 15 и 27. определите число нейтронов и электронов в их атомов.
В соответствии с принципом Паули укажите максимальное число электронов на s-, р-, d-, f- подуровнях данного энергетического уровня.
Дайте определение понятия изотоп. Объясните причину нецелочисленных значений атомных масс большинства химических элементов. Вычислите атомную массу серебра, если известно, что массовые доли изотопов в природном серебре составляют соответственно
 -
40% и
-
40% и -
60%.
-
60%.Дайте определения понятия s-, р-, d-, f- элемент. Приведите примеры.
Энергетическое состояние электрона в атоме описывается четырьмя квантовыми числами n, l, m, s.укажите, какие значения может принимать каждое из них. Определите набор квантовых чисел для внешнего электрона атома натрия.
Составьте электронные формулы атомов элементов с порядковыми номерами 17 и 25. Укажите, к какому электронному семейству относится каждый из них. Приведите электронные и электронно - графические формулы атомов элементов II периода, которые могут иметь на р – подуровне один электрон, учитывая как основное, так и возбужденное состояние атома.
Укажите число квантовых d – орбиталей в основном состоянии у атомов элементов с порядковыми номерами 23, 42, 47, 49.
Составьте электронные формулы атомов элементов с порядковыми номерами 14, 25 и укажите, к какому электронному семейству они относятся.
Объясните физический смысл главного и орбитального квантовых чисел и укажите, какие значения они принимают.
Объясните физический смысл магнитного квантового числа и укажите, какие значения оно может принимать при данном числовом и буквенном значении орбитального квантового числа. Заполните таблицу:
|
|
m | |
|
Числовое значение |
Буквенное значение | |
|
0 |
s |
0 |
|
1 |
|
|
|
2 |
|
|
|
3 |
|
|
Напишите электронную формулу элемента, в атоме которого содержится один электрон на 3d – орбитали. Укажите период, группу и символ этого электрона.
Приведите формулы, позволяющие рассчитать электронную емкость энергетического уровня и подуровня, а также число орбиталей на данном уровне и подуровне.
Сформулируйте правило Клечковского. Определите порядок заполнения электронами орбиталей 3d, 4s, 4р, 5s, 5р.
Укажите период, группу и символ химического элемента, атому которого соответствует электронная формула: [Ne ] 3s2 3р6 3d5 4s2. К какому электронному семейству он относится?
Укажите возможные значения квантовых чисел для электронов второго и третьего энергетических уровней. Заполните таблицу:
n
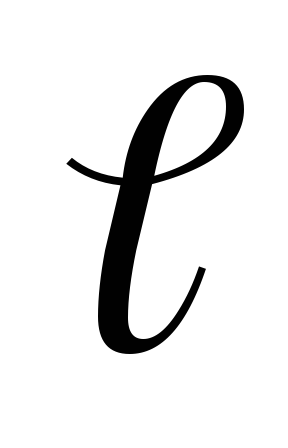
m
s
Укажите число протонов и нейтронов в ядре атома углерода, изотопа
 .
Напишите электронную формулу атома
углерода в основном и возбужденном
состояниях.
.
Напишите электронную формулу атома
углерода в основном и возбужденном
состояниях.Напишите электронные формулы атомов элементов с порядковыми номерами 8 и 24. Подчеркните валентные электроны и укажите, к какому электронному семейству относится каждый элемент.
Назвать элементы, имеющие по одному электрону на подуровне: а) 3d; б) 4d; в) 5d. Написать электронные формулы атомов этих элементов и указать их положение в периодической системе – период, группа и подгруппа.
Сколько свободных d-орбиталей имеется в атомах титана и ванадия? Написать для них электронно-графическую структуру d-подуровня.
Назвать элементы 4-го периода, атомы которых содержат наибольшее число непарных d-электронов. Написать электронно-графическую структуру их d-подуровня.
Написать электронно-графические формулы атомов индия, германия и титана в нормальном и возбужденном состоянии.
У элементов каких периодов электроны внешнего слоя характеризуются значением n + l = 5?
Указать порядковый номер элемента, у которого: а) заканчивается заполнение электронами орбиталей 4d; б) начинается заполнение подуровня 4р.
Сколько вакантных 3d-орбиталей имеют возбужденные атомы: а) Сl; б) V; в) Mn?
Среди приведенных ниже электронных конфигураций указать невозможные и объяснить причину невозможности их реализации: а) 1р3; б) 3р6; в) 3s2; г) 2s2; д) 2d5; е) 5d2; ж) 3f12; з) 3p7.
Написать электронные формулы атомов элементов четвертого периода – калия, марганца, криптона. К какому семейству элементов они относятся?
Написать электронные формулы атомов элементов четвертого периода – скандия, цинка, мышьяка. К какому семейству элементов они относятся?
Назвать элементы 4, 5 и 6-го периодов, у которых заканчивается заполнение d-орбиталей (3d10, 4d10 и 5d10). Написать электронные формулы атомов этих элементов и указать, к какому периоду, группе и подгруппе периодической системы они относятся.
Запишите общую сокращенную электронную конфигурацию галогенов.
Сколько валентных электронов у атома фосфора?
Запишите полную электронную конфигурацию атома марганца. К семейству каких элементов он относится?
К какому семейству элементов относится группа элементов, имеющая общую сокращенную конфигурацию ns2np2?
Структура валентного электронного уровня атома элемента выражается формулой: a) 5s25p4;
б) 3d54s1. Определите порядковый номер и название элемента.
Какое максимальное число электронов может содержать атом на электронном уровне с главным квантовым числом n = 5 и n = 3?
Напишите электронные формулы атомов элементов с порядковыми номерами 24 и 33. Составьте их графические схемы. К какому электронному семейству относится каждый из них, почему?
Сколько неспаренных электронов содержат невозбужденные атомы В, S, Сr? Составьте их электронные и графические схемы.
Составьте электронные формулы атомов элементов с порядковым номером 32 и 42. У последнего один 5s-электрон проваливается на 4d-подуровень. К какому электронному семейству они относятся?
Какой подуровень заполняется в атомах после заполнения 5p-подуровня; после заполнения 5d-подуровня, почему?
Какие из электронных формул, отражающих строение невозбужденного атома некоторого элемента, неверны: а) 1s22s22p53s1; б) 1s22s22p6; в) 1s22s22p63s23p63d4;г) 1s22s22p63s23p64s2; д) 1s22s22p63s23d2? Почему?
Запишите электронные формулы атомов элементов с зарядом ядра 8; 13 и 18. Составьте графические схемы.
Какое максимальное количество электронов может располагаться в s-, p-, d- и f-подуровнях данного уровня? Почему? Напишите электронную структуру атома с порядковым номером 29.
Электронная структура атома описывается формулой 1s22s22p63s23p64s2. Какой это элемент? Составьте его графическую схему.Какое максимальное число электронов может содержать атом на электронном уровне с главным квантовым числом n = 5 и n = 3? Ответ мотивируйте.
Напишите электронные формулы атомов элементов с порядковыми номерами 24 и 33. Составьте их графические схемы. К какому электронному семейству относится каждый из них, почему?
