
- •Міністерство освіти і науки України
- •Частина 3 Розділ 1. Атом водню. Основні формули
- •Приклади розв’язування задач
- •Елементи квантової механіки Основні формули
- •3. Часове рівняння Шредінгера має вигляд
- •Приклади розв’язування задач
- •Розділ 2. Молекулярно-кінетична теорія ідеального газу Основні формули
- •Приклади розв’язання задач
- •Елементи термодинаміки Основні формули
- •Приклади розв’язання задач
- •Розділ 3. Фізика твердого тіла Основні формули
- •Приклади розв’язання задач
- •Розділ 4. Фізика атомного ядра Основні формули
- •Приклади розв’язування задач
- •Основна література:
- •Додаткова лытература:
- •Деякі відомості з математики
- •2. Довідкові дані
- •3. Приставки, що служать для утворення кратних одиниць сі
- •4. Властивості деяких твердих тіл
- •5. Діелектрична проникність деяких речовин
- •6. Електричні властивості матеріалів при 20°с
- •7. Робота виходу а електронів з металу, еВ
- •21021, М. Вінниця, Хмельницьке шосе, 95, внту
Приклади розв’язання задач
Приклад 1. Визначити число молекул, які містяться в об'ємі 1 мм3 води, і масу молекули води. Знайти також діаметр молекул. Вважати умовно, що молекули води мають вигляд кульок, які щільно дотикаються одна до одної.
Дано:
H2O
V= 1 мм3 = 10-9м3
______________
N - ? m1 - ? d - ?
Розв’язування. Число N молекул, які втримуються в деякій системі масою m, дорівнює добутку постійної Авогадро NA на кількість речовини
![]()
Оскільки = m/, де - молярна маса, то N = (m / ) NA. Виразивши в цій формулі масу як добуток густини на об'єм V, одержимо
![]() ( 1)
( 1)
Виконаємо обчислення, врахувавши, що = 18 . 10-3 кг/моль,
= 1,0.103 кг/м3
![]() молекул.
молекул.
Масу m1 однієї молекули можна знайти за формулою
![]() (
2)
(
2)
Підставивши в (2) значення і NA , знайдемо масу молекули води
![]() кг.
кг.
Якщо молекули води щільно прилягають одна до одної, то можна вважати, що на кожну молекулу приходиться об'єм V1 = d3, де d - діаметр молекули. Звідки
![]() (
3)
(
3)
Об'єм V1
знайдемо, розділивши об'єм моля
![]() на число молекул у молі, тобто на NА
на число молекул у молі, тобто на NА
![]() (
4)
(
4)
Підставивши вираз (4) в (3), одержимо
![]() ,
,
де V![]() =
/ .
=
/ .
Тоді
![]() .
( 5)
.
( 5)
Зробимо необхідні розрахунки
![]() .
.
Приклад 2. Знайти масу сірчистого газу (SO2), який займає об'єм 25 л при температурі 270С і тиску 101 кПа.
Дано:
SO2
V = 25 л = 25.10-3 м3
t = 270C
P = 101 кПа = 1,01.105 Па
___________________
m - ?
Розв’язування. З рівняння Клапейрона маса газу дорівнює
![]() .
.
Визначаємо молярну
масу сірчистого газу за даними таблиці
Менделєєва
![]() і абсолютна температура T = t + 2730
= 270
+ 2730
= 3000
K.
і абсолютна температура T = t + 2730
= 270
+ 2730
= 3000
K.
Обчислюємо масу
![]() кг.
кг.
Приклад 3. Балон містить 80 г кисню й 300 г аргону. Тиск суміші 10 атм, температура 150С. Приймаючи дані гази за ідеальні, визначити ємність балона.
Дано:
O2
m1 = 80 г = 8.10-2кг
Аr
m2 = 300 г = 3.10-1кг
t = 150C
P = 10 атм = 1,01.106 Па
_____________________
V - ?
Розв’язання. За законом Дальтона тиск суміші дорівнює сумі парціальних тисків газів, що входять до складу суміші. Парціальним тиском газу називається тиск, який здійснював би газ, якби тільки він один перебував у посудині, зайнятій сумішшю.
З рівняння Клапейрона парціальні тиски кисню p1 й аргону p2 виражаються формулами
![]() і
і
![]()
Отже, за законом Дальтона для суміші газів p = p1 + p2 або
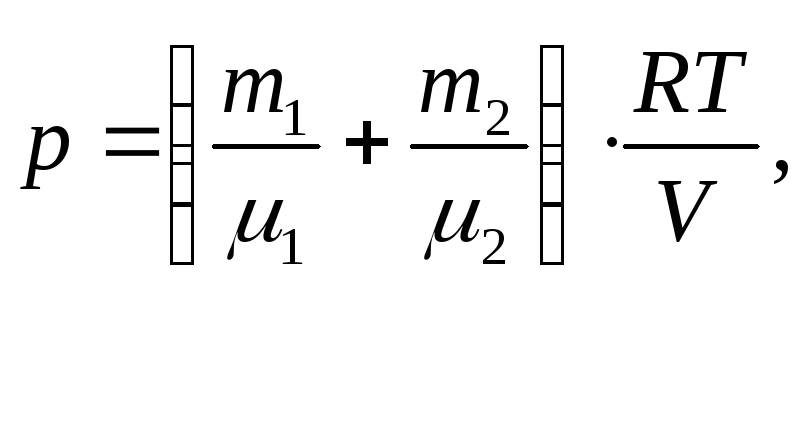
звідки об’єм балона дорівнює
![]() (
1)
(
1)
Виразимо в одиницях СІ числові значення величин, які входять у цю формулу: m1 = 80 г = 0,08 кг; 1 = 32.10-3 кг/моль; m2 = 300 г = 0,3 кг; 2 = 40.10-3 кг/моль; p = 10 атм = 10.1,01.105 Па; T = 150 + 2730 = 288K; R = 8,31 Дж / (моль. К).
Підставимо числові значення у формулу (1) і виконаємо необхідні розрахунки
![]()
Приклад 4. Знайти кінетичну енергію обертального руху однієї молекули кисню при температурі 130С, а також кінетичну енергію обертального руху всіх молекул, які містяться в 4 г кисню.
Дано:
O2
m = 4 г = 4.10-3 кг
t = 130C
_____________
об - ? Wоб - ?
Розв’язання. Відомо, що на кожну ступінь вільності молекули газу припадає однакова енергія, яка виражається формулою
![]() (
1)
(
1)
де k - стала Больцмана;
T- абсолютна температура газу.
Оскільки обертальному руху двохатомної молекули (молекула кисню - двохатомна) приписуються дві ступені вільності, то енергія обертального руху молекули кисню виразиться формулою
![]() (
2)
(
2)
Підставивши у формулу (2) k = 1,38 . 10-23 Дж/К й T = 130 + 2730 = 286 K, одержимо
![]() Дж.
Дж.
Кінетична енергія обертального руху всіх молекул газу визначається з рівності
![]() ,
( 3)
,
( 3)
де N - число всіх молекул газу.
Число молекул N можна одержати за формулою
![]() (
4)
(
4)
де NA - число Авогадро;
- число молів газу.
Число молів газу дорівнює
![]()
де m - маса газу;
![]() - маса одного моля
газу,
- маса одного моля
газу,
Кількість молекул газу визначається із формули (4)
![]() (
5)
(
5)
Підставивши цей вираз N у рівність (3), одержимо
![]() (
6)
(
6)
Виразимо величини, що входять у цю формулу, в одиницях СІ:
![]() моль-1;
моль-1;
![]() кг;
кг;![]() кг/моль;
кг/моль;![]() Дж.
Дж.
Підставивши ці значення у формулу (6), знайдемо
![]()
Приклад 5. На якій висоті над рівнем моря густина повітря зменшується у 2 рази? Вважати, що температура повітря не залежить від висоти й дорівнює 00С. Молярна маса повітря дорівнює 29.10-3 кг/моль.
Дано:
1/ 2 = 2
t = 00C
__________
h - ?
Розв’язання. Густина ідеального газу і його концентрація n зв'язані співвідношенням
= nm0 ,
де m0 = / NA - маса однієї молекули повітря;
- молярна маса повітря;
NA - число Авогадро.
Таким чином, відношення густин газу 1/2 дорівнює відношенню концентрацій молекул n1/n2. Відповідно до розподілу Больцмана концентрація n молекул повітря на висоті h дорівнює
![]() ,
,
де n0 - концентрація молекул на рівні моря (h = 0);
Un - потенціальна енергія молекули на висоті h визначається за формулою Un = m0gh (якщо h = 0 то Un= 0) .
Концентрації молекул на висоті h = 0 і h відповідно дорівнюють
n1
= n0
й
n2
= n0
e![]() .
.
Відношення концентрацій на цих висотах дорівнює
 ,
,
де NAk
= R і
NAm0
=
![]() .
.
Беремо натуральний логарифм від обох частин відношення й знаходимо висоту h
![]()
Підставивши в отриману формулу дані з умови задачі, одержимо
h
=
![]() = 5,5.103м.
= 5,5.103м.
