
Лабораторная работа № 53
ИЗУЧЕНИЕ СПЕКТРОВ ИЗЛУЧЕНИЯ АТОМОВ,
МОЛЕКУЛ И ТВЁРДЫХ ТЕЛ
Цель работы:
1. Ознакомиться с характером спектров излучения атомов химических элементов, молекул и твердых тел.
2. Изучить закономерности расположения спектральных серий и спектральных линий в спектре атома водорода.
3. Изучить устройство монохроматора УМ-2 и порядок работы с ним.
4. Снять спектры излучения различных газов и паров, молекул, а также твёрдых тел.
Теоретическое введение
О птическим
спектром
называется
распределение по частотам (или длинам
волн) интенсивности оптического излучения
некоторого тела (спектр испускания) или
интенсивности поглощения при его
прохождении через вещество (спектр
поглощения). Спектры делятся на три вида
– линейчатые, полосатые и сплошные
(рис.1, 2).
птическим
спектром
называется
распределение по частотам (или длинам
волн) интенсивности оптического излучения
некоторого тела (спектр испускания) или
интенсивности поглощения при его
прохождении через вещество (спектр
поглощения). Спектры делятся на три вида
– линейчатые, полосатые и сплошные
(рис.1, 2).

Линейчатые спектры излучают вещества в атомарном состоянии. Линейчатые спектры излучения выглядят как цветные линии, разделенные тёмными промежутками (рис. 1а, 2а). Атомы всех веществ излучают свойственные только им наборы волн вполне определенных частот.
Полосатые спектры излучаются молекулами. Выглядят полосатые спектры подобно линейчатым, только вместо отдельных линий наблюдаются отдельные серии линий, воспринимаемые как отдельные полосы (рис. 1б, 2б).
Сплошные спектры излучают вещества, находящиеся в твёрдом состоянии. Сплошной спектр содержит волны всех частот видимого света и поэтому выглядит как цветная полоса с плавным переходом от одного цвета к другому в следующем порядке: красный, оранжевый, желтый, зеленый, голубой, синий, фиолетовый (рис. 1в, 2в).
Задолго до создания квантовой теории атомов, в 1885 г., швейцарский физик И. Бальмер подобрал эмпирическую формулу, определяющую закономерность расположения спектральных линий атома водорода в видимой области:
![]()
, (1)
где R - постоянная Ридберга, R = 1,1∙10 7 м -1 ,
n – целые числа, (n > 2), то есть n = 3, 4, 5, ...
Это открытие послужило толчком для обнаружения других серий в спектре атома водорода – серии Лаймана в ультрафиолетовой области, серии Пашена в инфракрасной области и других. Физический смысл наблюдающихся закономерностей был установлен квантовой физикой.
Началом квантовой физики считается открытие квантования энергии, введённое нем. физиком Планком для объяснения характера спектра теплового излучения (рис. 1в). Формула Планка энергии кванта
E = hν, (2)
где ν - частота испускаемого кванта света,
h - постоянная Планка; h = 6,63 ∙10 -34 Дж∙с,
является одной из основных в квантовой физике. Дальнейшее развитие квантовая физика получила в планетарной модели атома Резерфорда и в теории Бора, постулирующей дискретный характер энергии электрона в атоме (постулат стационарных орбит). Энергия hν испущенного фотона в соответствии со вторым постулатом Бора равна разности энергий электрона в соответствующих состояниях:
hνnk = En - Ek, (3)
где En , Ek - энергия электрона атома в состояниях n и k соответственно.
Именно этим и объясняется линейчатый характер спектров излучения атомов.
Из теории Бора выводится формула Бальмера для всех серий. При этом в формуле (1) вместо цифры 2 (номер серии Бальмера и соответственно номер уровня, на который электрон переходит с более высоких уровней) следует подставить целое число m (m = 1 - для серии Лаймана, 3 - для серии Пашена, 4 - для серии Брэкетта и т.д.). Таким образом, значение m устанавливает номер серии, а значения n – номера линий в серии. Далее, в теории Бора устанавливается, что постоянная Ридберга представляет собой комбинацию физических констант:
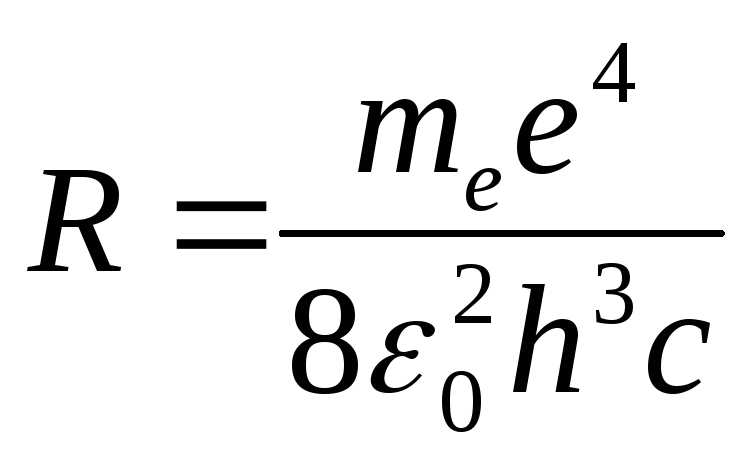
, (4)
где e - заряд электрона; e = 1,6∙10 -19 Кл,
me - масса электрона; me = 9,1∙10 -31 кг,
εо - электрическая постоянная; εо = 8,85∙10 -12 Ф/м.
Э то
совпадение убедительно подтвердило
правильность гипотезы Бора о квантовании
энергии электрона в атоме. Следовательно,
по теории Бора, количественно объяснившей
спектр атома водорода, спектральные
серии соответствуют излучению,
возникающему в результате перехода
атома в данное состояние из возбуждённых
состояний, расположенных выше данного
(рис. 3). Элементы резко отличаются друг
от друга по сложности своего спектра.
Например, в спектре лития наблюдается
всего несколько десятков линий, а в
спектрах вольфрама или железа известно
около 5000 линий. Спектры атомов химических
элементов приводятся в специальных
атласах [5].
то
совпадение убедительно подтвердило
правильность гипотезы Бора о квантовании
энергии электрона в атоме. Следовательно,
по теории Бора, количественно объяснившей
спектр атома водорода, спектральные
серии соответствуют излучению,
возникающему в результате перехода
атома в данное состояние из возбуждённых
состояний, расположенных выше данного
(рис. 3). Элементы резко отличаются друг
от друга по сложности своего спектра.
Например, в спектре лития наблюдается
всего несколько десятков линий, а в
спектрах вольфрама или железа известно
около 5000 линий. Спектры атомов химических
элементов приводятся в специальных
атласах [5].
Молекулярные спектры значительно сложнее и многообразнее, чем атомные, так как строение молекулы более сложно, чем строение атома. У молекул имеют место ещё два вида движения, которых вообще нет в атомах. Это колебание отдельных атомов относительно положения равновесия и вращение всей молекулы вокруг оси подобно волчку. Оба эти движения приводят к появлению колебательных и вращательных уровней. Полная энергия изолированной молекулы
EΣ = Еэ + Ек + Евр, (5)
где Еэ – энергия движения электронов относительно ядер,
Ек – энергия колебательного движения атомов,
Евр – энергия вращательного движения молекулы.
При этом Еэ > Ек > Евр (рис. 4). Частоты спектральных линий, испускаемых молекулами, могут соответствовать переходам с одного электронного уровня на другой (электронные спектры) или с одного колебательного (вращательного) уровня на другой (колебательные (вращательные) спектры). Корме того, возможны комбинации этих переходов, дающие электронно-колебательные и колебательно-вращательные спектры. Поэтому спектр молекул весьма сложный и состоит из групп настолько тесно расположенных линий, что линии в группах сливаются в полосы (рис. 1б, 2б).
Н а
индивидуальности спектров атомов и
молекул основан способ определения
химического состава вещества методом
изучения их спектров. Этот способ
называется спектральным анализом.
а
индивидуальности спектров атомов и
молекул основан способ определения
химического состава вещества методом
изучения их спектров. Этот способ
называется спектральным анализом.
Спектральный анализ открыли в 1860 г. немецкие физики Г. Кирхгоф и Р. Бунзен. Они установили, что спектр пламени газовой горелки зависит только от введённого металла, причём спектр каждого металла строго постоянен. Обнаружив в спектрах некоторых образцов новые незнакомые линии, они открыли новые химические элементы – рубидий (rubidus – красный) и цезий (ceasius – голубой). Позже другие исследователи открыли ещё четыре новые элемента: таллий, индий, галлий и гелий, причём гелий был впервые обнаружен при изучении спектра Солнца и только спустя четверть века был обнаружен на Земле.
Спектральный анализ широко применяется в науке и технике, например, для определения химического состава звезд, атмосферы планет, в геологии, химической, нефтеперерабатывающей, металлургической, машиностроительной, фармацевтической и других отраслях промышленности, в экологии для контроля объектов окружающей среды (воды, воздуха, почв). Чувствительность спектрального анализа очень высока – достигает 10-5 – 10-6 %. Для спектрального анализа характерна высокая избирательность. Это означает, что каждое вещество может быть определено качественно и количественно в образце сложного состава без его разделения на отдельные компоненты.
Атомный спектральный анализ определяет элементный состав образца по атомным (ионным) спектрам испускания и поглощения; молекулярный спектральный анализ определяет состав вещества по молекулярным спектрам поглощения, люминесценции и комбинационного рассеяния света.
Р азложение
излучения источников света в спектр
осуществляется с помощью специальных
оптических приборов – спектральных
аппаратов, в которых световые лучи с
разными длинами волн отделяются в
пространстве друг от друга. Спектральные
аппараты устроены таким образом, что
световые колебания каждой длины волны,
попадающие в прибор, образуют одну
линию. Сколько различных длин волн
присутствовало в излучении источника
света, столько линий получается в
спектральном аппарате.
азложение
излучения источников света в спектр
осуществляется с помощью специальных
оптических приборов – спектральных
аппаратов, в которых световые лучи с
разными длинами волн отделяются в
пространстве друг от друга. Спектральные
аппараты устроены таким образом, что
световые колебания каждой длины волны,
попадающие в прибор, образуют одну
линию. Сколько различных длин волн
присутствовало в излучении источника
света, столько линий получается в
спектральном аппарате.
Современные спектральные приборы оснащены компьютерными базами данных, позволяющими значительно ускорить анализ содержания веществ по их спектрам (рис. 5). При этом на экран монитора выводятся спектр исследуемого вещества и наиболее близкие спектры нескольких веществ.
