
- •Министертсво образования и науки рф
- •Контрольная работа 2.1 «Химическая кинетика и равновесие»
- •2.1.1. Химическая кинетика
- •«Химическая кинетика»
- •2.1.2. Химическое равновесие Теоретические пояснения
- •«Химическое равновесие»
- •Контрольная работа 2.2 «Растворы»
- •II. Концентрационный способ:
- •Примеры решения задач.
- •Перечень контрольных задач по теме 2.2. «Растворы»
- •Литература
2.1.2. Химическое равновесие Теоретические пояснения
Понятие «химическое равновесие» применимо только к обратимым реакциям. Химическим равновесием называют такое состояние реагирующей системы, при котором скорость прямой реакции Vпрямая равна скорости обратной реакции Vобратная . Равенство скоростей прямой и обратной реакций является кинетическим условием химического равновесия.
Химическое равновесие характеризуется постоянным для данных условий соотношением равновесных концентраций всех веществ, участвующих во взаимодействии.
Величина, равная отношению произведения равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных веществ в степенях их стехиометрических коэффициентов, называется константой равновесия. Если в выражении константы равновесия концентрации веществ приведены в моль/л, то такая константа называется Кс. Когда реагирующие вещества находятся в газовой фазе, то можно концентрацию заменить на парциальные давления этих веществ. Константа равновесия, в которой концентрации реагирующих веществ представлены парциальными давлениями этих веществ называется Кр.
Для
обратимой реакции Н2(г)
+ I2(г)
![]() 2HI(г)
константа равновесия имеет вид:
2HI(г)
константа равновесия имеет вид:
Kc
=

Для
обратимой реакции синтеза аммиака
N2+3H2![]() 2NH3,
константа равновесия имеет вид:
2NH3,
константа равновесия имеет вид:
Kc
=

Константа равновесия зависит от природы реагентов, температуры и не зависит от исходной концентрации веществ в системе.
Химическое равновесие остается неизменным до тех пор, пока постоянны параметры, при которых оно установилось. При изменении условий равновесие нарушается. Через некоторое время в системе вновь наступает равновесие, характеризующееся новым равенством скоростей и новыми равновесными концентрациями всех веществ.
Равновесие смещается в ту или иную сторону потому, что изменение условий по-разному влияет на скорости прямой и обратной реакций. Равновесие смещается в сторону той реакции, скорость которой при нарушении равновесия становится больше. Например, если при изменении внешних условий равновесие нарушается так, что скорость прямой реакции становится больше скорости обратной реакции, то равновесие смещается вправо.
В общем случае направление смещения равновесия определяется принципом Ле Шателье: если на систему, находящуюся в равновесии , оказывать внешнее воздействие, то равновесие смещается в том направлении, которое ослабляет эффект внешнего воздействия.
Необходимый уровень подготовки студентов
Знать понятия: химическое равновесие, константа химического равновесия, принцип Ле – Шателье.
Уметь на основе принципа Ле-Шателье предсказывать направление смещения химического равновесия при оказании на систему внешнего воздействия.
Литература
Романцева Л.М., Лещинская З.Л, Суханова В.А. Сборник задач и упражнений по общей химии - М.: Высш. шк., 19991.-с. 74-100.
Коровин Н.В. Общая химия .-М.:Высш. шк., 2000, -с. 116-203
Глинка Н.Л. Общая химия - Л.: Химия. 1985, -с.184-187.
Примеры решения задач
Задача
1. При
синтезе аммиака N2
+3H2
![]() 2NH3
равновесие
установилось при следующих концентрациях
реагирующих веществ (моль/л):
2NH3
равновесие
установилось при следующих концентрациях
реагирующих веществ (моль/л):
![]() =
2,5;
=
2,5;
![]() =
1,8;
=
1,8;![]() =
3,6. Рассчитайте константу равновесии
этой реакции и исходные концентрации
азота и водорода,
=
3,6. Рассчитайте константу равновесии
этой реакции и исходные концентрации
азота и водорода,
Решение. Определяем константу равновесия КС этой реакции:
Kc
=
 =
(3,6)2/
2,5 (1,8)3
= 0,89
=
(3,6)2/
2,5 (1,8)3
= 0,89
Исходные концентрации азота и водорода находим на основе уравнения реакции. На образование 2 моль NH3,, расходуется 1 моль азота, а на образование 3,6 моль аммиака потребовалось З,6/2 = 1,8 моль азота. Учитывая равновесную концентрацию азота, находим его первоначальную концентрацию:
Сисх (Н2) = 2,5 + 1,8 = 4,3 моль/л
На образование 2 моль NH3 необходимо израсходовать 3 моль водорода, и для получения 3,6 моль аммиака требуется 3х3,6/2=5,4 моль; Сисх(Н2) = 1,8 + 5,4 = 7,2 моль/л.
Таким образом, реакция начиналась при концентрациях (моль/л): С(N2) = 4.3; C (H2) = 7,2
Задача 2. Объемный состав реакционной смеси в момент равновесия для реакции 2СО2 = 2СО+О2 был следующий: 88,72 % СО2; 7,52 % СО; 3,76 % О2. Найдите Кр для реакции, если общее давление в системе при данной температуре (2273 К) равно 1,0133 • 105 Па,
Решенне. Для реакций, протекающих между газами, при вычислении константы равновесия удобно пользоваться парциальным давлениями реагирующих веществ. Константу равновесия Кр - вычисляют через парциальные давления:
Кр
=
 (1)
(1)
Определив парциальные давления реагирующих веществ:
![]() =
1,0133
=
1,0133![]() 105
105
![]() 0,8872= 0,8990 х 105
Па;
0,8872= 0,8990 х 105
Па;
РСО
=1, 0133
![]() 105•0,0752
=0,0762 х 106
Па;
105•0,0752
=0,0762 х 106
Па;
![]() 1,0133
1,0133![]() 105
105
![]() 0,0376=
0,0381.105
Па,
0,0376=
0,0381.105
Па,
Подставив соответствующие значения парциальных давлений СО2, СО и О2 в выражение 1 получим Кр = 27,35 Па.
Задача
3. Реакция
протекает по уравнению А+В![]() 2С.
Определите равновесные концентрации
реагирующих веществ, если исходные
концентрации веществ А и В соответственно
равны 0,5 и 0,7 моль/л, а константа равновесия
реакции КС
=50.
2С.
Определите равновесные концентрации
реагирующих веществ, если исходные
концентрации веществ А и В соответственно
равны 0,5 и 0,7 моль/л, а константа равновесия
реакции КС
=50.
Решение. К моменту равновесия концентрации веществ А и В понизятся, а концентрация вещества С увеличится. На каждый моль веществ А и В образуется 2 моль вещества С; поэтому, если понижение концентрации веществ А и В обозначить через Х моль, то увеличение концентрации вещества С будет равно 2Х моль.
Равновесные концентрации реагирующих веществ будут: СА= (0,5- х) моль/л; СВ = (0,7-х)моль/л; СС = 2х моль/л.
Кс = С2 С /САСВ = 4х2/(0,5 –х) ( 0,7-х) =4х2 / (0,35 – 1,2х + х2) = 50;.
Решая
это уравнение, получаем: х1
= 0,86; х2
= 0,44. Так
как, исходные концентрации веществ А и
В были 0,5 и 0,7 моль/л соответственно, то
их конверсия (превращение или расход)
не может быть выше этих величин.
Следовательно, по условию задачи
справедливо значение х2.
Отсюда равновесные концентрации
реагирующих веществ равны: СА=0,5
- 0,44 = 0,06 моль/л; СВ
= 0,7- 0,44 =
0,26 моль/л; СС
= 0,44![]() 2
= 0,88 моль/л.
2
= 0,88 моль/л.
Задача 4: 4. Рассчитайте константу равновесия реакции
С25Н2807
+ НС1
![]() С25Н27О6С1
+ Н2O
С25Н27О6С1
+ Н2O
если
для ее проведения смешали 12 мл 10-2М
раствора С25Н2807
и 15 мл 10-2М
раствора НС1. Полученную смесь разбавили
водой до 50 мл. Равновесная концентрация
С25Н27О6С1
оказалась равной 2,03![]() 10-3
моль/л.
10-3
моль/л.
Решение: Вычислим количество исходных и конечных веществ до и после реакции. Известно, что количество вещества определяется как произведение молярной концентрации (моль/л) и объема раствора (в литрах). Тогда имеем:
![]() о(С25Н2807)=12
о(С25Н2807)=12![]() 10-3
10-3![]() 10-2=1,2
10-2=1,2![]() 10-4моль,
и
10-4моль,
и
![]() о
(НСl)=15
о
(НСl)=15![]() 10-3
10-3![]() 10-2=1,5
10-2=1,5![]() 10-4
моль.
10-4
моль.
![]() (С25Н27О6С1)
= 50
(С25Н27О6С1)
= 50![]() 10-3
10-3![]() 2,03
2,03![]() 10-3=1,015
10-3=1,015![]() 10-4
моль.
10-4
моль.
Если
образовалось продукт, в количестве
1,015![]() 10-4
моль, то в
соответствии с реакцией, столько же
было израсходовано соляной кислоты и
С25Н2807.
Следовательно, в равновесной смеси,
концентрация исходных веществ составит:
СМ(С25Н2807)=
10-4
моль, то в
соответствии с реакцией, столько же
было израсходовано соляной кислоты и
С25Н2807.
Следовательно, в равновесной смеси,
концентрация исходных веществ составит:
СМ(С25Н2807)=
![]() и СМ(НСl)=
и СМ(НСl)=
![]() .
Константу равновесия считаем по уравнению
КС=
.
Константу равновесия считаем по уравнению
КС=
![]() =
=![]()
Задача
5: Константа
химического равновесия реакции С2H6(г)
![]() С2Н4(г)+
Н2(г)
при 1500К равна 38,4. Определить направление
реакции, если в начале реакции парциальные
давления в газовой смеси компонентов
составляли: этана - 0,06Мпа, этилена - 0,02
Мпа и водорода 0,01 МПа.
С2Н4(г)+
Н2(г)
при 1500К равна 38,4. Определить направление
реакции, если в начале реакции парциальные
давления в газовой смеси компонентов
составляли: этана - 0,06Мпа, этилена - 0,02
Мпа и водорода 0,01 МПа.
Решение: В этой задаче приведены парциальные давления реагирующих компонентов смеси. Поэтому, в данном случае следует пользоваться выражение Кр.
Кр=
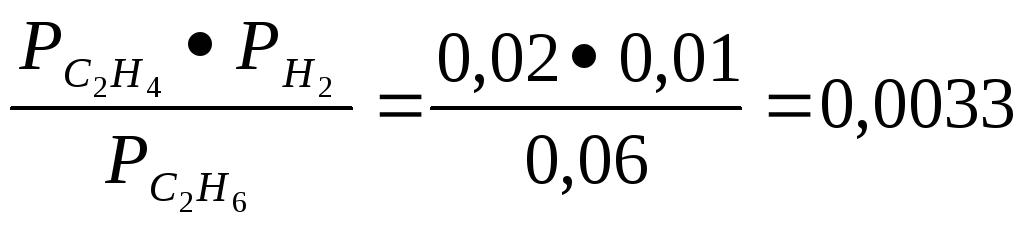
Как видно, расчет значения Кр по исходным показателям давления реагирующих газов дает значения, намного меньше, чем значения константы равновесия (38,4). Это означает, что в результате химических превращений, давления реагирующих газов изменились таким образом, что их отношение приводит к увеличению дроби. Такая ситуация возможна, если возраст числитель, при этом уменьшится знаменатель. То есть, в реакционной среде должно быть увеличено давление этилена и водорода, и уменьшено давление этана. Такая ситуация возможна, если в ходе реакции будет израсходован этан (знаменатель) в результате чего будут возрастать давление водорода и этилена. Это означает, что реакции направлена слева на право, то есть реакция идет в сторону разложения этана с образованием водорода и этилена.
Перечень контрольных задач по теме 2.1.2
