
2. Химическая коррозия
Химическая коррозияпредставляет собой самопроизвольное разрушение металла в среде окислительного газа (например, кислорода, галогенов) при повышенных температурах или в жидких неэлектролитах. Сущность процессов химических коррозии сводится к окислительно-восстановительной реакции, осуществляемой непосредственным переходом электронов металла к окислителю.
Химическая газовая коррозия обычно протекает при высоких температурах в газах и парах агрессивных веществ, когда исключена возможность их конденсации на поверхности металла, и поэтому ее часто называют высокотемпературной газовой коррозией. Это коррозия лопаток турбин, сопел ракетных двигателей, элементов электронагревателей, а также коррозия в процессах термической обработки в металлургической промышленности (при горячей прокатке, закалке, ковке). К коррозионным газовым агентам относятся O2, H2O, CO2, SO2, H2S, Cl2 и др.
Термодинамика газовой коррозии.
Рассмотрим химическую коррозию в газах (газовую коррозию), в частности, коррозию в атмосфере кислорода. Уравнение реакции окисления металла кислородом можно записать в виде:
m
Me(тв)
+
![]() O2(г)
O2(г)
![]() MemOn(тв)
(1)
MemOn(тв)
(1)
Константа равновесия реакции (1) имеет вид:
Kp
=
![]() ( 2) ,
( 2) ,
где
![]() - равновесное парциальное давление
кислорода. Кр
связана с изменением энергии Гиббса [
] следующим уравнением:
- равновесное парциальное давление
кислорода. Кр
связана с изменением энергии Гиббса [
] следующим уравнением:
![]() =
=
![]() =
=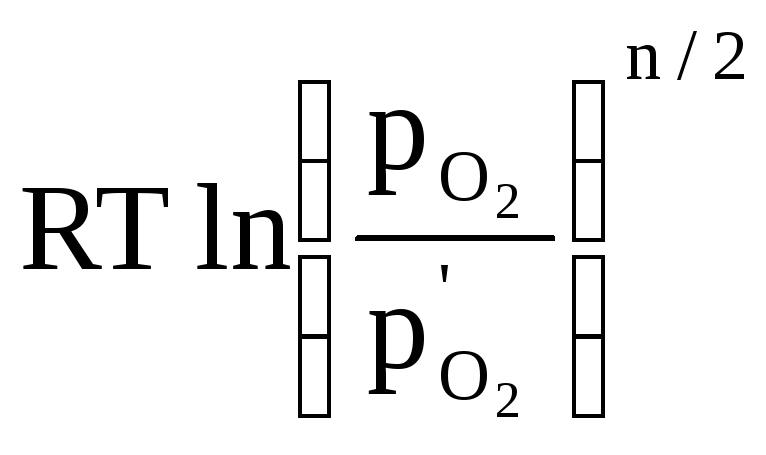 ,( 3)
,( 3)
где
![]() - неравновесное парциальное давление
кислорода.
- неравновесное парциальное давление
кислорода.
Это
уравнение позволяет оценить возможность
протекания процесса окисления. Если
![]() >
>
![]() ,
то процесс окисления возможен, так как
в этих условиях
,
то процесс окисления возможен, так как
в этих условиях
![]() <
0. Если
<
0. Если
![]() <
<
![]() ,
то окисление невозможно, так как
,
то окисление невозможно, так как
![]() >
0.
>
0.
Этот
принцип используют для предотвращения
газовой коррозии в ряде технологических
операций, например, в металлургии. Снижая
парциальное давление кислорода
![]() в газовой среде, защищают металл от
окисления при высоких температурах.
в газовой среде, защищают металл от
окисления при высоких температурах.
Кинетика газовой коррозии
Обычно
скорость газовой коррозии ( r
) выражают через скорость роста
толщины (![]() )
оксидной пленки во времени (
)
оксидной пленки во времени (![]() )
:
)
:
r
=
![]() .
.
Из большого числа факторов, влияющих на скорость, существенную роль в случае газовой коррозии играет состояние поверхности металла, а именно отсутствие или наличие на ней оксидной пленки в результате окисления металла. Окисление металлов – процесс многостадийный.
Основные стадии газовой коррозии металлов.Образование продуктов коррозии осуществляется в результате протекания ряда последовательных и параллельных реакций. На рис. 2. представлена схема образования сплошной оксидной пленки при окислении металла кислородом из газовой фазы.
Стадии окисления металла:
1. ионизация металла и переход его в форме ионов и электронов в слой оксида;
2. перемещение ионов металла Меn+и электронов в слое оксида;
3. реакция образования оксида.
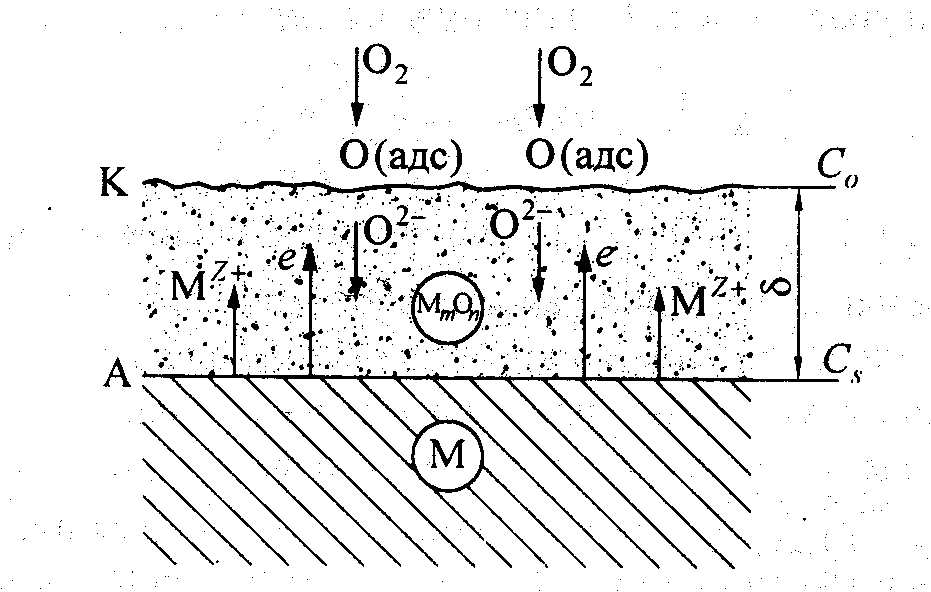
Рис. 2. Схема механизма образования и роста защитной оксидной пленки на поверхности металла
Поверхностная пленка, которая образуется на металле, определяет его коррозионную устойчивость в агрессивной среде. Толщина пленок обусловливается видом металла, свойствами коррозионной среды и рядом других факторов. Различают тонкие (невидимые), средние (видимые благодаря интерференционному окрашиванию как цвета побежалости) и толстые (видимые) пленки. Толщина первых составляет от монослоя молекул до 40 нм. Средние имеют толщину 40…500 нм. Толстые пленки обнаруживаются на поверхности визуально (например, окалина на стали) и имеют толщину более 500 нм.
Чтобы оксидная пленка обладала защитными свойствами, она должна удовлетворять следующим требованиям: быть сплошной и беспористой, обладать высокой адгезией к металлу, быть химически инертной к агрессивной среде, обладать выской твердостью и износостойкостью.
Влияние различных факторов на скорость высокотемпературной коррозии. К внутренним факторам, влияющим на скорость газовой коррозии, относятсяприрода, химический и фазовый состав сплава, наличие механических напряжений и деформаций, состояние поверхности.
Внешние факторы, такие как состав, давление, температура, скорость движения газовой среды, время ее контакта, режим нагрева, оказывают большее влияние на скорость коррозии. Колебания температуры (особенно попеременный нагрев и охлаждение) вызывают быстрое разрушение защитной пленки из-за возникновения больших внутренних напряжений.
С повышением парциального давления кислорода скорость окисления металлов при высокой температуре увеличивается, а затем при достижении некоторого критического значения резко уменьшается и остается достаточно низкой в широком диапазоне давлений. Наблюдаемое явление получило название высокотемпературной пассивации. Пассивное состояние металла объясняется образованием на поверхности совершенной по структуре оксидной пленки.
Коррозия под действием продуктов сгорания топлива. Продукты сгорания топлива (угля, мазута и др.) в большинстве случаев содержат значительные количества соединений серы и ванадия. Под действием соединений серы железоуглеродистые сплавы подвергаются межкристаллитной коррозии из-за большего числа дефектов в кристаллических решетках сульфидов по сравнению с решетками оксидов.
С повышением содержания в продуктах сгорания топлива оксида углерода (II) заметно снижается скорость газовой коррозии углеродистых и низколегированных сталей, однако при очень высоких его концентрациях возможно науглероживание поверхности:
3
Fe+ 2CO
![]() Fe3C+CO2
Fe3C+CO2
![]()
Науглероживание поверхности стали происходит и при нагревании ее в атмосфере углеводородов.
Коррозия железа, стали, чугуна в атмосфере, содержащей О2, СО2, Н2О. При нагревании железа и сталей на их поверхности образуется окалина, имеющая сложное строение. Из-за большего объема образующихся оксидов компонентов чугуна размеры детали увеличиваются, а ее прочность снижается.
В стали и чугуне наряду с окислением железа происходит взаимодействие карбида железа с кислородом и кислородосодержащими реагентами:
Fe3C
+ O2
![]() 3 Fe + CO2
3 Fe + CO2
Fe3C
+ CO2
![]() 3 Fe + 2 CO
3 Fe + 2 CO
При этом их поверхностный слой обедняется углеродом (так называемое обезуглероживание), что ухудшает их механические и антикоррозионные свойства.
За защиты от газовой коррозии применяют жаростойкоелегирование(например, хромом, алюминием, кремнием),защитные покрытия(главным образом, металлические и термодиффузионные покрытия алюминием, хромом и жаростойкие эмали), а также различные защитные атмосферы (Ar,N2,N2–CO2и др.).
Химическая коррозия в жидкостях-неэлектролитах. Жидкие неэлектролиты – это жидкие коррозионные среды, не проводящие электрический ток. К ним относят жидкости органического (спирты, бензолы, нефть, керосин и др.) и неорганического (жидкий бром, расплавленная сера) происхождения. Сами по себе (в чистом виде) они малоагрессивны, однако присутствие в них даже небольших количеств примесей (воды, йода, сероводорода и др.) резко увеличивает их активность.
Например, меркаптаны (R –SH), содержащиеся в нефти, вызывают коррозию Cu, Ni, Ag, Pb, Sn и других металлов с образованием их меркаптидов (M - (SR)n). Присутствие воды величивает коррозионную активность сырой нефти, содержащей тиоспирты и сероводород. Последний реагирует с Fe, Pb, Cu, Ag с образованием сульфидов:
2
Cu
+ 2 H2S
+ O2
![]() 2 CuS
+ H2
O
2 CuS
+ H2
O
