
- •Лекция по теме: «Защита металлов от коррозии» Учебные вопросы
- •1. Коррозия в естественных условиях
- •Основные способы защиты металлов от коррозии
- •Механизм реакции имеет сложный характер. Электродная реакция протекает в несколько стадий. Наряду с образование оксида происходит его частичное растворение в кислоте:
- •3. Электрохимическая защита
Механизм реакции имеет сложный характер. Электродная реакция протекает в несколько стадий. Наряду с образование оксида происходит его частичное растворение в кислоте:
Al2O3
+
6 H+
![]() 2 Al3+
+ 3 H2O
2 Al3+
+ 3 H2O
В результате пленка становится пористой, через поры пленки проникают ионы и процесс роста пленки продолжается. Полученная пленка Al2O3весьма пориста, причем размеры пор очень малы. Вследствие этого пленка может быть пропитана различными составами, повышающими коррозионную стойкость поверхности. Оксидная пленка на алюминии имеет высокую твердость, поэтому после анодирования и пропитки оксидного слоя смазкой значительно повышается износостойкость деталей.
3. Электрохимическая защита
Электрохимические способы основаны на торможении анодных или катодных реакций коррозионных процессов. Метод эффективен в коррозионных средах с хорошей ионной электрической проводимостью. Сущность метода состоит в уменьшении скорости электрохимической коррозии металла при поляризации электрода от источника постоянного тока или при контакте с добавочным электродом, являющимся анодом по отношению к защищаемой конструкции металла. В зависимости от вида поляризации различают катодную и анодную защиты.
Катодная защита. Ее осуществляют двумя способами:
1) подключение защищаемой конструкции к отрицательному полюсу внешнего источника постоянного тока – так называемая катодная защита внешним током;
2) присоединением к защищаемой конструкции электрода (дополнительного анода, протектора), изготовленного из более активного металла, т.е. имеющего наиболее отрицательный электродный потенциал - так называемая протекторная защита.
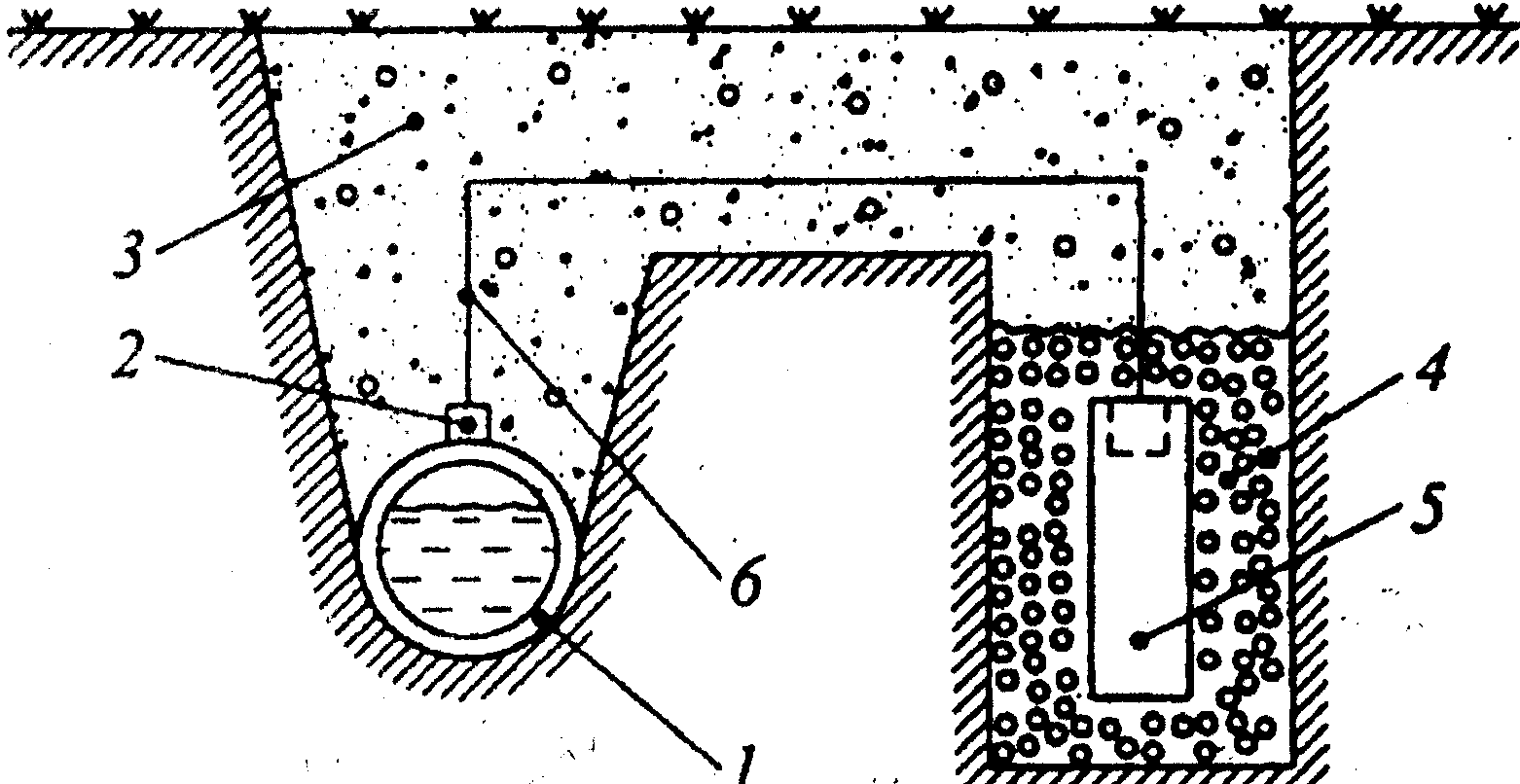
В случае катодной защиты защищаемый металл присоединяется к отрицательному полюсу источника постоянного тока и становится катодом, дополнительный электрод – к положительному (рис. 3.).

Рис. 3. Схема катодной защиты:
1 – стальной провод с изоляцией; 2 – грунт; 3 – выпрямитель; 4 – засыпка; 5 – вспомогательный анод; 6 – защищаемая конструкция (трубопровод).
Источник постоянного тока перекачивает электроны от дополнительного электрода на защищаемый металл, который все время поддерживается в восстановленном состоянии. В качестве дополнительного электрода чаще всего используется металлический лом. Вспомогательный электрод (анод) растворяется:
(-)
А: Me
![]() Men+
+ n
Men+
+ n![]()
Для снижения сопротивления коррозионной среды, например, грунта, непосредственно окружающего вспомогательный анод, последний помещают в так называемую токопроводящую засыпку (смесь кокс, NaCl и CaSO4· 2 H2O).
На защищаемом металле (катоде) в зависимости от характера среды выделяется водород или разряжается кислород.
Катодная защита внешним током применяется главным образом для предотвращения металлических конструкций (трубопроводов, газопроводов, кабельных установок) от коррозии в условиях не сильно агрессивных сред.
Протекторная защита. Ее преимущество состоит в том, что нет необходимости во внешнем источнике постоянного тока, специальное сооружение которого бывает иногда экономически нецелесообразно. При протекторной защите к изделию подсоединяют металл или сплав-протектор, потенциал которого значительно отрицательнее потенциала металла изделия (рис. 4.).
В образующемся гальваническом элементе протектор служит отрицательным электродом (анодом) и постепенно разрушается, а на защищаемый металл поступают электроны с протектора; таким образом, он является положительным электродом (катодом) и тем самым защищен от коррозии.
В качестве материалов протекторов чаще всего используют магний и его сплавы, реже алюминий и цинк. Это связано с тем, что последние в воде и грунтах склонны к пассивации – образованию на поверхности плотных оксидных пленок, нарущающих токоотдачу. Для предотвращения пассивации в засыпку вводят хлориды или другие вещества, растворяющие их, а также компоненты, увеличивающие сопротивление грунта. Последнее приводит к уменьшению скорости
(-)
А: Me
![]() Men+
+ n
Men+
+ n![]() ,
где Ме (Mg, Al, Zn)
,
где Ме (Mg, Al, Zn)
(+)
К: 2 H2O
+ 2
![]()
![]() H2
H2![]() + 2 OH-
+ 2 OH-
Рис. 4. Схема протекторной защиты:
1 – защищаемая конструкция (трубопровод); 2 – стальной наконечник; 3 – грунт; 4 – засыпка (суспензия бентонита и алебастра); 5 – протектор; 6 – стальной провод с изоляцией.
растворения протектора. Эффективность этого вида защиты определяется радиусом действия протектора, т.е. максимально возможным его удалением от защищаемого изделия. Чем выше электрическая проводимость среды, тем выше радиус защитного действия протектора. Эффективность протекторной защиты возрастает при совместном ее использовании с защитными покрытиями, например битумными. Протекторную защиту используют для борьбы с коррозией трубопроводов и металлоконструкций в воде, грунте и других нейтральных средах. Высокая скорость саморастворения протектора в кислотных средах ограничивает его применение в них.
Анодная защита. В основе данного способа лежит анодная поляризация: потенциал защищаемого металла смещают в положительную сторону, путем присоединения защищаемой конструкции к положительному полюсу внешнего источника постоянного тока, а вспомогательного электрода (катода) – к отрицательному.
Анодная
защита применяется только для тех
металлов и сплавов, которые легко
пассивируются при анодной поляризации,
т.е. покрываются пассивной пленкой
оксида, например 2 Cr
+ 3H2O
![]() Cr2O3
+ 6H+
+ 6
Cr2O3
+ 6H+
+ 6
![]() (большинство переходных металлов и
сплавов на их основе, включая нержавеющие
и углеродистые стали). Она не осуществима
для Mg,
Cd,
Ag,
Cu
и медных сплавов.
(большинство переходных металлов и
сплавов на их основе, включая нержавеющие
и углеродистые стали). Она не осуществима
для Mg,
Cd,
Ag,
Cu
и медных сплавов.
Изменение
свойств коррозионной среды.
Для снижения агрессивности среды
уменьшают концентрацию компонентов,
опасных в коррозионном отношении.
Например, в нейтральных средах коррозия
обычно протекает с поглощением кислорода.
Его удаляют деаэрацией (кипячение,
барботаж инертного газа) или восстанавливают
с помощью соответствующих восстановителей
(сульфиты, гидразин N2H4
и т.п.). Например, O2
+ N2H4
![]() N2
+ 2 H2O.
Агрессивность среды может уменьшаться
при снижении концентрации ионов Н+,
т.е. повышении рН (подщелачивание). Для
защиты от коррозии широко применяют
ингибиторы.
N2
+ 2 H2O.
Агрессивность среды может уменьшаться
при снижении концентрации ионов Н+,
т.е. повышении рН (подщелачивание). Для
защиты от коррозии широко применяют
ингибиторы.
Ингибитором называется вещество, при добавлении которого в небольших количествах в среду, где находится металл, значительно уменьшается скорость коррозии металла.
По механизму своего действия на процесс электрохимической коррозии ингибиторы разделяются на адсорбционные и пассивационные.
Механизм действия значительного числа ингибиторов заключается в адсорбции ингибитора на корродирующей поверхности и последующем торможении катодных и анодных процессов.
Адсорбционные ингибиторы уменьшают скорость коррозии за счет снижения интенсивности процесса или сокращения площади участков, лимитирующих процесс. К таким ингибиторам относятся органические вещества, содержащие в своем составе серу, азот, фосфор (диэтиламин, формальдегид, пиридин). Их широко используют при травлении металлов кислотами, а также для защиты от атмосферной коррозии.
Для защиты металлических изделий в воздушной атмосфере, при перевозке, хранении используют летучие (атмосферные) ингибиторы, имеющие достаточно высокое давление паров. Ими пропитывают упаковочные материалы. Пары ингибиторов адсорбируются на поверхности металла и образуют на нем защитную пленку.
Пассивационные ингибиторы вызывают образование на поверхности метала защитных пленок, в их присутствии поверхность металла становится пассивной и не подвергается воздействию окружающей среды. Они применяются, как правило, в нейтральных и щелочных средах, когда протекает коррозия с восстановлением кислорода. К ним относятся в основном неорганические вещества: хроматы, нитриты, а также некоторые органические вещества, например, соли бензойной и других органических кислот.
Рациональное конструктирование изделий должно исключать наличие или сокращать число и размеры особо опасных, с точки зрения коррозии, участков в изделиях или конструкциях (сварных швов, контактов разнородных по электродным потенциалам металлов и др.).
Все металлы разделяют на пять групп: I – Mg; II – Zn, Al, Cd ; III - Fe, Pb, Sn, углеродистые стали; IV – Ni, Cr, хромистые стали, хромоникелевые стали; V – Ag, Cu, медно-никелевые сплавы .
Для предотвращения контактной коррозии допустимым считается контакт металлов, входящих в одну группу. Металлы каждой последующей группы усиливают коррозию металлов предыдущей.
Л И Т Е Р А Т У Р А
Глинка Н.Л. Общая химия. М: Интеграл-Пресс, 2002, гл. 9.
Коровин Н.В. Общая химия, М. Высшая школа, 2002, гл. 9.
Глинка Н.Л. Задачи и упражнения по общей химии. М: Интеграл-Пресс, 2002, гл.VIII.
