
Методички по лабам(физика) / lab93
.pdfФедеральное агентство по образованию Государственное образовательное учреждение высшего профессионального образования
«Хабаровский государственный технический университет»
ОПРЕДЕЛЕНИЕ ОТНОШЕНИЯ Cp  Cv МЕТОДОМ АДИАБАТИЧЕСКОГО РАСШИРЕНИЯ
Cv МЕТОДОМ АДИАБАТИЧЕСКОГО РАСШИРЕНИЯ
Методические указания к лабораторной работе № 93 по физике для студентов всех форм обучения
Хабаровск Издательство ХГТУ
2005
УДК 535.2
Определение отношения Cp  Cv методом адиабатического расшире-
Cv методом адиабатического расшире-
ния : методические указания к лабораторной работе № 93 по физике для студентов всех форм обучения / сост. В. В. Насыров. – Хабаровск : Изд-во Хабар. гос. техн. ун-та, 2005. – 8 с.
Методические указания к лабораторной работе № 93 составлены на кафедре «Физика». Содержат указания по определению отношения Cp  Cv
Cv
методом адиабатического расширения. Объем выполнения лабораторной работы – 2 часа.
Печатается в соответствии с решениями кафедры «Физика» и методического совета факультета математического моделирования и процессов управления.
© Хабаровский государственный технический университет, 2005
ОПРЕДЕЛЕНИЕ ОТНОШЕНИЯ Cp  Cv МЕТОДОМ АДИАБАТИЧЕСКОГО РАСШИРЕНИЯ
Cv МЕТОДОМ АДИАБАТИЧЕСКОГО РАСШИРЕНИЯ
Хабаровск
2005
Цель работы: Изучение изопроцессов идеальных газов.
Задача: Определение показателя адиабаты. Приборы Установка ФПТ1–6 и материалы: (жидкостный манометр).
Введение
В термодинамике для описания тепловых свойств тел используется понятие теплоемкости.
Теплоемкостью C * называется физическая величина, характеризующая способность тела нагреваться, равная теплоте, которую необходимо сообщить телу для увеличения температуры на 1 К:
C Q где δQ – теплота, сообщаемая телу; |
C |
|
Дж |
|
dT , dT – изменение температуры тела. |
|
|
|
|
|
|
К |
||
Теплоемкость зависит как от химического состава и термодинамического состояния тела, так и от типа процесса, при котором происходит сообщение телу теплоты.
Очевидно, что теплоемкость также зависит от массы тела, поэтому удобно пользоваться такими понятиями, как:
удельная теплоемкость c – величина, характеризующая теплоемкость единицы массы вещества:
|
C |
|
|
|
Дж |
|
c |
|
|
где m – масса вещества (тела) |
с |
|
|
|
|
|
||||
|
m |
, |
|
|
кг К |
|
молярная теплоемкость C – величина, характеризующая теплоемкость одного моля вещества:
C C |
|
где |
m |
– число молей вещества; |
|
|
Дж |
|
|
|
|
С |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
, |
|
|
|
||||
|
μ – молярная масса вещества. |
|
|
моль К |
|||||
|
|
|
|
|
|
|
|||
При описании тепловых свойств газа, участвующего в некотором изопроцессе, к знаку теплоемкости принято приписывать знак, соответствующий сохраняющейся термодинамической величине (т. е. CP* – теплоемкость в изобарном процессе, CV* – теплоемкость в изохорном про-
цессе и т. д.). Зависимость величины теплоемкости газов от вида термодинамического процесса можно изучить, исследуя уравнение первого начала термодинамики
Q dU A, |
(1) |
из которого следует, что изменение внутренней энергии вещества, определяющей изменение температуры газа, будет зависеть от доли теплоты, идущей на совершение газом работы.
В случае изохорного расширения dV=0, поэтому вся подводимая теплота идет на увеличение внутренней энергии:
3

mcV dT dU.
При изобарном расширении газа уравнение (1) имеет вид m cP dT m cV dT d A.
При изобарном нагревании газ совершает работу d A PdV m RdT .
Так как в изобарном процессе часть энергии идет на совершение газом работы, то для нагревания газа до одной и той же разности температур в изобарном процессе должно быть подведено большее, чем в изохорном
процессе, количество теплоты. Таким образом, теплоемкость cP всегда больше теплоемкости cV .
Молекулярно-кинетическая теория позволяет получить выражения для теплоемкостей изопроцессов в следующем виде:
cP |
|
i 2 |
|
R |
– удельная теплоемкость при постоянном давлении; |
(2) |
||||
|
2 |
|||||||||
|
|
|
|
|
|
|||||
cV |
|
i |
|
R |
|
– удельная теплоемкость при постоянном объеме, |
(3) |
|||
|
|
|||||||||
|
|
|
2 |
|
|
|||||
где R – газовая постоянная; i – количество степеней свободы газа (для одноатомных газов i 3 , для двухатомных i 5 , для трехатомных и более i 6 ).
Как правило, величина теплоемкости газа существенно меньше величины теплоемкости сосуда, в котором находится газ. Это приводит к тому, что непосредственное измерение теплоемкости газа чрезвычайно неточно.
В данной работе при помощи метода адиабатического расширения измеряется отношение теплоемкостей cP cV , являющееся показателем адиабаты, в уравнении Пуассона, описывающем адиабатический процесс:
PV const .
Теоретическое значение показателя адиабаты γ может быть рассчитано по формуле
|
i 2 |
|
|
|
i . |
(4) |
|||
|
||||
|
|
|||
Показатель адиабаты в данной работе определяется для воздуха, кото- |
||||
рый на 96 % состоит из молекул двухатомного газа. Поэтому количество |
|
|||
степеней свободы i в формуле (4) можно принять равным 5. |
|
|||
4
Описание установки
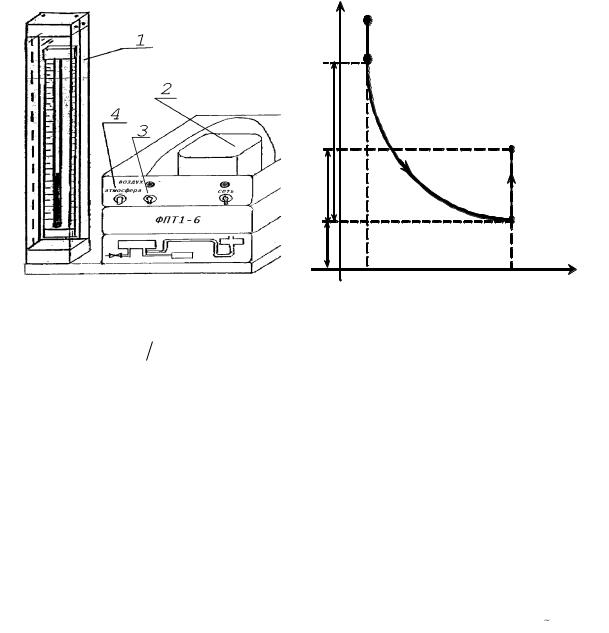
Для определения показателя адиабаты воздуха используется экспериментальная установка, изображенная на рис. 1.
|
1’ |
~ |
P |
( P ’1, V1 ,T ’1,) |
~
1 ( P1, V1 , T1)
h 1
~
3 ( P3, V2 , T1)
|
h 3 |
|
|
2 |
~ |
|
( P2, V2 , T2) |
|
|
H |
|
|
|
~ |
|
|
V |
Рис. 1. Схема установки для определения |
Рис. 2. Диаграмма процессов, совершае- |
|
отношения Cp Cv адиабатическим |
мых единицей массы газа: 1-2 – |
|
методом |
адиабатическое расширение; 2-3 – |
|
изохорное нагревание |
|
|
|
|
|
Установка состоит из емкости 2, соединенной с открытым водяным манометром 1. Нагнетание воздуха в емкость производится микрокомпрессором, вмонтированным в установку. Включение микрокомпрессора осуществляется тумблером 3. Рычаг 4 позволяет соединять емкость 2 с микрокомпрессором или с атмосферой (положение "Атмосфера").
Описание метода измерений
В ходе опыта масса воздуха в сосуде изменяется, при этом объем сосуда Vc остается неизменным, поэтому для описания состояния газа в данном эксперименте удобно использовать понятие удельного объема V :
~ |
Vc |
|
|
V |
|
, где m – масса воздушной смеси в сосуде. |
|
m |
|
||
При |
таком подходе набор термодинамических |
~ |
|
переменных ( P, V, T ) |
|||
описывает параметры единицы массы газа, то есть остается возможность применения всех термодинамических законов, описывающих поведение замкнутых объемов газа неизменной массы.
В данной работе воздушная смесь, содержащаяся в сосуде 2, совершает процесс, диаграмма которого приведена на рис. 2. Вначале воздух закачивается в сосуд микрокомпрессором. При этом в сосуде создается давление P1' , превышающее атмосферное давление PA , и газ переходит в состояние
5
1’ (см. рис. 2) с параметрами |
' |
~ |
' |
. Повышение давления при достаточ- |
P1 |
, V1 |
, T1 |
но быстром нагнетании воздуха сопровождается повышением температуры T1' . Затем вследствие теплопроводности стенок сосуда воздух в закрытой емкости изохорически охлаждается до температуры окружающей среды, и
газ переходит в состояние 1 (см. рис. 2) с параметрами |
~ |
, T1 |
. Уровни |
P1 , V1 |
жидкости в манометре перестают изменяться, и устанавливается разность уровней h1 . Для перевода газа в сосуде в состояние 2 необходимо на короткое время соединить емкость с атмосферой. При этом часть газа покидает сосуд и давление воздуха в сосуде становится равным атмосферному
давлению. Новое состояние газа характеризуется параметрами ~ .
P2 , V2 , T2
Масса газа в сосуде уменьшается, поэтому удельный объем ~ становится
V2
больше, чем начальный объем ~ . Быстрое расширение газа в процессе 1 –
V1
2 приближенно считают адиабатическим, так как в этом случае можно пренебречь обменом энергией между газом в сосуде и окружающей средой из - за конечной скорости распространения теплоты по стенкам сосуда.
Температура газа T2 в состоянии 2 оказывается меньше температуры T1 , так как из первого начала термодинамики следует, что в процессе адиабатического расширения газ совершает работу только за счет убыли своей внутренней энергии.
Через некоторое время вследствие теплопроводности стенок темпера-
тура воздуха в емкости начнет изохорически повышаться до температуры |
||
окружающей среды T1 (процесс 2 – 3), давление при этом будет повышать- |
||
|
~ |
, T1 . |
ся. Газ в емкости в состоянии 3 характеризуется параметрами P3 , V2 |
||
Адиабатический процесс 1 – 2 описывается уравнением Пуассона |
||
~ |
~ |
|
P V |
P V |
(5) |
1 1 |
2 2 . |
|
В рассматриваемом опыте температура газа в состояниях 1 и 3 равна |
||
температуре окружающей среды, поэтому T1 T3 . Следовательно, |
из урав- |
|
нения Клапейрона – Менделеева можно получить |
|
|
~ |
~ |
|
P1V1 |
P3V2 . |
(6) |
Получим из уравнений (5) и (6) выражение для расчета показателя адиабаты γ. Для этого возведем уравнение (6) в степень γ и разделим почленно на уравнение (5):
P1 1 |
P |
|
|
3 |
. |
(7) |
|
|
|||
|
P |
|
|
|
2 |
|
|
После логарифмирования уравнения (7) получим
|
|
P |
|
|
|
|
|
|
|
h |
|
|
|
|
|
|
||
|
ln |
1 |
|
|
|
|
ln 1 |
|
1 |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
P2 |
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
P |
|
|
|
h |
|
|
|
|
h |
3 |
, |
(8) |
|||||
|
|
|
|
|
||||||||||||||
|
ln |
1 |
|
|
ln 1 |
|
1 |
|
|
ln 1 |
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||||||||
|
|
P3 |
|
|
|
|
H |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
H |
|
|||||||
6
где h1 , h3 – разность разности уровней воды в манометре в состояниях газа
1 и 3 соответственно; H – высота водяного столба, гидростатическое давление которого равно атмосферному давлению PA . Для получения последнего равенства в формуле (9) использованы следующие соотношения:
P1 g h1 H , |
|
|
P2 |
PA gH , |
(9) |
P3 |
g h3 H , |
|
где ρ – плотность воды; g – ускорение свободного падения.
В данном опыте величины h1 и h3 могут принимать значения до 15 – 25 см, значение величины H примерно 10 м, поэтому в выражении (9) можно
использовать приближенную формулу |
ln(1 x) x , справедливую при |
|||
x 1. |
|
|
|
|
Так как h1 ,h3 H , то формула для расчета показателя адиабаты прини- |
||||
мает следующий вид |
|
|
|
|
|
|
h1 |
(10) |
|
|
|
. |
||
h |
h |
|||
1 |
3 |
|
|
|
Порядок выполнения работы
1.Включите установку тумблером "Сеть".
2.Установите рычаг 4 в нижнее положение и включите микрокомпрессор тумблером 3 на 3 – 5 секунд. Выключите микрокомпрессор при разности уровней жидкости в манометре 150 – 250 мм.
3.Дождитесь, пока температура в емкости станет равной температуре окружающей среды. При этом разность уровней жидкости в манометре перестанет изменяться. Определите установившуюся разность уровней
h1 .
4.Выпустите воздух из сосуда, переведя рычаг 4 в положение "Атмосфера". После того как уровни жидкости в плечах манометра сравняются, закройте клапан, переведя рычаг 4 в нижнее положение.
5.По мере нагревания воздуха в сосуде возникнет разность уровней воды в плечах манометра. После того как изменение уровней воды в манометре прекратится, выполните отсчет значения разности уровней h3 .
6.Повторите опыт (пункты 2 – 5) не менее десяти раз.
7.Для каждого измерения по формуле (10) вычислите показатель адиабаты .
8.Считая воздух двухатомным газом, по формуле (4) вычислите теоретическое значение .
9.Сравните теоретическое и экспериментальное значения .
7
Примерный вид таблицы результатов
|
|
|
|
|
|
|
|
|
|
|
№ |
h |
, см |
h |
, см |
|
|
|
теор |
|
измерения |
|
|
||||||
|
1 |
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
…….. |
|
|
|
|
|
|
|
|
|
…….. |
|
|
|
|
|
|
|
|
|
10 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
x |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Контрольные вопросы
1.Какой процесс называется адиабатическим? Напишите уравнение адиабатического процесса.
2.Сформулируйте первый закон термодинамики. Запишите первый закон термодинамики для адиабатического процесса.
3.Дайте определения понятий теплоемкость, удельная теплоемкость, молярная теплоемкость. Какие единицы измерения они имеют?
4.Что означают обозначения cP и cV ? Почему они имеют разные значения для одной и той же массы газа?
5.Почему при адиабатическом расширении газа понижается его температура? За счет какого источника энергии совершается работа расширяющегося газа?
6.Выведите формулу (4).
7.Могут ли молярные теплоемкости различных газов быть одинаковыми по величине?
8.Почему разность молярных cP cV имеет примерно одинаковое значение независимо от типа молекул?
9.Получите формулу (10).
10.Какой из газов одинаковой массы – одноатомный или двухатомный, находящихся первоначально при одинаковых условиях, а затем адиабатно расширившихся до одинакового объема, совершит бóльшую работу?
Библиографический список
1.Трофимова Т. И. Курс физики / Т. И. Трофимова. – М. : Высш. шк.,
1997. – 542 с.
2.Лабораторные занятия по физике / Л. Л. Гольдин [ и др. ]. – М. : Наука,
1983. – 704 с.
3.Майсова Н. Н. Практикум по курсу общей физики / Н. Н. Майсова. –
М. : Высш. шк., 1970. – 448 с.
8
ОПРЕДЕЛЕНИЕ ОТНОШЕНИЯ Cp 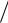 Cv МЕТОДОМ АДИАБАТИЧЕСКОГО РАСШИРЕНИЯ
Cv МЕТОДОМ АДИАБАТИЧЕСКОГО РАСШИРЕНИЯ
Методические указания к лабораторной работе № 93 по физике для студентов всех форм обучения
Вячеслав Вячеславович Насыров
Главный редактор Л. А. Суевалова Редактор Л. С. Бакаева
Подписано в печать 16.03.05. Формат 60х84 1/16. Бумага писчая. Гарнитура "Таймс". Печать офсетная. Усл. печ. л. 0,46. Тираж 250 экз. Заказ .
Издательство Хабаровского государственного технического университета. 680035, Хабаровск, ул. Тихоокеанская, 136.
Отдел оперативной полиграфии издательства Хабаровского государственного технического университета. 680035, Хабаровск, ул. Тихоокеанская, 136.
