
- •Государственное бюджетное образовательное учреждение высшего профессионального образования
- •Содержание
- •Список сокращений
- •Введение
- •І. Тема: белки
- •1. Строение и биологическая роль аминокислот, пептидов, белков
- •Аспарагиновая кислота (асп)
- •Лизин (лиз)
- •Серин (сер)
- •1.1. Первичная структура белка
- •1.2. Варианты вторичной структуры белка
- •1.3. Третичная структура белка
- •1.4. Четвертичная структура белка – высший уровень организации
- •Свойства протеинов
- •2.1. Физико - химические свойства биополимеров
- •2.2. Особенности биологических свойств белков
- •3. Методы очистки и выделения белков
- •4. Классификация белков
- •4.1. Простые белки
- •4.1.1. Глобулярные белки
- •4.1. 2. Фибриллярные белки
- •4.2. Сложные белки
- •Характеристика липопротеиновых частиц
- •5. Биологическая роль протеинов
- •Вопросы для самоконтроля:
- •Тестовые задания для оценки уровня знаний:
- •Ситуационные задачи
- •II. Тема: ферменты
- •1. Особенности строения ферментов
- •1.1. Энзим – сложный белок
- •1.1.1. Природа и роль кофермента
- •Витамины – компоненты коферментов
- •1.1.2. Апофермент и его значение
- •1.2. Функциональные центры фермента
- •1.2. Механизм действия ферментов
- •I стадия. Образование es-комплекса
- •II стадия. Активация es-комплекса
- •III стадия. Образование eр-комплекса
- •IV стадия. Распад eр-комплекса
- •1.3. Специфичность действия ферментов
- •1.4. Кинетика ферментативных реакций
- •1.4.1. Зависимость скорости реакции от концентрации субстрата
- •1.4.2. Зависимость скорости реакции от концентрации фермента
- •1.4.3. Зависимость скорости реакции от температуры
- •1.4.4. Зависимость скорости реакции от величины рН среды
- •2. Классификация, номенклатура и регуляция ферментов
- •2.1. Классификация и номенклатура ферментов
- •2.1.1. Характеристика отдельных классов ферментов
- •2.2. Регуляция работы фермента
- •2.2.1. Активация энзима
- •1. Аллостерическая регуляция
- •2.2.2. Особенности строения и функционирования аллостерических ферментов:
- •2.2.4. Регуляция путём ковалентной модификации
- •2.2.5. Частичный протеолиз – как способ активации энзима (активация зимогена)
- •2.3. Ингибирование ферментов
- •2.4. Использование ферментов в медицине.
- •Энзимопатии
- •Энзимодиагностика
- •Энзимотерапия
- •Вопросы для самоконтроля:
- •Тестовые задания для оценки уровня знаний:
- •Ситуационные задачи
Вопросы для самоконтроля:
1. Ферменты, их химическая природа, структурная организация, свойства. Сходство и отличия ферментов и небелковых катализаторов.
2. Коферменты, классификация, функции в ферментативных реакциях.
3. Классификация и номенклатура ферментов. Характеристика отдельных классов ферментов, примеры реакций.
4. Современные представления о механизме действия ферментов. Стадии ферментативной реакции, молекулярные эффекты.
5. Ингибирование ферментов. Конкурентное и неконкурентное ингибирование, примеры. Лекарственные вещества как ингибиторы ферментов.
6. Регуляция активности ферментов: белок – белковые взаимодействия, частичный протеолиз, фосфорилирование, дефосфорилирование. Аллостерический центр ферментов и аллостерическая регуляция.
Тестовые задания для оценки уровня знаний:
(Выберите один правильный вариант)
1. ПРИ УВЕЛИЧЕНИИ КОНЦЕНТРАЦИИ СУБСТРАТА СКОРОСТЬ ФЕРМЕНТАТИВНОЙ РЕАКЦИИ ИЗМЕНИТСЯ
1) сначала возрастает, затем не изменяется
2) непрерывно возрастает
3) сначала убывает, затем возрастает
2. КЛАССИФИКАЦИЯ ФЕРМЕНТОВ ОСНОВАНА НА
1) кинетической характеристике
2) органной принадлежности
3) типе катализируемой реакции
3. ПЕПСИН ОБЛАДАЕТ СПЕЦИФИЧНОСТЬЮ
1) абсолютной
2) относительной
3) стереохимической
4. ФУНКЦИЕЙ АЛЛОСТЕРИЧЕСКОГО ЦЕНТРА ФЕРМЕНТА ЯВЛЯЕТСЯ
1) связывание регуляторов
2) связывание субстрата
3) связывание кофермента
5. ФУНКЦИЕЙ КАТАЛИТИЧЕСКОГО УЧАСТКА АКТИВНОГО ЦЕНТРА ФЕРМЕНТА ЯВЛЯЕТСЯ
1) связывание субстрата
2) временное связывание регулятора
3) превращение субстрата
6. КАРДИОМИОЦИТЫ В НАИБОЛЬШЕМ КОЛИЧЕСТВЕ СОДЕРЖАТ ИЗОФЕРМЕНТ
1) ЛДГ-3
2) ЛДГ-1
3) ЛДГ-5
7. К МУЛЬТИЭНЗИМНЫМ КОМПЛЕКСАМ ОТНОСЯТ
1) -кетоглутаратдегидрогеназа
2) изоферменты ЛДГ
3) пируваткарбоксилаза
8. НЕСПЕЦЕФИЧЕСКИЕ ИНГИБИТОРЫ СНИЖАЮТ АКТИВНОСТЬ ФЕРМЕНТА, ВЫЗЫВАЯ:
1) связывание субстрата
2) связывание кофермента
3) изменение конформации фермента
9. КОФЕРМЕНТНЫЕ ФОРМЫ ВИТАМИНА В2
1) ФМН
2) НАД+
3) ТДФ
10. АКТИВАЦИЯ ФЕРМЕНТОВ МОЖЕТ ОСУЩЕСТВЛЯТЬСЯ ПУТЁМ
1) удаления кофермента
2) ограниченного протеолиза
3) блокирования активного центра
11. КОФЕРМЕНТНАЯ ФОРМА ВИТАМИНА В3
1) пиридоксальфосфат
2) ретиналь
3) никотинамидадениндинуклеотид
12. ИЗОФЕРМЕНТЫ ОТЛИЧАЮТСЯ ДРУГ ОТ ДРУГА
1) числом субъединиц
2) тканевой локализацией
3) катализируемой реакцией
Варианты правильных ответов на контрольные тесты
|
№ вопроса |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
|
Ответ |
1 |
3 |
2 |
1 |
3 |
2 |
1 |
3 |
1 |
2 |
3 |
2 |
Ситуационные задачи
Приложение № 1
Протеиногенные аминокислоты
Гидрофобные аминокислоты
А
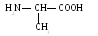 ланин
(ала)
ланин
(ала)
2 .
Валин (вал)
.
Валин (вал)
3. Лейцин (лей)

4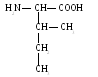 .
Изолейцин (иле)
.
Изолейцин (иле)
5. Метионин (мет)
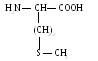
6. Фенилаланин (фен)

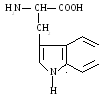
7. Триптофан (три)
Пролин (про)
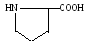
Гидрофильные нейтральные аминокислоты
Глицин (гли)
H2N
— СН2
—
COOH
Серин (сер)
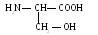
3. Треонин (тре)
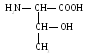
4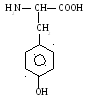 .
Тирозин (тир)
.
Тирозин (тир)
5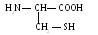 .
Цистеин (цис)
.
Цистеин (цис)
6. Глутамин (глн)
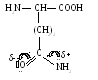
7. Аспарагин (асн)
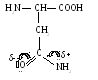
Кислые аминокислоты
А
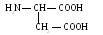 спарагиновая
кислота (асп)
спарагиновая
кислота (асп)
2. Глутаминовая кислота (глу)
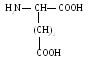
Основные аминокислоты
Л
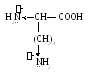 изин
(лиз)
изин
(лиз)
2 .
Аргинин (арг)
.
Аргинин (арг)
3. Гистидин (гис)

Литература:
1. Алейникова Т.Л. Руководство к практическим занятиям по биохимии/ Г.В.Рубцова, Н.А. Павлова. - М. : Медицина, 2000.
2. Березов Т.Т. Биологическая химия/ Т.Т. Березов, Б.Ф. Коровин– М. : Медицина, 2008.
3. Биохимия и молекулярная биология. Версия 1.0 [Электронный ресурс]: конспект лекций/ Н. М. Титова, А. А. Савченко, Т. Н. Замай и др. – Электрон. дан. (10 Мб). – Красноярск : ИПК СФУ, 2008.
4. Биохимия / под ред. Е.С. Северина.- 4-е изд., испр. — М. : ГОЭТАР – Мед, 2011. - 784 с.: ил. – (Серия «ХХI век»).
5. Биохимия с упражнениями и задачами/ Под ред. Е.С. Северина. — М.: ГОЭТАР – Мед, 2010.– (Серия «ХХI век»).
6. Биохимия человека : пер. с англ./ Р. Марри [и др.] – М. : Мир, 2004.- 381 с.
7. Кольман Я.— Г. Наглядная биохимия : пер. с нем./ Я. Кольман, К. Рем. — М. : Мир, 2000. — 469 с., ил.
8. Matta Cherif F. Quantum Biochemistry. Electronic Structure and Biological Activity. (Квантовая биохимия. Электронная структура и биологическая активность). – 2010. - 920 с.
9. Николаев А.Я. Биологическая химия/ А.Я. Николаев – 3-е изд., перераб. и доп. – М. : Мед. информ. Агентство, 2004. – 566 с.: ил.
10. Краткий курс с упражнениями и задачами/ Е.С. Северин, А.Я. Николаев — М. : ГОЭТАР – Мед, 2005. - 784 с.: ил. – (Серия «ХХI век»).
11. Щербак И.Г. Биологическая химия: учебник/ И.Г. Щербак– СПб. : Изд- во СПбГМУ, 2005 – 480 с.
