

1 5
с— теплоемкостьобразующегосяраствора, Дж/(г• K). Прималыхконцентрациях, теплоемкостьраствораможноприближеннопринятьравнойтеплоемкости воды. Прибольшихконцентрациях, теплоемкостьраствораможноопределитьпо справочным данным.
mi иci —массаитеплоемкостьсоставныхчастейкалориметра.
Точноопределитьmi иci непредставляется возможным. Поэтому ∑n |
mi ci |
i≥ |
3 |
обозначается символом К, называемым постоянной калориметра и определяетсяпоизменениютемпературыприрастворенииопределенногоколичества солисизвестнойтеплотойрастворения. К— постояннаякалориметра— количество тепла, которое необходимо подвести к участвующей в теплообмене части калориметра, чтобыподнятьеготемпературуна1K.
Уравнениетепловогобалансатогдазапишетсятогда
Q = [(m1 + m2 )c + K ]∆ T
Отсюда
K = ∆QT − (m1 + m2 )c
гдеQ = ∆ Нm2; ∆ Н— интегральнаятеплотарастворениясоли, кДж/грамм.
ВкачествесолисизвестнойтеплотойрастворенияможноиспользоватьKCl илиNH4Cl. Интегральныетеплотырастворениясолейданывсправочнике[1].
Всправочникеприведеныинтегральныетеплотырастворениядлястандартной температуры – 298 К. Если температура воды, в которой растворяют соль, отличается от стандартной, то теплота растворения будет иной. Поэтому опыт нужнопроводитьпристандартнойтемпературеилирассчитыватьинтегральную теплотурастворениядляданнойтемпературыспомощьюуравненийтипа
∆ Н= ∆ Н298 k (298 – Т). Гдеk — коэффициент, характерныйдлякаждойсоли.
Например, дляКСl ∆ Нуд = 256.9 – 3.89 (298 – T ), Дж/г.
Теплотарастворения солизависитотконцентрации образующегосяраствора. Поэтому необходимо рассчитать концентрацию раствора, образующегося прирастворениисолисизвестнойтеплотойрастворенияи, всоответствиисэтим, интерполяциейопределитьтеплотурастворенияэтойсолидляданнойконцентрациираствора, азатемрассчитатьпостояннуюкалориметра.
Знаяпостояннуюкалориметралегкорассчитатьтеплотурастворениянеизвестнойсоли. ДляэтогоопределяютизменениетемпературыприрастворениинеизвестнойсолиирассчитываютQ и∆ Н.
3.1. ПОЛУЧЕНИЕ ТЕМПЕРАТУРНЫХ ДАННЫХ
Приопределениидействительногоизменениятемпературыфиксируюттемпературу калориметрической жидкости в стакане, помещенном в подготовлен-
1 6 |
|
|
|
|
ныйдляработыкалориметр, дотехпор, покаизменениетемпературынестанет |
||||
одинаковыминезначительнымилиизменениетемпературынебудетнаблюдать- |
||||
ся (не менее 5 минут). Затем начинают термохимический опыт (например, ра- |
||||
створение соли), непрерывая записи температур. Это так называемый главный |
||||
период. По окончании главного периода, когда изменение температуры снова |
||||
станет равномерным, продолжают записывать температуру еще 5 минут, после |
||||
чегоопытсчитаюзаконченным. Перемешиваниежидкостимешалкойоблегчает |
||||
быстроедостижениетепловогоравновесиявкалориметре. |
|
|||
3.2. ОБРАБОТКА ПОЛУЧЕННЫХ ДАННЫХ |
|
|||
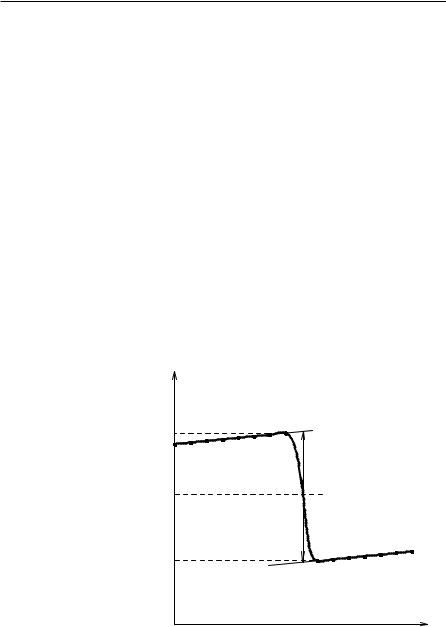
Пополученнымэкспериментальнымданнымстроитсяграфиквкоординатах |
||||
температура— время. Получающийсяграфикимеетследующийвид. |
||||
Время, относящеесякучасткуАВ, называется«начальнымпериодом», ВС— |
||||
«главнымпериодом», СD — «конечным». Чтобыопределитьдействительноеиз- |
||||
менение температуры ∆ T, проводят линии через точки, фиксирующие равно- |
||||
мерное изменение температуры начального и конечного периодов АВ и СD. За |
||||
начало главного периода принимают момент начала растворения соли, после |
||||
которогоначинаетсярезкоеизменениетемпературы, азаконецглавногопериода |
||||
— точку, которая первой ложится на прямую СD. Точки В и С проектируют на |
||||
ось ординат, находят середину отрезка mn и проводят линию kp. Через точку l |
||||
проводятвертикаль. Экст- |
|
|
|
|
раполируют линейные |
t |
|
|
|
участки АВ и СD (пунк- |
|
|
|
|
тирныелиниинаграфике) |
|
|
|
|
допересечениясвертика- |
m |
B |
F |
|
льювточкахЕиF. Отре- |
|
|||
зок EF соответствует из- |
A |
|
|
|
менению температуры |
|
|
|
|
∆ T в калориметрическом |
|
|
g |
p |
опытесучетомпоправки |
k |
|
||
натеплообмен. |
|
|
|
|
КрутизналинииВСза- |
|
|
|
D |
виситотхарактераиусло- |
|
|
C |
|
вий протекания исследу- |
n |
|
|
|
емого теплового процес- |
|
|
E |
|
са. Крутизна линий АВ и |
|
|
|
|
СD зависит от характера |
|
|
|
|
теплообмена с окружаю- |
|
|
|
|
щей средой. Таким обра- |
|
|
|
τ |
зом, повидукривойАВСD |
Рис. 4. График для определения действительного |
|||
можно судить о качестве |
изменениятемпературы |
|
|
|

1 7
проведенного опыта и учесть его недостатки при проведении следующих опытов. Точностьопределения изменениятемпературы засчеттепловогопроцесса являетсяосновнымфактором, определяющимточностьконечногорезультата.
3.3. ПРОВЕДЕНИЕЭКСПЕРИМЕНТА
Определениеинтегральныхтеплотрастворенияначинаютсопределенияпостояннойкалориметра. Дляэтогостакан, вкоторыйналито100 см3 дистиллированнойводы, устанавливаютвкалориметризакрываюткрышкойсукрепленным внейдатчикомтемпературы. Вотверстиекрышкивставляютспециальнуюпробирку, в которую предварительно насыпано 2 г измельченной соли с известной теплотойрастворения(KCl илиNH4Cl). Проводяткалориметрическийопытификсируютизменениетемпературы. Затемвыливаютизстаканараствор, ополаскиваютстакан, наливаютвнего100см3 дистиллированнойводыиустанавливаютв калориметр. Проводят растворение 2 г исследуемой соли, фиксируя при этом изменениетемпературы. Аналогичнопроводятрастворение4, 6, 8, 10, 12, 16, 20 и 30 гисследуемойсоли.
ЛИТЕРАТУРА
1.СтромбергА. Г., Семченко Д. П. Физическаяхимия. – М.: Химия, 1999. 528 с.
2.Краткийсправочникфизико-химическихвеличин/ Подред. А. А. Равделя, А. М. Пономаревой.– Л.: Химия, 1983, 321 с.

1 8
СОДЕРЖАНИЕ
ВВЕДЕНИЕ .............................................................................................................. |
3 |
1.ТЕРМОДИНАМИЧЕСКАЯТЕОРИЯРАСТВОРОВНЕЭЛЕКТРОЛИТОВ .... 5
1.1. Парциальные молярные величины и их значение |
|
в термодинамике растворов................................................................ |
5 |
1.2. Основные соотношения между парциальными |
|
молярнымивеличинами ......................................................................... |
7 |
МЕТОДИЧЕСКАЯЧАСТЬ .................................................................................. |
10 |
2.1. Аналитическиеметоды........................................................................... |
10 |
2.2. Графическиеметоды............................................................................... |
11 |
2.3. Вывод интерполяционной зависимости интегральной теплоты |
|
растворения от состава.................................................................... |
13 |
ПРАКТИЧЕСКАЯЧАСТЬ. |
|
ОПРЕДЕЛЕНИЕПАРЦИАЛЬНЫХМОЛЯРНЫХ |
|
ТЕПЛОТРАСТВОРЕНИЯ .............................................................................. |
14 |
3.1. Получениетемпературныхданных........................................................ |
15 |
3.2. Обработкаполученныхданных .............................................................. |
16 |
3.3. Проведение эксперимента ...................................................................... |
17 |
ЛИТЕРАТУРА........................................................................................................ |
17 |

1 9
Термодинамикарастворов «Определение парциальных молярных величин»
Методическоепособие
Составитель: Валерий Александрович Колпаков
Оригина-макет: КабакаевА.С.
