
- •1. Кінетика гомогенних хімічних реакцій
- •Виконання роботи
- •2. Кінетика гетерогенних процесів
- •Виконання роботи
- •3. Поверхневий натяг
- •Виконання роботи
- •4. Седиментація
- •Виконання роботи
- •5. Електропровідність
- •Виконання роботи
- •6. Електрорушийні сили (ерс)
- •Виконання роботи
- •7. Потенціометричне визначення рН
- •Виконання роботи
- •8. Електроліз
- •Виконання роботи
3. Поверхневий натяг
Шар рідини, що прилягає до її поверхні і дорівнює по товщині радіусові сфери молекулярної дії, називається поверхневим шаром.
Молекули рідини в поверхневому шарі знаходяться під дією сил притягання сусідніх молекул. Рівнодіюча цих сил притягання спрямована всередину рідини. Отже, переміщення молекул з глибини рідини в поверхневий шар вимагає виконання роботи на подолання сил молекулярного притягання.
Робота,
що необхідна для збільшення поверхні
рідини на одиницю, називається поверхневим
натягом. Поверхневий натяг можна
розглядати також як силу, що діє на
одиницю довжини контура поверхні рідини
і прагне скоротити цю поверхню. Одиниці
виміру поверхневого натягу
![]() ,
або
,
або![]() .
.
Зв'язок між адсорбцією і поверхневим натягом визначається рівнянням Гіббса:
|
|
(3.1) |
де Г
– питома адсорбція речовини,
![]() ,
тобто надмірна концентрація розчиненої
речовини в поверхневому шарі розчину
порівняно з його об’ємною концентрацієюс;
σ
- поверхневий натяг розчину,
,
тобто надмірна концентрація розчиненої
речовини в поверхневому шарі розчину
порівняно з його об’ємною концентрацієюс;
σ
- поверхневий натяг розчину,
![]() ;R
– універсальна газова стала,
;R
– універсальна газова стала,![]() ;Т
–
абсолютна температура, К.
;Т
–
абсолютна температура, К.
Похідна
![]() (зміна поверхневого натягу з концентрацією)
називається поверхневою активністю
розчиненої речовини.
(зміна поверхневого натягу з концентрацією)
називається поверхневою активністю
розчиненої речовини.
З рівняння
(3.1) випливає, що адсорбція додатня (Г
> 0), тоді, коли
![]() <
0. Це означає, що при адсорбції поверхневий
натяг зменшується. Речовини, які знижують
поверхневий натяг, називаються поверхнево
- активними (ПАР). ПАР по відношенню до
води є більшість органічних сполук,
молекули яких полярні: кислоти, спирти
та ін.
<
0. Це означає, що при адсорбції поверхневий
натяг зменшується. Речовини, які знижують
поверхневий натяг, називаються поверхнево
- активними (ПАР). ПАР по відношенню до
води є більшість органічних сполук,
молекули яких полярні: кислоти, спирти
та ін.
Адсорбція
від’ємна (Г
< 0) тоді, коли
![]() >
0. Це означає, що при адсорбції поверхневий
натяг збільшується. Речовини, які
збільшують поверхневий натяг називаються
поверхнево - інактивними (ПІР). ПІР по
відношенню до води є сильні електроліти.
>
0. Це означає, що при адсорбції поверхневий
натяг збільшується. Речовини, які
збільшують поверхневий натяг називаються
поверхнево - інактивними (ПІР). ПІР по
відношенню до води є сильні електроліти.
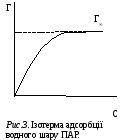 Якщо
концентрація розчину невелика, то
молекули адсорбованої речовини можуть
приймати горизонтальне положення і
вільно рухатись по поверхні рідини. Зі
збільшенням концентрації розчиненої
речовини адсорбція збільшується (рис.3),
і при досягненні граничної адсорбції
(Г∞)
на поверхні розчину буде знаходитись
мономолекулярний шар адсорбованих
молекул. При цьому молекули в адсорбційному
шарі будуть орієнтуватися полярною
групою в напрямку полярної фази (вода),
а неполярною – в напрямку неполярної
фази (повітря), рис. 4. За величиною
граничної адсорбції Г∞
Якщо
концентрація розчину невелика, то
молекули адсорбованої речовини можуть
приймати горизонтальне положення і
вільно рухатись по поверхні рідини. Зі
збільшенням концентрації розчиненої
речовини адсорбція збільшується (рис.3),
і при досягненні граничної адсорбції
(Г∞)
на поверхні розчину буде знаходитись
мономолекулярний шар адсорбованих
молекул. При цьому молекули в адсорбційному
шарі будуть орієнтуватися полярною
групою в напрямку полярної фази (вода),
а неполярною – в напрямку неполярної
фази (повітря), рис. 4. За величиною
граничної адсорбції Г∞
![]() можна визначити площу, яку займає одна
молекула та товщину адсорбційного
шару, який дорівнює довжині молекули.
можна визначити площу, яку займає одна
молекула та товщину адсорбційного
шару, який дорівнює довжині молекули.
Н ехай
при утворенні насиченого адсорбційного
шару адсорбувалосяГ∞
молів на 1 см2;
тоді площа, яку займає один моль буде:
ехай
при утворенні насиченого адсорбційного
шару адсорбувалосяГ∞
молів на 1 см2;
тоді площа, яку займає один моль буде:
![]() см2.
см2.
А площа, яку займає одна молекула в адсорбційному шарі, буде складати:
|
|
(3.2) |
де N – число Авогадро (6,023·1023 моль-1).
Якщо М
– молярна маса, а ρ
– густина адсорбованої речовини, то
об’єм моля
![]() ,
а об’єм окремої молекули
,
а об’єм окремої молекули![]() .
.
Якщо об’єм молекули поділити на площу, яку займає ця молекула, отримаємо довжину молекули l (або товщину адсорбційного шару).
|
|
(3.3) |
Одним із ефективних методів дослідження поверхневого натягу та адсорбції являється метод підрахунку крапель.
У цьому методі використовують прилад, який називається сталагмометром. Сталагмометр являє собою піпетку, що закінчується капіляром і має дві мітки, нанесені зверху та знизу нижньої кульки сталагмометра (рис. 5).
Для
визначення поверхневого натягу
досліджувану рідину затягують в прилад
вище за верхню мітку (1) надають можливість
їй вільно витікати. Як тільки меніск
рідини опуститься до верхньої мітки,
починають лічити краплі. Рахунок ведуть
до того часу, поки меніск не дійде до
нижньої мітки (2). Таким чином визначають
число крапель, які утворюються при
в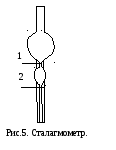 итіканні
обмеженого двома мітками об’єму рідини.
Об’єм краплі, що утворюється при відриві,
тим більший (а число капельn
тим менше), чим більший поверхневий
натяг рідини σ
і менша її густина ρ.
За допомогою сталагмометра проводять
порівняльне визначення поверхневого
натягу, тобто, визначають σ
досліджуваної рідини за відомим
поверхневим натягом стандартної рідини
σ0.
Як стандартну рідину часто використовують
воду. Значення σ0
для води при різних температурах наведено
у таблиці 3.1.
итіканні
обмеженого двома мітками об’єму рідини.
Об’єм краплі, що утворюється при відриві,
тим більший (а число капельn
тим менше), чим більший поверхневий
натяг рідини σ
і менша її густина ρ.
За допомогою сталагмометра проводять
порівняльне визначення поверхневого
натягу, тобто, визначають σ
досліджуваної рідини за відомим
поверхневим натягом стандартної рідини
σ0.
Як стандартну рідину часто використовують
воду. Значення σ0
для води при різних температурах наведено
у таблиці 3.1.
Якщо визначити число капель для води n0 і для досліджуваної рідини n, то за відомими густинами ρ0 і досліджуваної рідини ρ та поверхневим натягом води σ0, можна розрахувати поверхневий натяг досліджуваної рідини σ:
|
|
(3.4) |
Таблиця 3.1 – Поверхневий натяг води при різних температурах.
|
t, 0С |
16 |
17 |
18 |
19 |
20 |
21 |
22 |
23 |
24 |
25 |
|
|
73,3 |
73,2 |
73,1 |
72,9 |
72,7 |
72,6 |
72,4 |
72,3 |
72,1 |
72,0 |
