
Молекулярная физика
.pdf
МИНИСТЕРСТВО ОБЩЕГО И ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КАЗАНСКАЯ ГОСУДАРСТВЕННАЯ АРХИТЕКТУРНО-СТРОИТЕЛЬНАЯ АКАДЕМИЯ
Кафедра физики
МОЛЕКУЛЯРНАЯ ФИЗИКА, ТЕРМОДИНАМИКА.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
КРЕШЕНИЮ ЗАДАЧ ПО ФИЗИКЕ для студентов специальностей
2903, 2906, 2907, 2908, 2910
Казань
1998
Составитель В.Л. Фурер Под редакцией В.В. Алексеева, Л.И. Маклакова
УДК 530.1
МОЛЕКУЛЯРНАЯ ФИЗИКА, ТЕРМОДИНАМИКА. Методические указания к решению задач по физике для студентов специальностей 2903, 2906, 2907, 2908, 2910/ Казанская государственная архитектурно- строительная академия; Сост. В.Л. Фурер. Под редакцией В.В. Алексеева, Л.И. Маклакова. Казань, 1998 г. 18 с.
В работе приведены условия задач и основные формулы, необходи- мые для их решения.
Рецензент доцент кафедры молекулярной физики Казанского госуниверситета Пименов Г.Г.
© |
Казанская государственная |
|
архитектурно-строительная |
|
академия, 1998 г. |
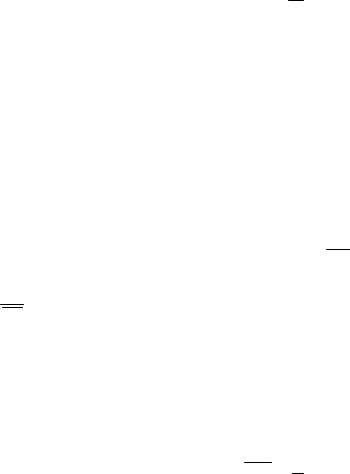
Идеальные газы подчиняются уравнению состояния Менделеева-
Клапейрона
pV = mm RT ,
где p - давление газа; V - его объем; T - термодинамическая температура; m - масса газа; μ - молярная масса газа; R = 8,31 Дж/(моль×К) - газовая по- стоянная; отношение ν = m μ дает количество газа.
μ дает количество газа.
По закону Дальтона давление смеси газов равно сумме их парциаль- ных давлений, т.е. тех давлений, которые имел бы каждый из газов в от- дельности, если бы он при данной температуре один заполнял весь объем.
Основное уравнение кинетической теории газов имеет вид
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
2 m0 υ2 |
|
|||
p = |
nW 0 |
= |
, |
|||||||
3 |
3 |
2 |
||||||||
где n - число молекул в единице объема; W0 - средняя кинетическая энер- гия поступательного движения одной молекулы; m0 - масса молекулы;

 υ2 - средняя квадратичная скорость молекул. Эти величины определя-
υ2 - средняя квадратичная скорость молекул. Эти величины определя-
ются следующими формулами: число молекул в единице объема n = p/(kT),
где k = R/N = 1,38×10-23 Дж/К - постоянная Больцмана; N = 6,02×1023 моль-1 - постоянная Авогадро; средняя кинетическая энергия поступательного
движения одной молекулы
W0 = 23 kT;
средняя квадратичная скорость молекул


 υ2 =
υ2 =  3RTm .
3RTm .
Энергия теплового движения молекул (внутренняя энергия) газа
W = 2i mm RT ,
где i - число степеней свободы молекул.
Связь между молярной C и удельной c теплоемкостями следует из их определения:
C = mc.
Молярная теплоемкость газа при постоянном объеме:
i CV = 2 R;
молярная теплоемкость при постоянном давлении:
Cp = CV + R.
Отсюда следует, что молярная теплоемкость C определяется числом степе- ней свободы i молекул газа:
для одноатомного газа (i = 3)
CV = 12,5 Дж/(моль×К), Cp = 20,8 Дж/(моль×К);
для двухатомного газа (i = 5)
CV = 20,8 Дж/(моль×К), Cp = 29,1 Дж/(моль×К);
для многоатомного газа (i = 6)
CV = 24,9 Дж/(моль×К), Cp = 33,2 Дж/(моль×К).
Закон Максвелла распределения молекул по скоростям позволяет найти наиболее вероятную скорость молекул υв = 
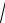 2RT
2RT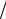 μ и среднюю
μ и среднюю
арифметическую скорость молекул
u = 
 8RTpm .
8RTpm .
Первое начало термодинамики может быть записано в виде dQ = dW + dA,
где dQ - количество теплоты, полученное газом; dW - изменение внутрен- ней энергии газа; dA = p×dV - работа, совершаемая газом при изменении его объема. Изменение внутренней энергии газа
dW = 2i mm RdT ,
где dT - изменение температуры. Полная работа, совершаемая при измене- нии объема газа,

V 2
A = ò pdV .
V 1
Работа, совершаемая при изотермическом изменении объема газа,
Аиз = RT |
m |
ln |
V 2 |
. |
|
m |
V 1 |
||||
|
|
|
Давление газа и его объем связаны при адиабатическом процессе уравне-
нием Пуассона
pV |
γ |
= const, т.е. |
p1 |
æV 2 |
ö |
γ |
|
|
= ç |
÷ |
, |
||
|
p2 |
|||||
|
|
|
èV 1 |
ø |
|
где показатель адиабаты γ = cp cV . Уравнение Пуассона может быть запи-
cV . Уравнение Пуассона может быть запи-
сано еще в таком виде: |
|
|
|
|
|
γ −1 |
|
TV γ −1 = const, т.е. T1 |
æ |
|
|
ö |
|||
= çV 2 |
÷ |
, |
|||||
или |
T 2 |
èV 1 |
ø |
|
|||
|
æ |
|
ö(1−γ ) γ |
||||
T p(1−γ ) γ = const, т.е. |
T1 |
p2 |
|||||
= ç |
÷ |
. |
|||||
|
T 2 |
è p1 |
ø |
|
|||
Работа, совершаемая при адиабатическом изменении объема газа, может
быть найдена по формуле
Aад = |
RT1 m êé |
æV 1 |
ö |
γ −1úù |
|
RT1 m æ |
|
T 2 |
ö |
p1V 1(T1 |
- T 2) |
||||||||
|
|
|
1 - ç |
|
÷ |
ûú |
= |
|
|
|
ç1 |
- |
|
÷ = |
|
|
, |
||
|
|
|
|
|
|
|
|
|
|||||||||||
|
g - 1 m |
ëê |
èV 2 |
ø |
|
g - 1 m è |
|
T1ø |
(g - 1)T1 |
||||||||||
где p1 и V1 - давление и объем газа при температуре T1 .
Уравнение политропического процесса имеет вид
pV n = const, или p1V 1n = p2V 2n ,
где n - показатель политропы (1 < n < γ).
Коэффициент полезного действия (к.п.д.) тепловой машины
h = Q1 - Q2 ,
Q1

где Q1− количество теплоты, полученное рабочим телом от нагревателя; Q2 − количество теплоты, отданное холодильнику. Для идеального цикла
Карно
η = T1 − T 2 ,
T1
где T1 и T 2 − термодинамические температуры нагревателя и холодильни-
ка.
Разность энтропий S B − S A двух состояний B и A определяется
формулой
− = B dQ
S B S A òA T .
1. УРАВНЕНИЕ МЕНДЕЛЕЕВА-КЛАПЕЙРОНА
1(5.1). Какую температуру t имеет масса m = 2 г азота, занимающего объем V= 820 см3 при давлении p = 0,2 МПа?
2(5.2). Какой объем V занимает масса m = 10 г кислорода при давле- нии p = 100 кПА и температуре t = 20° C?
3(5.3). Баллон объемом V = 12 л наполнен азотом при давлении
p = 8,1 МПа и температуре t = 17° С. Какая масса m азота находится в бал- лоне?
4(5.4). Давление воздуха внутри плотно закупоренной бутылки при температуре t1= 7° С было p1= 100 кПа. При нагревании бутылки пробка вылетела. До какой температуры t2 нагрели бутылку, если известно, что пробка вылетела при давлении воздуха в бутылке p2 = 130 кПа?
5(5.5). Каким должен быть наименьший объем V баллона, вмещаю- щего массу m = 6,4 кг кислорода, если его стенки при температуре
t = 20° С выдерживают давление p = 15,7 МПа?
6(5.6). В баллоне находилась масса m1 = 10 кг газа при давлении
p1 = 10 МПа. Какую массу m газа взяли из баллона, если давление стало равным p2 = 2,5 МПа? Температуру газа считать постоянной.
7(5.7). Найти массу m сернистого газа (SO2), занимающего объем V = 25 л при температуре t = 27° С и давлении p = 100 кПа.
8(5.8). Найти массу m воздуха, заполняющего аудиторию высотой
h = 5 м и площадью пола S = 200 м2. Давление воздуха p = 100 кПа; температура помещения t = 17° С. Молярная масса воздуха μ = 0,029 кг/моль9(5. .9). Во сколько раз плотность r1 воздуха, заполняющего помеще- ние зимой (t1 = 7° С), больше его плотности r2 летом (t2 = 37° С)? Давление газа считать постоянным.
10(5.12). Какое количество ν газа находится в баллоне объемом V = 10 м3 при давлении p = 96 кПа и температуре t = 17° С?
11(5.13). Массу m = 5 г азота, находящуюся в закрытом сосуде объемом V = 4 л при температуре t1 = 20° С, нагревают до температуры t2 = 40° С. Найти давления p1 и p2 газа до и после нагревания.
12(5.17). При температуре t = 50° С давление насыщенного водяного пара p = 12,3 кПа. Найти плотность ρ водяного пара.
13(5.19). Некоторый газ при температуре t = 10° С и давлении
p = 200 кПа имеет плотность ρ = 0,34 кг/м3. Найти молярную массу μ газа. 14(5.20). Сосуд откачан до давления p = 1,33×10-9 Па; температура
воздуха t = 15° С. Найти плотность ρ воздуха в сосуде.
15(5.21). Масса m = 12 г газа занимает объем V = 4 л при температуре t1 = 7° С. После нагревания газа при постоянном давлении его плотность стала равной ρ = 0,6 кг/м3. До какой температуры t2 нагрели газ?
16(5.23). В запаянном сосуде находится вода, занимающая объем, равный половине объема сосуда. Найти давление p и плотность ρ водяного пара при температуре t = 400° С, зная, что при этой температуре вся вода обращается в пар.
17(5.28). В сосуде находятся масса m1 = 14 г азота и масса m2 = 9 г водорода при температуре t = 10° С и давлении p = 1 МПа. Найти моляр- ную массу μ смеси и объем V сосуда.
18(5.29). Закрытый сосуд объемом V = 2 л наполнен воздухом при нормальных условиях. В сосуд вводится диэтиловый эфир (C2H5 OC2H5). После того как весь эфир испарился, давление в сосуде стало равным
p = 0,14 МПа. Какая масса m эфира была введена в сосуд?
19(5.32). В воздухе содержится 23,6% кислорода и 76,4% азота (по массе) при давлении p = 100 кПа и температуре t = 13° С. Найти плотность ρ воздуха и парциальные давления p1 и p2 кислорода и азота.
20(5.33). В сосуде находится масса m1 = 10 г углекислого газа и масса m2 = 15 г азота. Найти плотность ρ смеси при температуре t = 27° С и дав- лении p = 150 кПа.

2. МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ ИДЕАЛЬНОГО ГАЗА
1(5.34). Найти массу m0 атома: а) водорода; б) гелия.
2(5.36). Молекула аргона, летящая со скоростью v = 500 м/с, упруго ударяется о стенку сосуда. Направление скорости и нормаль к стенке сосу- да составляют угол a = 60°. Найти импульс F×Dt, полученный стенкой со- суда за время удара.
3(5.38). Какое число молекул n содержит единица массы водяного
пара?
4(5.39). В сосуде объемом V = 4 л находится масса m = 1 г водорода. Какое число молекул n содержит единица объема сосуда?
5(5.40). Какое число молекул N находится в комнате объемом V = 50 м3 при температуре t = 17° С и давлении p = 100 кПа.
6(5.46). Найти среднюю квадратичную скорость 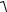
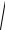 υ2 молекул возду-
υ2 молекул возду-
ха при температуре t = 17° С. Молярная масса воздуха m = 0,029 кг/моль. 7(5.47). Найти отношение средних квадратичных скоростей молекул
гелия и азота при одинаковых температурах.
8(5.49). Найти число молекул n водорода в единице объема сосуда при давлении p = 266,6 кПа, если средняя квадратичная скорость его моле-
кул 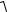
 υ2 = 2,4 км/с.
υ2 = 2,4 км/с.
9(5.50). Плотность некоторого газа r = 0,06 кг/м3, средняя квадра-
тичная скорость его молекул 
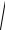 υ2 = 500 м/с. Найти давление p, которое газ
υ2 = 500 м/с. Найти давление p, которое газ
оказывает на стенки сосуда.
10(5.52). Найти импульс mv молекулы водорода при температуре
t = 20° С. Скорость молекулы считать равной средней квадратичной скоро- сти.
11(5.53). В сосуде объемом V = 2 л находится масса m = 10 г кисло- рода при давлении p = 90,6 кПа. Найти среднюю квадратичную скорость

 υ2 молекул газа, число молекул N, находящихся в сосуде, и плотность r
υ2 молекул газа, число молекул N, находящихся в сосуде, и плотность r
газа.
12(5.55). Средняя квадратичная скорость молекул некоторого газа
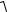
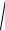 υ2 = 450 м/с. Давление газа p = 50 кПа. Найти плотность r газа при этих условиях.
υ2 = 450 м/с. Давление газа p = 50 кПа. Найти плотность r газа при этих условиях.
13(5.56). Плотность некоторого газа r = 0,082 кг/м3 при давлении

p = 100 кПа и температуре t = 17° С. Найти среднюю квадратичную ско-
рость 
 υ2 молекул газа. Какова молярная масса μ этого газа?
υ2 молекул газа. Какова молярная масса μ этого газа?
14(5.59). Найти внутреннюю энергию W массы m = 1 г воздуха при температуре t = 15° С. Молярная масса воздуха μ = 0,029 кг/моль.
15(5.60). Найти энергию WВР вращательного движения молекул, со- держащихся в массе m = 1 кг азота при температуре t = 7° С.
16(5.62). Энергия поступательного движения молекул азота, находя- щегося в баллоне объемом V = 20 л, W = 5 кДж, а средняя квадратичная
скорость его молекул 
 υ2 = 2×103 м/с. Найти массу m азота в баллоне и
υ2 = 2×103 м/с. Найти массу m азота в баллоне и
давление p, под которым он находится.
17(5.68). Найти отношение удельных теплоемкостей сp/cV для кисло-
рода.
18(5.69). Удельная теплоемкость некоторого двухатомного газа cp = 14,7 кДж/(кг×К). Найти молярную массу μ этого газа.
19(5.70). Плотность некоторого двухатомного газа при нормальных условиях ρ = 1,43 кг/м3. Найти удельные теплоемкости cv и cp этого газа.
20(5.77). Найти отношение cp /cv для газовой смеси, состоящей из массы m1 = 8 г гелия и m2 = 16 г кислорода.
3. ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ
1(5.80). Масса m = 12 г азота находится в закрытом сосуде объемом V = 2 л при температуре t = 10° С. После нагревания давление в сосуде стало равным p = 1,33 МПа. Какое количество теплоты Q сообщено газу при на- гревании?
2(5.82). В закрытом сосуде находится масса m = 14 г азота при дав- лении p1= 0,1 МПа и температуре t1 = 27° С. После нагревания давление в сосуде повысилось в 5 раз. До какой температуры t2 был нагрет газ? Найти объем V сосуда и количество теплоты Q, сообщенное газу.
3(5.83). Какое количество теплоты Q надо сообщить массе m = 12 г кислорода, чтобы нагреть его на t = 50° C при p = const?
4(5.86). Какую массу m углекислого газа можно нагреть при
p = const от температуры t1 = 20° С до температуры t2 = 100° С количест- вом теплоты Q = 222 Дж? На сколько при этом изменится кинетическая энергия одной молекулы?
5(5.87). В закрытом сосуде объемом V = 2 л находится азот, плот-
ность которого ρ = 1,4 кг/м3. Какое количество теплоты Q надо сообщить азоту, чтобы нагреть его на T = 100° К?
6(5.88). Азот находится в закрытом сосуде объемом V = 3 л при тем- пературе t1 = 27° С и давлении p1 = 0,3 МПа. После нагревания давление в сосуде повысилось до p2 = 2,5 МПа. Найти температуру t2 азота после на- гревания и количество теплоты Q, сообщенное азоту.
7(5.89). Для нагревания некоторой массы газа на t1 = 50° С при
p = const необходимо затратить количество теплоты Q1 = 670 Дж. Если эту же массу газа охладить на t2 = 100° С при V = const, то выделяется коли- чество теплоты Q2 = 1005 Дж. Какое число степеней свободы i имеют мо- лекулы этого газа?
8(5.90). Масса m = 10 г азота находится в закрытом сосуде при тем- пературе t1 = 7° С. Какое количество теплоты Q надо сообщить азоту, что- бы увеличить среднюю квадратичную скорость его молекул вдвое? Во сколько раз при этом изменится температура и давление газа на стенки со- суда?
9(5.91). Гелий находится в закрытом сосуде объемом V = 2 л при температуре t1 = 20° С и давлении p1 = 100 кПа. Какое количество теплоты Q надо сообщить гелию, чтобы повысить его температуру на t = 100° С?
Каковы будут при новой температуре средняя квадратичная скорость

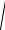 υ2 его молекул, давление p2, плотность гелия и энергия теплового дви-
υ2 его молекул, давление p2, плотность гелия и энергия теплового дви-
жения W его молекул.
10(5.92). В закрытом сосуде объемом V = 2 л находится масса m азота и масса m аргона при нормальных условиях. Какое количество теплоты Q надо сообщить, чтобы нагреть газовую смесь на t = 100° С.
11(5.159). Масса m = 10 г кислорода находится при давлении
p = 100 кПа и температуре t = 10° С. После нагревания при p = const газ за- нял объем V = 10 л. Найти количество теплоты Q, полученное газом, изме- нение W внутренней энергии и работу А, совершенную газом при расшире- нии.
12(5.160). Масса m = 6,5 г водорода, находящегося при температуре t = 27° С, расширяется вдвое при p = const за счет притока тепла извне. Найти работу А расширения газа и количество теплоты Q, сообщенное га- зу.
