
- •ХИМИЯ d - ЭЛЕМЕНТОВ
- •В периодической системе 37 d-элементов: в четвертом, пятом и шестом периодах находятся по
- •Все d-элементы делятся на подгруппы
- •D-элементы в кристаллическом состоянии обладают не чисто металлической связью, а ковалентно-металлической. Поэтому все
- •Вследствие незаполненности d- оболочек и наличия близких по энергии незаполненных ns- и np-
- •[(Zn(NH3)4)]Cl2 — хлорид тетраамминцинка(II) [Co(NH3)6]Cl2 — хлорид гексаамминкобальта(II)
- •d-элементы IIIВ–VIIВ подгрупп в высших степенях окисления по свойствам подобны соответствующим p-элементам. Так,
- •Сульфиды свинца (галенит или свинцовый блеск), ртути (киноварь), железа (пирит или железный колчедан),
- •Энергии ионизации d-элементов в сравнении с другими металлами велики, но они компенсируются большими
- •Восстановленная
- •Отличительной особенностью переходных элементов является образование фаз переменного состава
- •Велика роль соединений d-элементов в каталитических, в том числе биохимических процессах. Почти все
- •В I B-погруппу периодической системы входят медь, серебро и золото. Хотя все они

ХИМИЯ d - ЭЛЕМЕНТОВ
Подготовил
Пикалов О.
В периодической системе 37 d-элементов: в четвертом, пятом и шестом периодах находятся по 10 d-элементов, образующих так называемые «вставные декады». В незаконченном седьмом периоде только 7 d-элементов

Все d-элементы делятся на подгруппы
Группы и электронные формулы 3d–6d-элементов, характерные степени окисления
IIIB
Sc 3d14s
2
3
Y 4d15s
2
3
La 5d16s
2
3
Ac 6d17s
2
3
IVB
Ti 3d24s2 2, 3, 4
Zr 4d25s2 3, 4
Hf 5d26s2 3, 4
Rf 6d27s2
–
VB |
VIB |
VIIB |
|
|
V |
Cr |
Mn |
Fe |
|
3d54s1 |
3d54s2 |
3d64s2 |
||
3d34s2 |
||||
1, 2, 3, 4 2, 3, 4, 5 2, 3, 4, 5 |
||||
2, 3, 4, 5 |
||||
|
, 5, 6 |
, 6, 7 |
, 6 |
|
Nb |
Mo |
Tc |
Ru |
|
4d55s1 |
4d55s2 |
|||
4d45s1 |
4d75s1 |
|||
2, 3, 4, 5 2, 3, 4, 5 |
||||
3, 4, 5 |
, 6 |
, 6, 7 |
1–8 |
|
|
|
|||
Ta |
W |
Re |
Os |
|
5d56s2 |
||||
5d36s2 |
5d46s2 |
5d66s2 |
||
2, 3, 4, 5 |
||||
3, 4, 5 |
– |
, 6, 7 |
1–8 |
|
|
|
|
||
Db |
Sg |
Bh |
Hn |
|
6d37s2 |
6d47s2 |
6d57s2 |
6d67s2 |
|
– |
– |
– |
– |
|
VIIIB |
|
IB |
IIB |
Co |
Ni |
Cu |
Zn |
3d74s2 |
3d84s2 |
3d104s1 |
3d104s2 |
2, 3, 4 |
2, 3, 4 |
1, 2, 3 |
2 |
Rh |
Pd |
Ag |
Cd |
4d85s1 |
4d105s0 |
4d105s1 |
4d105s2 |
1–6 |
2–5 |
1, 2 |
2 |
Ir |
Pt |
Au |
Hg |
5d76s2 |
5d96s1 |
5d106s1 |
5d106s2 |
1–6 |
2–6 |
1, 3, 5 |
1, 2 |
Mt |
|
|
|
6d77s2 |
– |
– |
– |
– |
|
|
|

D-элементы в кристаллическом состоянии обладают не чисто металлической связью, а ковалентно-металлической. Поэтому все они твердые (кроме Hg) и тугоплавкие (за исключением Zn,
Cd) металлы

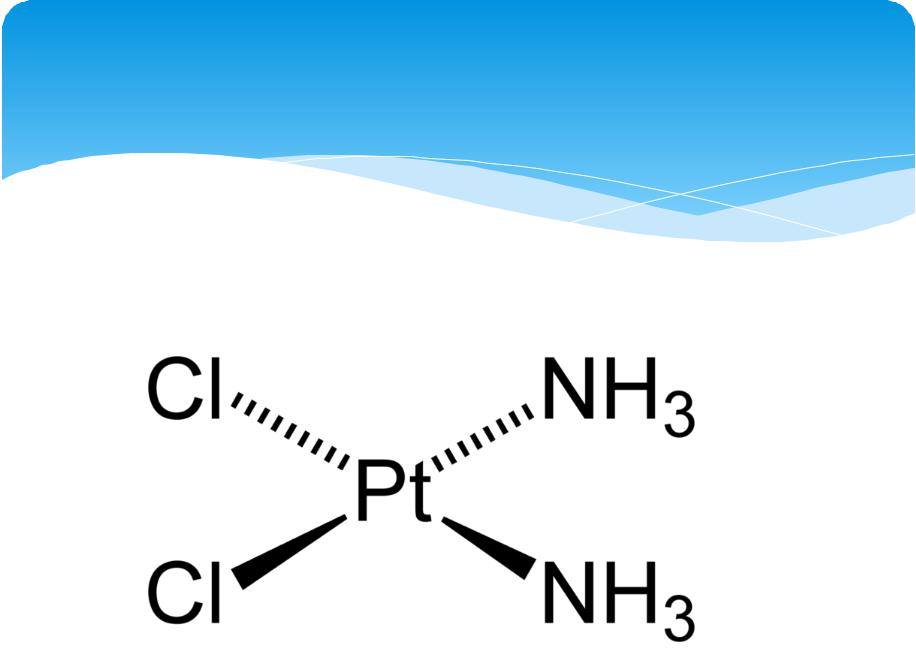
Вследствие незаполненности d- оболочек и наличия близких по энергии незаполненных ns- и np- уровней, d-элементы склонны к комплексообразованию

[(Zn(NH3)4)]Cl2 — хлорид тетраамминцинка(II) [Co(NH3)6]Cl2 — хлорид гексаамминкобальта(II)
K2[BeF4] — тетрафторобериллат(II) калия Li[AlHлития4] — тетрагидридоалюминат(III) K3[Fe(CN)6] —
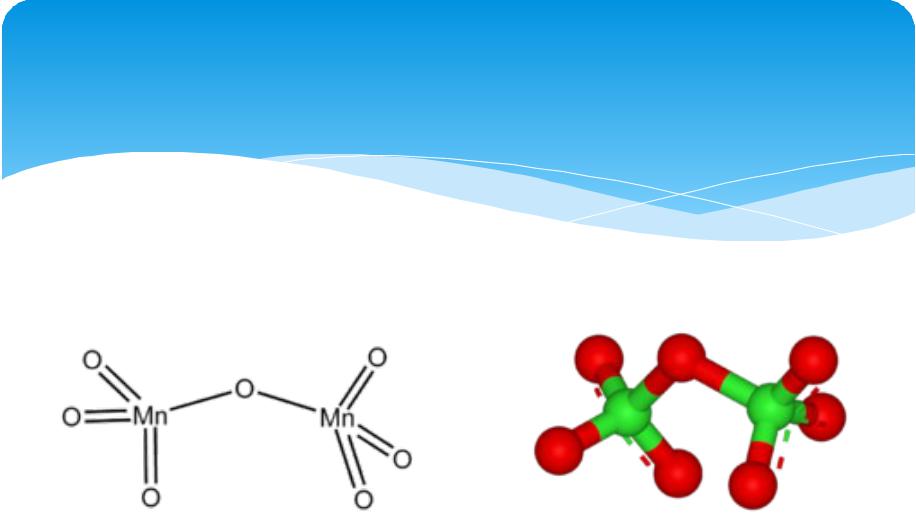
d-элементы IIIВ–VIIВ подгрупп в высших степенях окисления по свойствам подобны соответствующим p-элементам. Так, в высших степенях окисления Mn (VII) и Cl (VII) являются электронными аналогами

Сульфиды свинца (галенит или свинцовый блеск), ртути (киноварь), железа (пирит или железный колчедан), цинка (бленда)
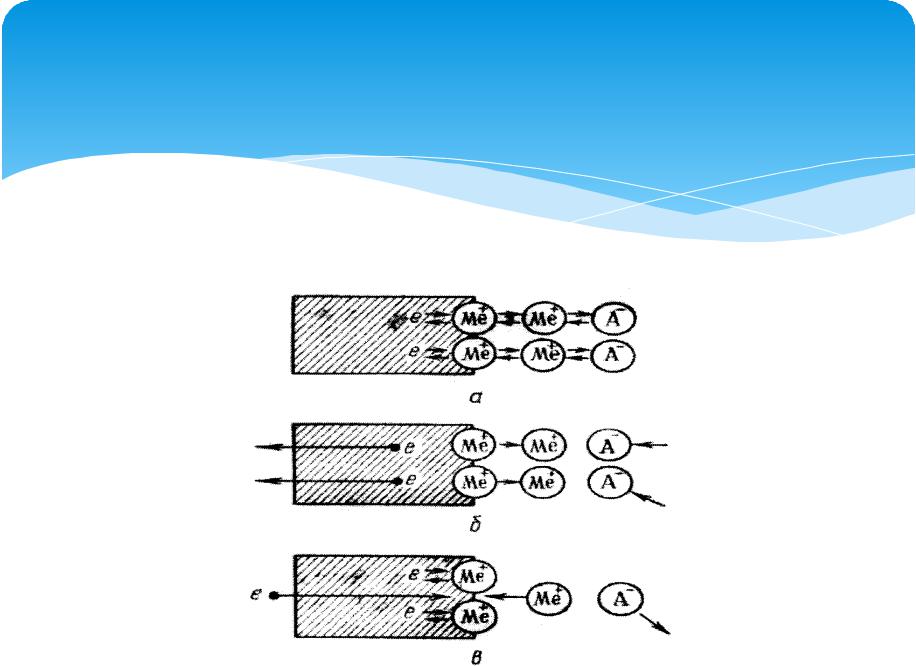
Энергии ионизации d-элементов в сравнении с другими металлами велики, но они компенсируются большими энтальпиями гидратации их ионов. Вследствие этого электродные потенциалы большинства d-элементов отрицательны
