
4) Распределение максвелла по скорости.
Когда
под подсистемой имеют виду тело являющейся
частью большой системы и рассматривают
влияние на данное тело окружающей среды.
Гипсон вывел эту формулу
![]() тогда
вероятность того что тело имеет импульс
тогда
вероятность того что тело имеет импульс![]() и
координату
и
координату![]() .
.
![]() .
Полная энергия системы зависит от
координат и импульсов. А можно наити из
условия нормировки
.
Полная энергия системы зависит от
координат и импульсов. А можно наити из
условия нормировки
![]() .
.
Рассмотрим
газ. Полная энергия может быть рассмотрена
как сумма
![]() и
и![]() энергии.
Причем кинетическая зависит только от
импульсов а потенциальная от взаимного
расположения частиц, т.е от ее координаты.
энергии.
Причем кинетическая зависит только от
импульсов а потенциальная от взаимного
расположения частиц, т.е от ее координаты.
![]() .
.
![]() тогда
вероятность того что частица имеет
импульс в интервале
тогда
вероятность того что частица имеет
импульс в интервале
![]() и
координату
и
координату![]() равна
равна
![]() вероятность
разбиваем на произведение 2-х сомножителей
один зависит только от импульсов а
другой только от координат. Вероятность
одновременного появления 2-х независимых
событии равна произведению вероятности
этих событии.
вероятность
разбиваем на произведение 2-х сомножителей
один зависит только от импульсов а
другой только от координат. Вероятность
одновременного появления 2-х независимых
событии равна произведению вероятности
этих событии.
В
ф-ле произведение вероятностей того
что частица имеет импульс![]() и
координату
и
координату![]() .
.
![]() это
значит что эти 2 события не связаны.
это
значит что эти 2 события не связаны.
В
идеальном газе взаимодействия вместе
с частицей отсутствует.
![]()
![]() .
Кинетическая энергия частицы равна
.
Кинетическая энергия частицы равна![]() тогда
тогда
![]() .
.
![]() также с y,z!
также с y,z!![]() .
Экспоненту можно представить в виде
произведения трех экспонент. Коэффициент
А определяется из условия нормировки
.
Экспоненту можно представить в виде
произведения трех экспонент. Коэффициент
А определяется из условия нормировки
![]() .
.
![]() .
.![]() ,
,![]()
![]() ;
;![]() .
.![]() .
.
![]()
![]() Вероятность того
что частица имеет
Вероятность того
что частица имеет
![]() в
интервале
в
интервале![]() ,
с y,z
так же.
,
с y,z
так же.
![]() ,
,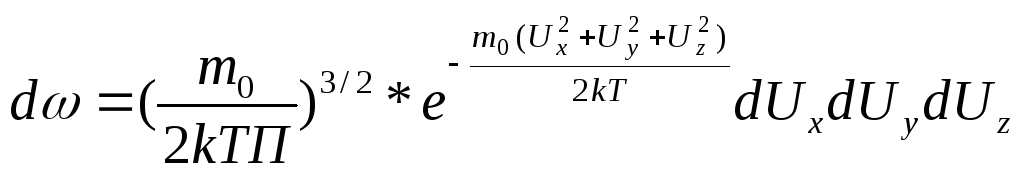 ;
;![]() с y,z
так же. Это
распределение максвелла по компонентам
скорости.
с y,z
так же. Это
распределение максвелла по компонентам
скорости.
![]() ;
;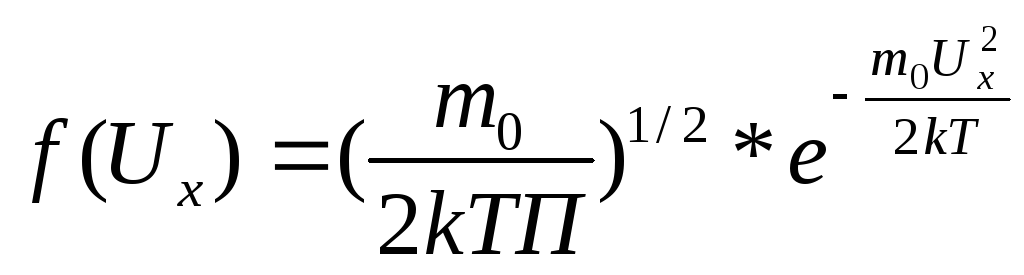 ;
;![]() (рис.)
В сферической системе координат
(рис.)
В сферической системе координат
![]() тогда
подставляем это в функцию распределения
тогда
подставляем это в функцию распределения
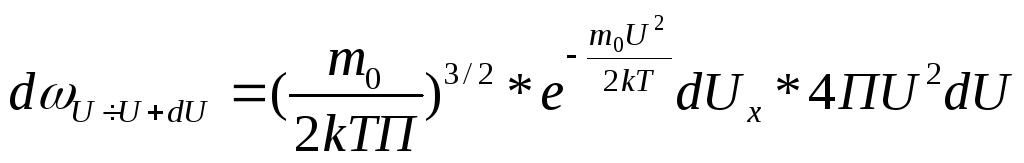 ,
,![]() .
.
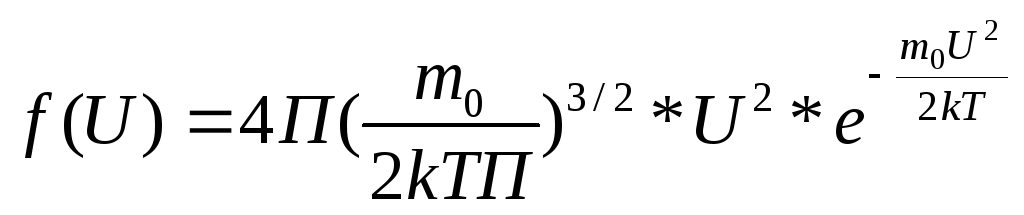 .
Ф-ция распределения состоит из 2-
множителей один растет другой убывает.
Следовательно ф-ция распределения имеет
максимум.
.
Ф-ция распределения состоит из 2-
множителей один растет другой убывает.
Следовательно ф-ция распределения имеет
максимум.
График функции распределения по скоростям.
С корость
при которой ф-ция распределения принимаетmax
значения называется наиболее
вероятная скорость. Чтоб
ее наити надо
корость
при которой ф-ция распределения принимаетmax
значения называется наиболее
вероятная скорость. Чтоб
ее наити надо
![]() .
.
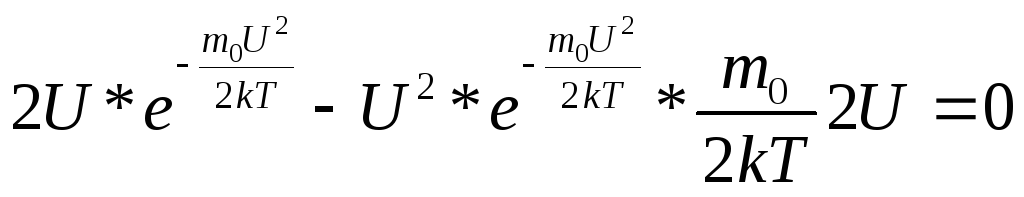 Решения:
1)
Решения:
1)![]() соответствует
минимуму (2)
соответствует
минимуму (2)![]() соответствует
минимуму (3)
соответствует
минимуму (3)![]() ;
;![]() .
Зная функцию распределения можно наити
среднее значение любой физической
величины зависящее от абсолютной
скорости. Средняя
скорость
.
Зная функцию распределения можно наити
среднее значение любой физической
величины зависящее от абсолютной
скорости. Средняя
скорость
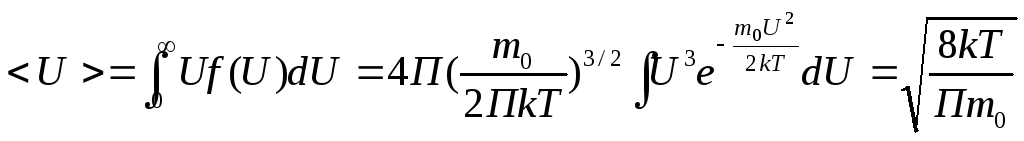 .
.
Средняя
квадратичная скорость
![]() .
Все скорости зависят от температуры с
ростом температуры наиболее вероятностная
скорость тоже увеличивается. Площадь
под кривой
.
Все скорости зависят от температуры с
ростом температуры наиболее вероятностная
скорость тоже увеличивается. Площадь
под кривой
![]() не
изменяется. Значит с увеличением
температуры max
скорость смешается в сторону увеличения
и размазывается.
не
изменяется. Значит с увеличением
температуры max
скорость смешается в сторону увеличения
и размазывается.
Зная
ф-цию распределения по скоростям можно
определить ф-цию
распределения по энергии.
(рис.)![]() .
.![]() где
где![]() -
число частиц которые имеют скорость в
интервале,
-
число частиц которые имеют скорость в
интервале,![]() -
полное число частиц.
-
полное число частиц.
![]() каждому
значению скорости соответствует
определенное значение энергии (рис.)
каждому
значению скорости соответствует
определенное значение энергии (рис.)
![]() число
частиц которые имеет энергию в интервале.
число
частиц которые имеет энергию в интервале.
![]() число частиц скорость
которых лежит в интервале
число частиц скорость
которых лежит в интервале![]() тогда
вероятность того что часть частиц имеют
скорость
тогда
вероятность того что часть частиц имеют
скорость
![]() ;
;![]() .
Между энергией и скоростью существует
однозначное соответствие.
.
Между энергией и скоростью существует
однозначное соответствие.
![]() (рис.)
(рис.)![]() число частиц энергия которых лежит в
интервале
число частиц энергия которых лежит в
интервале![]() тогда вероятность того что часть частиц
имеют энергию;
тогда вероятность того что часть частиц
имеют энергию;
![]() ;
;![]() .
Из-за того что между скоростью и энергией
есть соответствие число частиц которые
имеют скорость в интервале равно числу
частиц которые имеют энергию в интервале.
.
Из-за того что между скоростью и энергией
есть соответствие число частиц которые
имеют скорость в интервале равно числу
частиц которые имеют энергию в интервале.
![]() .
.
![]() .
.
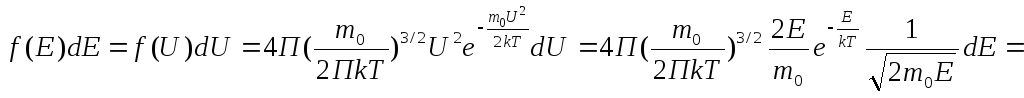
![]() ;
;![]() .
Зная функцию распределения по энергиям
можно определить
среднее значение энергии.
.
Зная функцию распределения по энергиям
можно определить
среднее значение энергии.![]() -
получили туже формулу что и из основного
Ур-ия МКТ.
-
получили туже формулу что и из основного
Ур-ия МКТ.
Зная
функцию распределения по скоростям
можно определить среднее значение
импульса.![]() (рис.)
(рис.)
![]() .
Из-за того что
.
Из-за того что
![]() и
и
![]() однозначно
соответственны то
однозначно
соответственны то
![]() ;
;![]() ;
;![]()
![]() .
.
Барометрическая формула.
В
атмосфере молекулы газа находятся в
поле тяготения однако молекулы не падают
на землю ,т.к они в тепловом хаотическом
движении. Поле тяготения не позволяет
молекулам разлетаться таким образом в
атмосфере устанавливается стационарное
состояние при котором давление уменьшается
с ростом высоты. Возьмем высоту![]() с
давлением
с
давлением
![]() и
чуть выше высоту
и
чуть выше высоту
![]() с
давлением
с
давлением![]() .
.![]() ,
,![]() -
одинкова. Тогда
-
одинкова. Тогда
![]() ;
;![]() .
.
![]() ;
;![]() .
.
![]() ,
,![]() ;
;![]() ;
;![]() ,
,![]() ;
;![]() Если
Если![]() то
то![]() ,
,![]() то
то![]() ,
,![]() ,
,![]() ,
с ростом высоты давление уменьшается
,
с ростом высоты давление уменьшается
![]() потенциальная
энергия молекулы
потенциальная
энергия молекулы
![]() -
чем больше масса тем меньше давление.
-
чем больше масса тем меньше давление.
Зависимость
концентрации от высоты.
![]() концентрация
уменьшается с ростом высоты. Чем тяжелее
газ тем меньше давление и концентрация.
концентрация
уменьшается с ростом высоты. Чем тяжелее
газ тем меньше давление и концентрация.
Распределение
Максвелла Больцмана.
Вероятность того что молекула имеет
проекции скоростей
![]() так
же с y
и z.
И координаты
так
же с y
и z.
И координаты![]() так же с y
и z.
Равна
так же с y
и z.
Равна
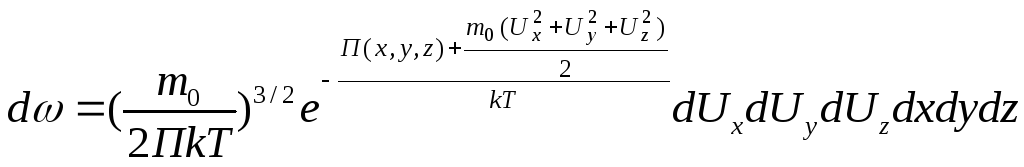 .
.
Температура.
Если 2 соприкасающихся тела находятся
в состоянии теплового равновесия т.е
не происходит теплообмен между телами
тогда этим телам приписывают одинаковую
температуру. Если одно тело передает
другому тепло путем теплопередачи то
первому телу приписывается большая
температура чем второму. Количественная
характеризация температуры – ряд
физических св-в зависят от нее. Репейные
точки это точки в которых определенным
физическим св-вам приписывается какая-то
температура. При установлении шкалы
Цельсия выбираются 2 репейные точки
при![]() Па.
1-я температура при которой замерзает
вода
Па.
1-я температура при которой замерзает
вода
![]() .
2-я вода кипит
.
2-я вода кипит![]() .
Объем термометрического тела при
.
Объем термометрического тела при![]() имеет
имеет![]() ,
при
,
при
![]() имеет
имеет![]() .Тогда
при любой температуре объем термометрического
тела
.Тогда
при любой температуре объем термометрического
тела
![]() .
.
В
физике используется термодинамическая
шкала температуры которая строится по
1-ой репейной точки при![]() Па
в которой вода, лед, пар в термодинамическом
равновесии.
Па
в которой вода, лед, пар в термодинамическом
равновесии.
При
нормальном давлении температура
замерзания воды Т=273,16К. Для перехода из
Цельсия в кельвина
![]() .
.
5)Внутренняя
энергия это
кинетическая энергия хаотического
движения частиц и потенциальная энергия
их взаимодействия. В опред не входят –
кинетическая энергия газа перемещаемого
как целое вместе с сосудом. Во внутреннюю
энергию не входят потенциальная энергия
частиц в поле силы тяготения, если газ
идеальный то взаимодействие между
частицами нет тогда внутренняя энергия
это только хаотическое движение частиц
![]() ,
,
![]() средняя
энергия приходящаяся на одну частицу.
средняя
энергия приходящаяся на одну частицу.
![]() ;
;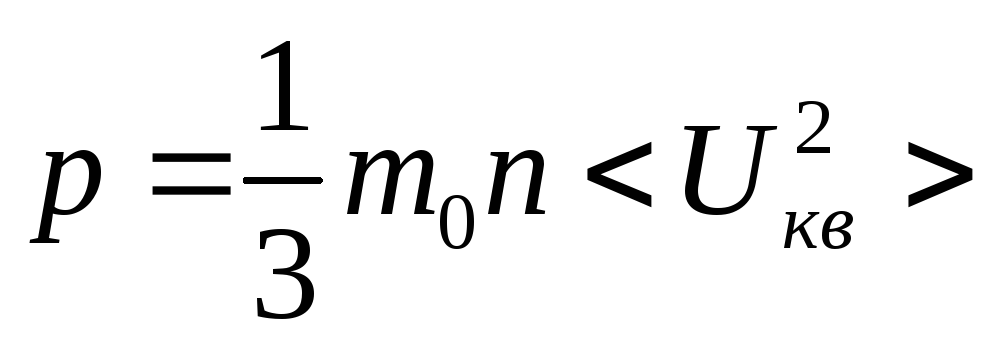 ;
;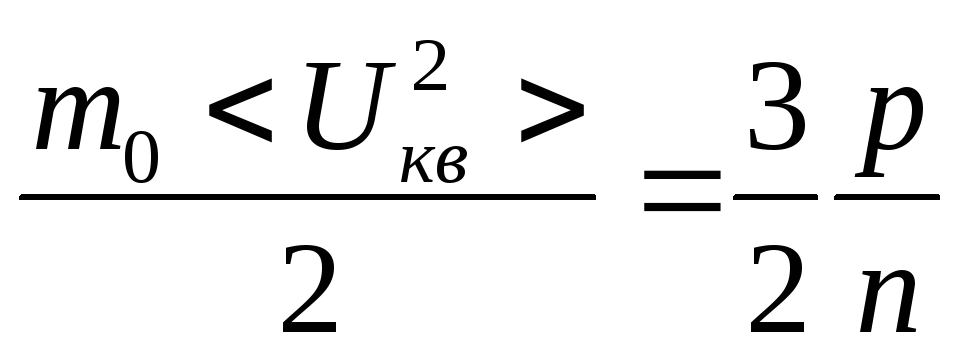 ;
;![]() ;
;![]() -
молекулы одноатомного газа.
-
молекулы одноатомного газа.
![]() -число
степеней свободы
число независимых переменных в помощью
которых можно определить положение
молекул
-число
степеней свободы
число независимых переменных в помощью
которых можно определить положение
молекул
1)Для
одноатомного газа:![]()
2)2-х
атомного![]()
3)3-х
атомного![]()
в
одноатомном энергия![]() значит
на каждое поступательное движение
приходится
значит
на каждое поступательное движение
приходится![]() .
При высоких температурах можно рассмотреть
в 2-х и 3-х атомных молекулах колебательные
степени свободы.
.
При высоких температурах можно рассмотреть
в 2-х и 3-х атомных молекулах колебательные
степени свободы.
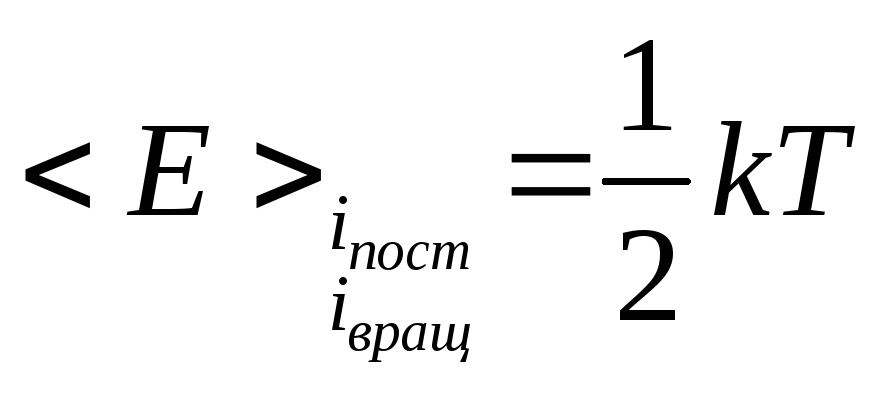 ;
;![]() .
Рассмотрим как суперпозиции колебательно
и вращательное движение
.
Рассмотрим как суперпозиции колебательно
и вращательное движение![]() ;
;![]() ;
;![]()
![]() ;
;![]() .
.
![]() идеального
газа зависит только от температуры и
от вида газа. Внутренняя энергия является
ф-цией состояния т.е если система попадает
в данное состояние то
идеального
газа зависит только от температуры и
от вида газа. Внутренняя энергия является
ф-цией состояния т.е если система попадает
в данное состояние то![]() не
зависит от способа перехода и предыстории
определяется только для данного
состояния.
не
зависит от способа перехода и предыстории
определяется только для данного
состояния.
![]() (рис.)
Если совершается круговой процесс т.е
система переходит в исходное состояние
то изменения
(рис.)
Если совершается круговой процесс т.е
система переходит в исходное состояние
то изменения
![]()
![]() ,
т.е внутренняя энергия является полным
дифференциалом.
,
т.е внутренняя энергия является полным
дифференциалом.
Первое начало термодинамики.
Изменение![]() происходит
за счет 1)сообщения газу количества
теплоты 2)совершения работы. Процессы
которые приводят к передаче энергии
называются процессами теплопередачи.
Количество теплоты
происходит
за счет 1)сообщения газу количества
теплоты 2)совершения работы. Процессы
которые приводят к передаче энергии
называются процессами теплопередачи.
Количество теплоты
![]() это
энергия сообщаемая системе путем
процесса теплопередачи.
это
энергия сообщаемая системе путем
процесса теплопередачи.
![]() положительно
если сообщает системе тепло и отрицательна
если наоборот. Работа положительна если
совершается над внешними силами и
отрицательна если внешними силами над
газом. Происходит увеличение
положительно
если сообщает системе тепло и отрицательна
если наоборот. Работа положительна если
совершается над внешними силами и
отрицательна если внешними силами над
газом. Происходит увеличение![]() и
совершается работа против внешних сил.
и
совершается работа против внешних сил.
1-ое
начало термодинамики.![]() ,
,![]() работа
против внешних сил,
работа
против внешних сил,
![]() количество
теплоты сообщаемое системе. Изменения
полной энергии являются полным
дифференциалом.
количество
теплоты сообщаемое системе. Изменения
полной энергии являются полным
дифференциалом.
![]() ,
,![]() ,
,![]() .
.
Работа
газа при изменении объема.
![]() ;
;![]() .
.![]() результат
зависит от
результат
зависит от
![]() .
.
![]() -численно
равна площади под кривой
-численно
равна площади под кривой
![]() Если
Если![]() то
то
![]()
![]() ,
Если
,
Если![]() то
то
![]()
![]() ,
в ходе кругового
процесса работа и положительна и
отрицательна (рис.)
,
в ходе кругового
процесса работа и положительна и
отрицательна (рис.)
![]() .
.
![]() численно
равна площади под кривой
численно
равна площади под кривой![]() .
.![]() численно равна площади под кривой
численно равна площади под кривой![]() .
Работа за цикл численно равна площади
внутри контура. Если цикл по часовой
стрелке то то
.
Работа за цикл численно равна площади
внутри контура. Если цикл по часовой
стрелке то то
![]()
![]() прямои
переход, Если против то
прямои
переход, Если против то
![]()
![]() обратный
переход.
обратный
переход.
Теплоемкость
молярная
![]() количество
теплоты сообщаемое одному молю в-ва для
того чтоб температура изменилась на 1
градус кельвина. Удельная
теплоемкость
количество
теплоты сообщаемое одному молю в-ва для
того чтоб температура изменилась на 1
градус кельвина. Удельная
теплоемкость
![]() количество теплоты сообщаемое одному
кило в-ва для того чтоб температура
изменилась на 1 градус кельвина.
количество теплоты сообщаемое одному
кило в-ва для того чтоб температура
изменилась на 1 градус кельвина.
![]() .
.
![]() .
.
![]() ,
,![]() т.е
невозможно создать двигателя первого
рода.
т.е
невозможно создать двигателя первого
рода.
Теплоемкость при постоянном объеме.
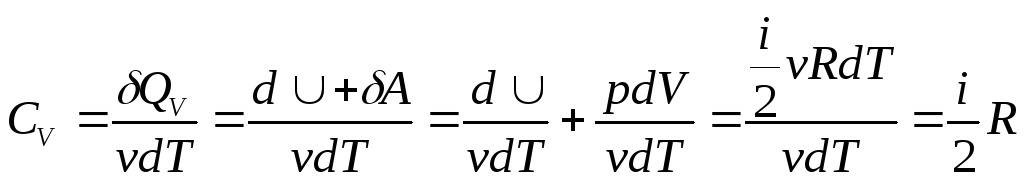 ,
,![]() ;
;![]() ,
,![]() .
.
Теплоемкость при постоянном давлении.
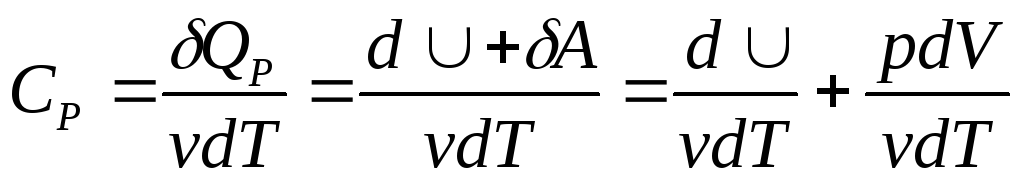 ,
,![]() ;
;![]() ,
,![]() ,
,![]() .
.![]() .
Физически смысл
.
Физически смысл![]() это
работа совершаемая газом при постоянном
давлении над 1 молем газа, при котором
температура изменяется на 1градус
Кельвина.
это
работа совершаемая газом при постоянном
давлении над 1 молем газа, при котором
температура изменяется на 1градус
Кельвина.
![]() -
Ур-ие Майера.
-
Ур-ие Майера.
![]() .
.
![]() есть
характеристика газа зависит только от
степеней свободы.
есть
характеристика газа зависит только от
степеней свободы.
![]() это
объясняется тем что при нагревании газа
при
это
объясняется тем что при нагревании газа
при
![]() требуется
дополнительное количество теплоты на
совершение работы расширения газа так
как
требуется
дополнительное количество теплоты на
совершение работы расширения газа так
как
![]() обеспечивается
увеличение объема.
обеспечивается
увеличение объема.
Процессы
проходящие без теплообмена с окружающей
средой называются адиабатическими
![]() .
Способы реализации: 1) быстрые процессы
– система не успевает обменяться теплом.
(2) Теплоизолированный сосуд. 2-х стенный
сосуд между стенками вакуум так что
молекулы тепло не передают наружу, кроме
того поверхность зеркальная. (3) Тело
внутри оболочки температура которой
такая же как и температура тела.
.
Способы реализации: 1) быстрые процессы
– система не успевает обменяться теплом.
(2) Теплоизолированный сосуд. 2-х стенный
сосуд между стенками вакуум так что
молекулы тепло не передают наружу, кроме
того поверхность зеркальная. (3) Тело
внутри оболочки температура которой
такая же как и температура тела.
![]() ,
,![]() ,
,![]() работа
совершается за счет убыли внутренней
энергии.
работа
совершается за счет убыли внутренней
энергии.
![]() ,
,![]() .
Если совершается положительная работа
то тело охлаждается. Если отрицательная
то нагревается.
.
Если совершается положительная работа
то тело охлаждается. Если отрицательная
то нагревается.
6)Ур-ие
Адиабата.
![]() ,
,![]() ,
,![]() .
.
![]() ,
,![]() ,
,![]() .
Берем дифференциал от
.
Берем дифференциал от
![]() ,
,![]() При
адиабатном процессе изменяется все
При
адиабатном процессе изменяется все
![]() ,
,![]() .
.
![]() ;
;![]() ,
,![]() ,
,![]() ;
;![]() ,
,![]() ,
,![]() .
.![]() ,
,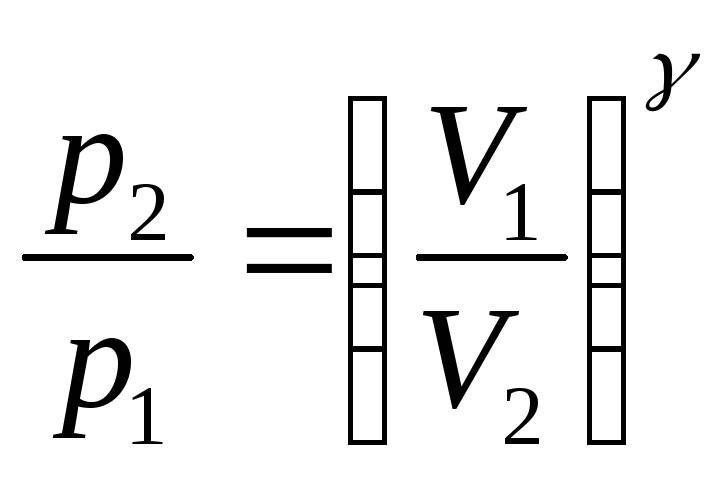 ,
,![]() т.к
состояния 1 и 2 выбраны произвольно то
можно записать
т.к
состояния 1 и 2 выбраны произвольно то
можно записать
![]() .
.
![]() ,
,![]() .График
для адиабатического процесса
.График
для адиабатического процесса
![]() круче
чем график для изотермического
круче
чем график для изотермического![]() т.к в адиабатном процессе изменяются
все параметры.
т.к в адиабатном процессе изменяются
все параметры.
Запишем
адиабатное ур-ие через другие параметры
системы:
![]() ;
;![]() ,
,![]() ,
,![]() .
.
![]() ,
,![]() .
.![]() .
.
![]() .
.
Изопроцессы
запишем с помощью работы.
![]() 1)
1)![]() ,
,
![]()
2)
![]() ,
,
![]()
3)
![]() ,
,![]() ,
,![]() ,
,![]() ,
,
![]() ,
,
![]()
4)
![]() ,
,![]() ,
,![]() ,
,![]() ,
,![]() .
.
Энтропия и ее статистически смысл. Микро и макро состояния.
Мгновенное состояние системы газа будет описано полностью если указать положение и скорости всех частиц газа но вероятность такого состояния практически равна нулю. Для описания системы нужно более грубое описание состояния газа. Разобьем объем газа на ячейки так что с одной стороны размеры ячеек много меньше объема всего газа а с другой в каждой большое число молекул. Пронумеруем каждую молекулу.
Микросостояние системы это такое состояние системы при котором известно количество молекул в ячейки и их номера. При этом не важно в каком месте находится молекула. При перемещении молекулы в нутрии ячейки микросостояние системы не меняется.
С макроскопической точки зрения все молекулы одинаковые поэтому для более удобного описания системы используется макроскопическое состояние. Макроскопическое состояние – это такое описание системы при котором важно знать только кол-во молекул в ячейках и не важны номера.
Если молекула перешла из одной системы в другую то макросостояние меняется и микросостояние тоже. Если 2 молекулы поменять местами то макро состояние не меняется а микро изменится. Любое макросостояние системы может быть реализовано различным числом способов, т.е различным числом микросостоянии.
Статистическим
весом называется
– число микросостоянии реализующих
данные макросостояния. Рассмотрим микро
и марко состояния на примере 4-х частиц.
Дан цилиндр разделили его 2 части и
пронумеровали частицы. Вероятность
того что №1 находится в левой части
равна![]() и
в правой
и
в правой
![]() .для
№1№2 Вероятность одновременного события
2-х независимых событии равна произведению
вероятностей этих событии
.для
№1№2 Вероятность одновременного события
2-х независимых событии равна произведению
вероятностей этих событии![]() .
Вероятность того что все 4 молекулы
находятся слева равна
.
Вероятность того что все 4 молекулы
находятся слева равна![]() .
Вероятность любого расположения молекул
равна
.
Вероятность любого расположения молекул
равна![]() .
.
|
Макросостояние |
Микросостояние |
Статистически вес |
Вероятность состояния | ||
|
Л |
Пр |
Л |
Пр | ||
|
4 |
0 |
№1234 |
- |
1 |
1/16 |
|
3 |
1 |
123 124 134 234 |
4 3 2 1 |
4 |
1/4 |
|
2 |
2 |
12 13 14 23 24 34 |
34 24 23 14 13 12 |
6 |
6/16 |
|
1 |
3 |
4 3 2 1 |
123 124 134 234 |
4 |
1/4 |
|
0 |
4 |
- |
1234 |
1 |
1/16 |
Видно что вероятность состояния пропорциональна статистическому весу.
Равновесное
состояние это состояние которое не
имеет тенденции к изменению. В равновесном
состоянии будет состояние которое
наиболее вероятно в таблице это
состояние2![]() 2
при этом статистический вес этого
состояния максимальный.
2
при этом статистический вес этого
состояния максимальный.
Неравновесное состояние это состояние в котором вероятность меньше максимальной вероятности статистически вес при этом меньше минимального состояния.
Поместим 4 молекулы влево вероятность минимальна т.е в результате теплового движения система будет переходить из менее вероятного состояния в более. Статистически вес системы увеличится, вероятность того что все 4 соберутся справа почти равна нулю.
Вероятность макросостояния системы пропорциональна статистическому расстоянию , т.е числу способов реализующих данное макросостояние в качестве характеристики системы можно было принять статистически вес но он не является аддитивной величиной:
Статистический
вес одной части![]() другой
другой![]() .
.
![]() но
если взять логарифм то
но
если взять логарифм то
![]() т.е
аддитивная величина поэтому формула
Больцмана
т.е
аддитивная величина поэтому формула
Больцмана![]() - энтропия.
- энтропия.
В
равновесном состоянии статистически
вес максимален, а значит, и энтропия
принимает макс. значение. При необратимом
процессе замкнутая система переходит
из менее вероятного состояния в более
при этом статистически вес увеличивается
а значит и энтропия увеличивается. В
равновесном состоянии может наблюдаться
уменьшение энтропии но это кратковременно
и мало поэтому статистически вес
максимален постоянная величина таким
образом приходим ко 2-му
началу термодинамики.
В замкнутой системе энтропия не убывает
она может только возрастать или достигать
максимального значения в![]() .
.
В
19-ом веке обсуждался вопрос о тепловой
смерти вселенной , т.е Клаузиус представил
вселенную как замкнутую систему –
энтропия возрастает, т.е все формы
движения становятся только тепловыми
температура выравнивается и происходит
смерть , однако вселенную нельзя
рассматривать как замкнутую систему .
Приращение
энтропии. В
не замкнутой системе энтропия уменьшается.
Если система при постоянной температуре
термостата сообщает![]() то
температура увеличивается и изменение
энтропии
то
температура увеличивается и изменение
энтропии
![]() .
Если системе сообщить
.
Если системе сообщить
![]() то увеличится тепловое движение молекул
а следовательно увеличится число
микросостоянии реализующих данное
макросостояние следовательно увеличится
статистический вес а значит увеличится
и энтропия. Если системе передать одно
и только одно кол-во теплоты но
то увеличится тепловое движение молекул
а следовательно увеличится число
микросостоянии реализующих данное
макросостояние следовательно увеличится
статистический вес а значит увеличится
и энтропия. Если системе передать одно
и только одно кол-во теплоты но
![]() то
когда
то
когда![]() степень
увеличения теплового движения за счет
сообщения
степень
увеличения теплового движения за счет
сообщения
![]() будет
меньше а значит статистически вес меньше
и изменение энтропии меньше. Энтропия
– мера беспорядка.
будет
меньше а значит статистически вес меньше
и изменение энтропии меньше. Энтропия
– мера беспорядка.
Если
происходит необратимый процесс то
изменения энтропии происходят как
засчет сообщения количества теплоты
так и засчет необратимости процесса
поэтому![]() и
при
и
при
![]() то
то
![]() .
Возрастание энтропии в замкнутых
системах соответствует увеличению
степени хаотического движения молекул,
т.е система приближаясь к равновесному
состоянию обладает большим беспорядком
и в равновесном состоянии наблюдается
полный беспорядок. В связи с увеличением
энтропии при переходе к равновесному
состоянию вторая
формулировка 2-го начала термодинамики
сформулирована: если
система замкнута то любые процессы в
системе могут происходить при переходе
из менее вероятных состоянии в более
вероятные. При нулевой температуре
система находится в основном состоянии
при этом статистически вес равен единице,
т.е систему можно описать только одним
способом: 3-е
начало термодинамики
.
Возрастание энтропии в замкнутых
системах соответствует увеличению
степени хаотического движения молекул,
т.е система приближаясь к равновесному
состоянию обладает большим беспорядком
и в равновесном состоянии наблюдается
полный беспорядок. В связи с увеличением
энтропии при переходе к равновесному
состоянию вторая
формулировка 2-го начала термодинамики
сформулирована: если
система замкнута то любые процессы в
системе могут происходить при переходе
из менее вероятных состоянии в более
вероятные. При нулевой температуре
система находится в основном состоянии
при этом статистически вес равен единице,
т.е систему можно описать только одним
способом: 3-е
начало термодинамики
![]() . Теорема Нернста: Энтропия это функция
состояния, т.е зависит от параметров
данного состояния и может быть выражено
через его параметры:
. Теорема Нернста: Энтропия это функция
состояния, т.е зависит от параметров
данного состояния и может быть выражено
через его параметры:
![]() .
Если совершается круговой процесс то
изменение энтропии равно нулю.
.
Если совершается круговой процесс то
изменение энтропии равно нулю.
![]() .
.
(рис.)
![]() ,
,![]() ,
,![]() ;
;![]() .
.
![]() ,
,![]() ,
,![]() .
.
![]() -Диаграмма
(рис.)
-Диаграмма
(рис.)
![]() ,
,![]() .
.
(рис.)
1)![]() ;
;![]() ,
,
![]() ,
,![]() ,
,![]() ,
,![]() ,
,![]() .
.![]() ;
;
![]() Участок
Участок![]() -
изометрическое расширение.
-
изометрическое расширение.
![]() ,
,![]() Изометрическое
сжатие.
Изометрическое
сжатие.
2)
![]() ,
,![]() Изоэнтропийный
процесс.
Изоэнтропийный
процесс.
![]() ;
;![]() ,
,![]() ,
,![]() ,
,![]() ,
,![]() адиабатическое
сжатие.
адиабатическое
сжатие.
![]() ;
;![]() адиабатическое
расширение.
адиабатическое
расширение.
3)Изохорический
процесс.
![]() ,
,![]() .
.
![]()
![]() ,
,![]() ,
,![]() Изохорическое
нагревание
Изохорическое
нагревание![]() .
.
![]()
![]() ,
,![]() ,
изохорическое охлаждение.
,
изохорическое охлаждение.
4)
![]() ,
,![]() ,
т.к
,
т.к
![]() то
то
![]()
![]() ,
,![]() изобарическое
нагревание
изобарическое
нагревание
![]()
![]() ,
,![]() изобарическое
охлаждение.
изобарическое
охлаждение.
