
Термодинамика и статистическая физика.
Молекулярная физика – это раздел изучающий строение и св-ва вещества исходя из молекулярно-кинетических представлении. Согласно им все тела состоят из огромного числа атомов которые находятся в постоянном хаотическом движении.
Статистическая физика ставит задачи истолковать св-ва в-ва такие как давление температура и т.д, как суммарный результат действия всех молекул. Термодинамика изучает макроскопические св-ва тел не интересуясь микроскопической природой этих св-в. В основе термодинамики лежит несколько законов которые являются обобщением экспериментальных фактов. Эти подходы дополняют друг друга.
1)Атомная
масса – это
отношение массы атома электрона к
![]() массы
атома изотопа углерода
массы
атома изотопа углерода![]() .
.
Молекулярная
масса – это
отношение массы молекулы к
![]() массы
атома изотопа углерода
массы
атома изотопа углерода![]() .
.
Моль
– кол-во в-ва в котором содержится
столько же частиц сколько содержится
в 0,012 кг изотопа углерода![]() .
.
Число
Авогадро –
число атомов содержащихся в 1 моле в-ва.
В 1 моль любого в-ва содержится
![]() частиц.
частиц.
Молекулярная
масса(![]() )
масса в-ва
(
)
масса в-ва
(![]() ).
).![]() (
(![]() -число
частиц).
-число
частиц).
![]() -молярная
масса – масса
одного моля.
-молярная
масса – масса
одного моля.![]() .
.
![]() -
молярный объем
– объем 1 моля в-ва.
-
молярный объем
– объем 1 моля в-ва.
Закон
Авогадро - при одинаковых условиях моль
любого в-ва занимает одинаковый объем.
При нормальных условиях, т.е![]() Па,
Т=273К,
Па,
Т=273К,
![]() .
.
Кол-во
в-ва -
![]() .
.
Концентрация
– число молекул
в единице объема
![]() .
.
Плотность
в-ва![]() .
.
Состояние системы.
Система
это совокупность рассматриваемых тел.
Всякая система находится в различных
состояниях отличающихся![]() -
эти величины параметры системы. Состояние
системы не всегда характеризуется
определенными параметрами. Пример: газ
в цилиндре под поршнем. Если сдвигаем
поршень быстро то образуется воздушная
подушка, т.е область в которой давление
газа отличается от давления в остальных
частях сосуда. Т.е давление газа во всем
сосуде нельзя охарактеризовать одной
определенной величиной. Такое состояние
называется неравновесным.
-
эти величины параметры системы. Состояние
системы не всегда характеризуется
определенными параметрами. Пример: газ
в цилиндре под поршнем. Если сдвигаем
поршень быстро то образуется воздушная
подушка, т.е область в которой давление
газа отличается от давления в остальных
частях сосуда. Т.е давление газа во всем
сосуде нельзя охарактеризовать одной
определенной величиной. Такое состояние
называется неравновесным.
С течением времени в результате теплового хаотического движения – давление газа во всех точках сосуда станет одинаковым такое состояние – равновесное. Равновесное состояние это состояние в котором все параметры системы принимают определенное значение. Переход из неравновесного в равновесное состояние называется релаксацией. А время этого перехода – время релаксации. Равновесное состояние можно изобразить в координатной плоскости где изображены 2 любых параметра либо в виде кривой. Неравновесное состояние нельзя изобразить.
Процесс это переход из одного состояния в другое. Всякий процесс связан с нарушением равновесия, т.е при протекании в системе процесса – система проходит ряд не равновесных состоянии.
Опыт: Чем быстрее двигаем поршень тем больше нарушение равновесия. Если двигать медленно то состояние измениться незначительно.
Бесконечно медленный процесс – это процесс в котором время релаксации много меньше чем время перехода из одного состояния в другое. Бесконечно медленный процесс является равновесным процессом.
Равновесный процесс можно совершить и в обратном направлении при этом система приходит в начальное состояние проходя туже последовательность равновесных состоянии что и при прямом направлении. Обратимый процесс - проходит как в прямом так и в обратном порядке.
Цикл – это процесс в результате которого система приходит в начальное состояние. Круговой обратимый процесс может проводится как в прямом так и в обратном направлении. Все выводы термодинамики относятся к обратимым процессам и равновесным состояниям.
2) Ур-ие состояния идеального газа.
Состояние
любого газа данной массы определяется
3-мя параметрами данной системы. Ур-ие
связывающее все параметры системы
называется Ур-ем состояния![]() .
.
Идеальный газ это газ в котором. (1) Объем молекул много меньше объема сосуда. ( Объемом молекул можно пренебречь). (2)Отсутствует взаимодействие между молекулами (3)Удары абсолютно упругие между молекулами и молекулами со стенками сосуда.
Ур-ие
состояния идеального газа получено
Клапероном исходя из экспериментальных
законов. (рис.) 1![]() 2
закон Боле-Мариотта
2
закон Боле-Мариотта
![]() ,
,
![]() ,2
,2![]() 3Гей
Люссака
3Гей
Люссака
![]() ,
,
![]() ,
Исключим из этих Ур-нии параметры 2-го
состояния.
,
Исключим из этих Ур-нии параметры 2-го
состояния.
![]() ,
,![]() ,
,![]() ;
;![]() ,
Т.к состояние1
,
Т.к состояние1![]() 3
выбрано произвольно то
3
выбрано произвольно то
![]() для
любого состояния. Его можно вычислить
с помощью закона Авогадро. При одних и
тех же Р и Т моли любого газа имеют
одинаковый объем
для
любого состояния. Его можно вычислить
с помощью закона Авогадро. При одних и
тех же Р и Т моли любого газа имеют
одинаковый объем
![]() .
При Н.У.
.
При Н.У.
![]() Па,
Т=273К,
Па,
Т=273К,
![]() .
.![]() .
.![]() -
Ур-ие состояния 1 моля идеального газа.
Если газ занимает объем то
-
Ур-ие состояния 1 моля идеального газа.
Если газ занимает объем то
![]() ,
,![]() ,
,
![]()
Уравнение
состояния идеального газа -
![]() .
Ур-ние связывает 3 параметра системы.
.
Ур-ние связывает 3 параметра системы.
![]() ,
,![]() ,
,![]() ,
,![]() -
постоянная Больцмана.
-
постоянная Больцмана.
![]() ,
,![]() ,
,![]() .Отсюда
видно что Р прямо пропорционально V
в-ва.
.Отсюда
видно что Р прямо пропорционально V
в-ва.
Основное ур-ие МКТ идеальных газов.
Рассмотрим
одноатомный идеальный газ. Молекулы
газа находятся в постоянном хаотическом
движении. Число соударении между
молекулами много меньше соударении
молекул со стенками сосуда, тогда
давление на площадку со стороны
молекул равно
![]() где
где
![]() -
давление а
-
давление а![]() суммарный
импульс который передают все столкнувшиеся
со стеной молекулы.
суммарный
импульс который передают все столкнувшиеся
со стеной молекулы.
![]() ,
,![]() суммарный
импульс который передает одна молекула
при столкновении со стенкой за время
суммарный
импульс который передает одна молекула
при столкновении со стенкой за время![]() с
площадкой
с
площадкой![]() .
(рис.) Т.к масса молекулы много меньше
массы стенки то
.
(рис.) Т.к масса молекулы много меньше
массы стенки то![]() молекул
не меняется по величине. Из
закона сохранения импульса
молекул
не меняется по величине. Из
закона сохранения импульса![]() ,
где
,
где![]() импульс который получает стенка при
столкновении с 1-ой молекулой.
импульс который получает стенка при
столкновении с 1-ой молекулой.
![]() .
.
![]() ,
,
![]() -
объем в котором заключены все те молекулы
которые столкнулись с площадкой.
-
объем в котором заключены все те молекулы
которые столкнулись с площадкой.
![]()
Движения
молекул равновероятные т.е вдоль оси Х
лежит 1/3 всех молекул значит по направлению
к стенке летит 1/6 всех молекул.![]() -
для одноатомной молекулы в предположении
что все молекулы движутся с одинаковой
скоростью.
-
для одноатомной молекулы в предположении
что все молекулы движутся с одинаковой
скоростью.
Т.к
скорости молекул различные то
![]() .
Т.е
.
Т.е
![]() - основное Ур-ние МКТ.
- основное Ур-ние МКТ.
Из
основного Ур-ия можно получить выражение
для средней
квадратичной скорости.
![]() ;
;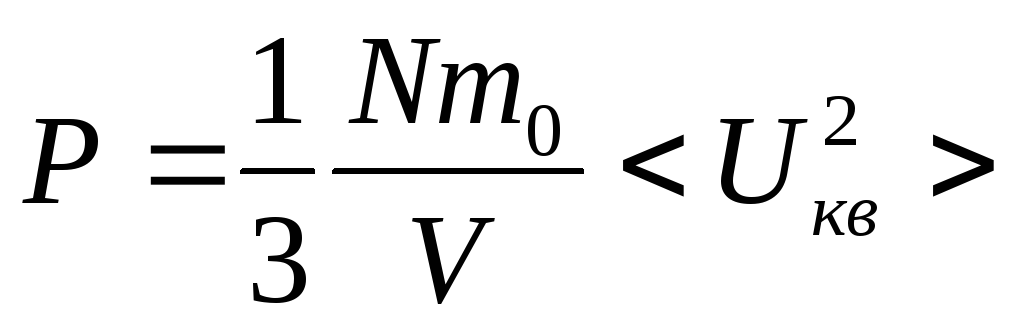 ,
,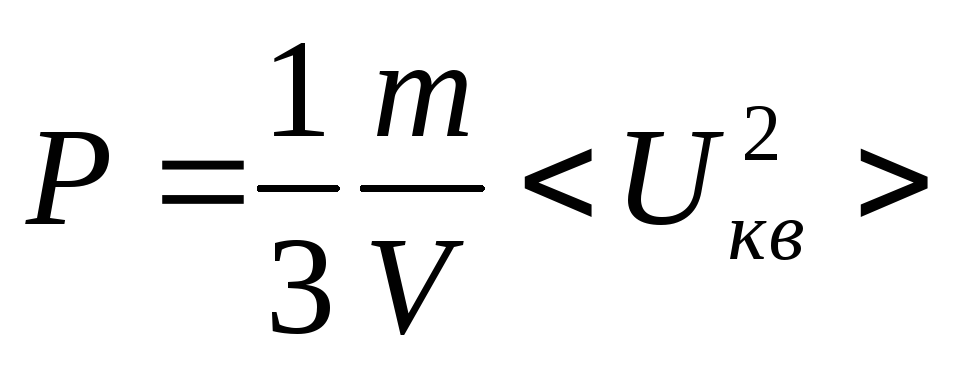 ,
,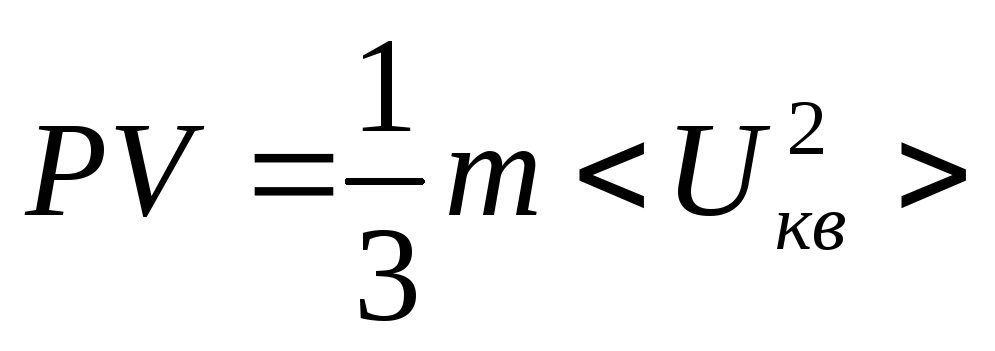 ,
,![]() ,
,![]() .
.
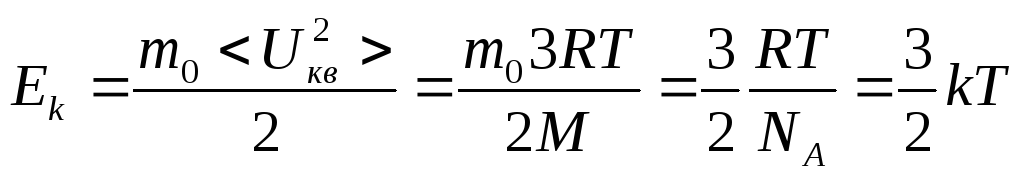 .
.![]() энергия
приходящаяся
на одну частицу в одноатомной газе.
энергия
приходящаяся
на одну частицу в одноатомной газе.
3)Статистическое распределение.
В классической механике для изучения движения тел системы мы записываем дифференциальное уравнение для каждого тела в отдельности, тогда положение и скорость всех тел системы в любой момент времени можно определить зная положение и скорость тел в начальный момент времени. Если система состоит из колоссального числа частиц то для описания состояния системы должны записать громадное число дифференциальных Ур-нии и если б мы проинтегрировали то не смогли б подставить в эти Ур-ния в общем виде начальную скорости и координаты всех частиц.
На самом деле новые статистические закономерности возникают с большим числом частиц или для 1-ой но тогда эксперимент повторяется много раз.
Пример1:
бросаем монету.
![]() -
полное число бросков
-
полное число бросков![]() число
благополучных бросков.
число
благополучных бросков.![]() .
.
Пример2:
Шар обмакнули в чернила и пустили по
подносу. (рис.) Взяли на подносе малую
площадку![]() ,
,
![]() -это
та часть времени в течении которой шар
был в этой площадке.
-это
та часть времени в течении которой шар
был в этой площадке.![]() -
полное время наблюдения. Тогда при
-
полное время наблюдения. Тогда при
![]() шарик
много раз побывает в
шарик
много раз побывает в![]() и
вероятность того что шар находится в
области площадки (не важно где)
и
вероятность того что шар находится в
области площадки (не важно где)
![]() .
.
Фазовое пространство.
Пусть
система состоит из колоссального числа
частиц тогда положение каждой частицы
обозначим координатой
![]() ,
,![]() состояние
частиц определяется импульсом
состояние
частиц определяется импульсом![]() .Значит
состояние системы можно характеризовать
точкой в фазовом пространстве. Т.е точка
определяет координату и импульс частиц.
.Значит
состояние системы можно характеризовать
точкой в фазовом пространстве. Т.е точка
определяет координату и импульс частиц.
Состояние одной частицы описывается точкой в 6-ти мерном фазовом пространстве. При изменении состояния системы новое состояние описывается другой фазовой точкой, а изменение состояния системы описывается линией – фазовой траекторией.
Рассмотрим замкнутую систему – система которая не взаимодействует с другими телами, все тела подчинены законам классической физики. Выделим некоторую часть – подсистему, все тела этой системы подчинены ЗКФ, число частиц всеравно огромно хотя размер много меньше. Эта система уже не замкнута она испытывает воздействие со стороны других подсистем. Воздействия носят сложный и запутанный характер но благодаря этому наша система побывает во всех взаимодействиях.
Выделим
некоторый объем фазового пространства
(рис.)
![]() ,
,![]() .
.
![]() та часть времени в
течении которого система побывала в
объеме фазового пространства
та часть времени в
течении которого система побывала в
объеме фазового пространства![]() ,
,![]() .
.![]() -
полное время наблюдения за системой.
Тогда вероятность
того что
система находится в Эл-те объема фазового
пространства
-
полное время наблюдения за системой.
Тогда вероятность
того что
система находится в Эл-те объема фазового
пространства![]() ,
,![]() ,
т.е импульсы частиц находятся в интервале
,
т.е импульсы частиц находятся в интервале
![]() а
координаты частиц
а
координаты частиц
![]() равна
равна
![]() .
.
возьмем
Эл-ты фазового пространства
![]() ,
,![]()
![]() ,
,![]()
Вероятность
того что система находится в Эл-те объема
![]() ,
,![]() ,пропорциональна
самому Эл-ту объема, т.е
,пропорциональна
самому Эл-ту объема, т.е
![]() ,
,
![]() -
коэффициент пропорциональности который
зависит от координаты и импульса частиц
называется функцией
статистического распределения
и играет роль плотности вероятности
т.е
-
коэффициент пропорциональности который
зависит от координаты и импульса частиц
называется функцией
статистического распределения
и играет роль плотности вероятности
т.е
![]() Ф-ция статистического распределения
подчиняется условию
нормировки,
т.е
Ф-ция статистического распределения
подчиняется условию
нормировки,
т.е
![]() интеграл
по всему объему фазового пространства.
Условие нормировки обозначает что сумма
вероятностей всех возможных состоянии
равна 1, т.е система в каком то состоянии
находится.
интеграл
по всему объему фазового пространства.
Условие нормировки обозначает что сумма
вероятностей всех возможных состоянии
равна 1, т.е система в каком то состоянии
находится.
Св-ва: Ф-ция распределения не зависит от начального состояния подсистемы поскольку за бесконечно большой промежуток времени любое состояние можно брать как начальное. Ф-ция распределения не зависит от начального состояния других подсистем поскольку за бесконечно большой промежуток времени действие на нашу подсистему со стороны других подсистем меняется любое состояние можно брать как начальное.
Зная
ф-цию распределения можно определить
среднее значение
любой физической величины.
Для этого надо данную величину умножить
на вероятность состояния и проинтегрировать
по всем возможным состояниям
![]() .
Можно определить нахождение частицы в
данном состоянии.
.
Можно определить нахождение частицы в
данном состоянии.
