
Khimia_Lektsia
.pdf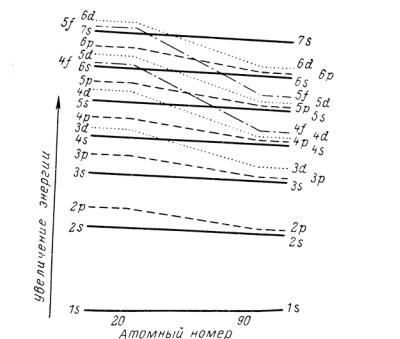
91
симметричным электронным слоем 3s23p6. В связи с отталкиванием от этого слоя для 19-го электрона атома К и 20-го электрона атома Са оказывается энергетически более выгодным 4s -состояние
19.К 1s2 2s2 2p6 3s2 Зр6 3d0 4s1
20.Са 1s2 2s2 2p6 3s2 3p6 3d0 4s2
При последующем возрастании эффективного заряда ядра у следующего после Са элемента — скандия Sc 3d-состояние становится энергетически более выгодным, чем 4p-состояние. Поскольку в 3d-состоянии может находиться десять электронов, 3d-подслой заполняется и в атомах последующих элементов.
Рис. 6.5. Изменение уровней энергии в зависимости от атомного номера элемента
|
|
|
21 |
Sc |
1s22s22p63s23p63d14s2 |
22 |
Ti |
………………..3d24s2 |
… |
… |
……………………… |
25 |
Mn |
………………..3d54s2 |
26 |
Fe |
………………..3d64s2 |
… |
… |
……………………… |
30 |
Zn |
……………… 3d104s2 |
|
|
|
Элементы, в атомах которых заполняется d-подслой, называются d- элементами. У d-элементов IV периода, следовательно, достраивается слой М до 18 электронов. После завершения 3d-подслоя у последующих шести элемен-
92
тов (Ga—Кг) заполняется р-подслой внешнего слоя. Таким образом, IV период тоже начинается двумя s-элементами и заканчивается шестью р-элементами, но в отличие от II и III периодов между s- и p-элементами располагаются еще десять d-элементов.
ВV периоде, содержащем 18 элементов, заполнение электронных слоев
иподслоев происходит как в IV периоде, а именно: у двух первых (s-элементов — Rb и Sr) и шести последних (р-элементов—In—Хе) заполняется внешний слой, между s- и p-элементами располагаются десять d- элементов (Y—Cd), в которых заполняется d-подслой предвнешнего квантового слоя (4 d -подслой).
VI период содержит 32 элемента и тоже начинается двумя s-элементами (Cs и Ва). Далее, у лантана начинает заполняться d-подслой предвнешнего слоя
57. La Is2 2s2 2p6 3s2 Зр6 3d10 4s2 4p6 4d10 5s2 5p6 5d1 6s2
У следующих за лантаном 14 элементов (Се—Lu) вследствие роста эффективного заряда ядра происходит заполнение 4f-подслоя третьего снаружи квантового слоя. Затем продолжается заполнение 5d-подслоя (Hf—Hg). И этот период завершается шестью р-элементами (Т1—Rn).
В VII периоде имеются два s-элемента (Fr, Ra), за ними следуют d-элемент (Ас) и четырнадцать f-элементов (Th—Lr), далее снова d-элемент
(Кu).
Изложенное показывает, что электронная структура атомов однозначно определяется зарядом ядра. Отсюда понятно, почему элементы имеют постоянные и индивидуальные для каждого из них свойства. По мере роста заряда ядра происходит закономерная периодическая повторяемость сходных электронных структур, а, следовательно, и повторяемость свойств элементов.
6.10. Структура периодической системы
Химические элементы по структуре невозбужденных атомов подразделяются на естественные совокупности, что отражено в периодической системе в виде горизонтальных и вертикальных рядов— периодов и групп.
Период представляет собой последовательный ряд элементов, в атомах которых происходит заполнение одинакового числа квантовых слоев. При этом номер периода элемента совпадает со значением главного квантового числа n внешнего слоя. Различие в последовательности заполнения квантовых слоев (внешних или более близких к ядру) объясняет причину различной длины периодов, которые соответственно содержат 2, 8, 8, 18, 18 и 32 элемента.
d- и f-Элементы данного периода объединяются в семейства. В IV—VI периодах в семейства по 10 элементов объединяются d-элементы. Это — семейства скандия (Sc— Zn), иттрия (Y—Cd) и лантана (La, Hf—Hg) . В VI и
93
VII периодах в семейства церия (Се—Lu) и тория (Th—Lr) по 14 элементов объединяются f-элементы.
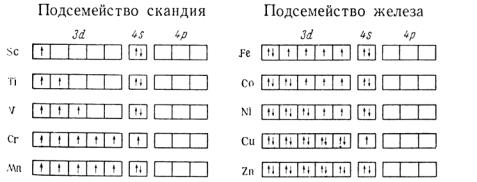
По характеру заполнения d (f)-орбиталей по одному или по два электрона элементы семейств в свою очередь подразделяются на подсемейства. Так, семейство скандия состоит из подсемейств скандия и железа
На соответствующие подсемейства подразделяются и элементы семейств иттрия и лантана: семейство иттрия — на подсемейство иттрия Y, Zr, Nb, Mo, Тс и подсемейство рутения Ru, Rh, Pd, Ag, Cd; семейство лантана — на подсемейство лантана La, Hf, Та, W, Re и подсемейство осмия Os, Ir, Pt, Au, Hg. Семейство церия подразделяется на подсемейства церия (Се—Gd) и тербия (Tb—Lu), семейство тория — на подсемейства тория (Th—Cm) и бер-
келия (Bk—Lr).
Если главное квантовое число определяет положение элемента в периоде, то сочетание побочного, магнитного и спинового квантовых чисел определяет положение элемента в соответствующей группе периодической системы. В соответствии с максимальным числом электронов на внешнем слое элементы периодической системы подразделяются на восемь групп. Подразделение элементов на группы производится по числу валентных электронов.
Положение в группах s- и p-элементов определяется общим числом электронов внешнего квантового слоя. Например, фосфор (3s23p3), имеющий на внешнем слое пять электронов, относится к V группе, аргон (3s23p6) — к VIII, кальций (4s2) — ко II группе и т. д.
Положение в группах d-элементов обусловливается общим числом валентных s-электронов внешнего и d-электронов предвнешнего слоев. По этому признаку первые шесть элементов каждого семейства d-элементов распо-
лагаются в одной из соответствующих групп: скандий (3d14s2) в III, марганец
(3d54s2) — в VII, железо (3d64s2) — в VIII и т. д. Цинк (3d10 4s2), у которого предвнешний слой завершен и валентными являются 4s2-элeктpoны, относится ко II группе.
По наличию на внешнем слое лишь одного электрона (за счет «провала» одного из 4S-электронов в 3d-подслой) медь (3d10 4s1), а также серебро (4d10 5s1) и золото (5d10 6s1) относят к I группе. Кобальт (3d74s2) и никель (3d84s2), родий (4d85s1) и палладий (4d10), иридий (5d7s2) и платина (5d9s1) ока-
94
зываются вне групп периодической системы. Их вместе с Fe, Ru и Os обычно помещают в VIII группу.
В соответствии с особенностями электронных структур элементы семейств церия и тория помещают в третью группу.
Элементы групп подразделяют на подгруппы: s- и p-элементы составляют так называемую главную, а d-элементы — побочную подгруппы. Кроме того, часто в особую подгруппу так называемых типических элементов выделяют элементы малых периодов. В последнем случае, согласно Б. В. Некрасову, элементы группы подразделяются на три подгруппы: типические элементы и две подгруппы, составленные из элементов больших периодов. Например, IV группа состоит из следующих трех подгрупп:
Типические элементы С Is2 2s2 2p2
Si Is2 2s2 2p6 3s2 3p2
Элементы подгруппы германия |
Элементы подгруппы титана |
|||||||
Ge. . .3s2 Зр6 3d10 4s2 4p2 |
Ti...... 3s2 |
3р6 |
3d2 |
4s2 |
||||
Sn. . .4s2 |
4p6 |
4d10 |
5s2 |
5p2 |
Zr...... 4s2 |
4p6 |
4d2 |
5s2 |
Pb . .5s2 |
5р6 |
5d10 |
6s2 |
6p2 |
Hf...... 5s2 5p6 5d2 6s2 |
|||
|
|
|
|
|
|
|
|
|
Все свойства элементов, определяемые структурой валентных квантовых слоев, закономерно изменяются по периодам и группам периодической системы. При этом, поскольку в ряду элементов-аналогов электронные структуры сходны, но не тождественны, то при переходе от одного элемента к другому в группах и подгруппах наблюдается не простое повторение свойств, а их более или менее отчетливо выраженное закономерное изменение.
Поскольку орбитали атомов заполняются сначала по одному, а затем по второму электрону, на фоне общей периодичности изменения свойств элементов в периодах проявляется еще так называемая вторичная периодичность. Последняя проявляется также и в подгруппах элементов.
6.11. Энергия ионизации и сродство к электрону
Химическая природа элемента может быть оценена способностью его атома терять и приобретать электроны. Эта способность может быть количественно оценена энергией ионизации атома и его сродством к электрону.
Энергией ионизации I называется количество энергии, необходимое для отрыва электрона от невозбужденного атома
95
Э0 + I = Э+ + е.
Энергия ионизации выражается в кДж/г-атом или в эв/атом. Значения энергии ионизации в эв/атом численно равны потенциалам ионизации в в. (см. табл. 6.3).
Таблица 6.3 Первый потенциал ионизации и сродство к электрону элементов II периода
Элемент |
Li |
Be |
B |
C |
N |
O F |
Ne |
|
|
|
|
|
|
|
|
|
|
|
|
Валентные |
s1 |
s2 |
s2p1 |
s2p2 |
s2p3 |
s2p4 |
s2p5 |
s2p6 |
|
электроны |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Первый потенциал |
5,39 |
‹ 9,32 › 8,296 ‹ 11,26 ‹ 14, 53 |
› 13,61 ‹ 17,42 ‹ 21,56 |
|
|||||
ионизации, в |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Сродство |
0,54 |
› -0,6 ‹ |
0,2 ‹ |
1, 25 › |
-0,1 ‹ |
1,47 ‹ |
3,45 › |
-0,57 |
|
к электрону, эв |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Сродством к электрону называется количество энергии Е, которое выделяется или поглощается при присоединении электронов к нейтральному атому Э0 с превращением его в отрицательный ион Э-
Э0+е= Э-± Е.
Сродство к электрону может быть выражено в кДж/г-атом или в эв/атом.
Надежные значения сродства к электрону атомов найдены лишь для небольшого числа элементов. Имеющиеся данные, однако, показывают, что в периодах и группах сродство к электрону атомов изменяется закономерно в соответствии с характером электронных структур атомов элементов. Наибольшим сродством к электрону обладают р-элементы VII группы. Наименьшее и даже отрицательное сродство к электрону имеют атомы с конфигурацией s2 (Be, Mg, Zn) и s2р6 (Ne, Ar, Kr) или с наполовину заполненным р-подслоем (N, P, As). Это служит дополнительным доказательством повышенной устойчивости указанных электронных конфигураций.
Для того чтобы решить вопрос: атом данного элемента легче теряет или присоединяет электрон — необходимо учесть обе характеристики: энергию ионизации и сродство к электрону. Полусумма энергии ионизации и сродства к электрону получила название электроотрицательности. Для удобства вместо абсолютных значений электроотрицательности (в кДж/г-атом или эв/атом) используют значения относительной электроотрицательности (ОЭО). Так, наименьшими ее значениями характеризуются s-элементы

96
I группы, а наибольшими— р-элементы VII группы.
Атомные и ионные радиусы. Вследствие волновой природы электрона атом не имеет строго определенных границ. Поэтому измерить абсолютные размеры атомов невозможно. Практически приходится иметь дело с радиусами атомов, связанных друг с другом тем или иным типом химической связи. Такие радиусы следует рассматривать как некоторые эффективные (т. е. проявляющие себя в действии) величины. Эффективные радиусы определяют при изучении строения молекул и кристаллов.
Изменение атомных радиусов в периодической системе носит периодический характер. В периодах атомные и ионные радиусы по мере увеличения заряда ядра в общем уменьшаются. Наибольшее уменьшение радиусов наблюдается у элементов малых периодов, так как у них происходит заполнение внешнего квантового слоя. В больших же периодах в пределах семейств d- и f-элементов наблюдается более плавное уменьшение радиусов. Это уменьшение называется соответственно d- и f-сжатием.
В подгруппах элементов радиусы атомов и однотипных ионов в общем увеличиваются. Однако степень увеличения радиусов при том же увеличении заряда ядра в подгруппах s- и р-элементов отлична от таковой в подгруппах d -элементов. В подгруппах s- и р-элементов размеры атомов и ионов увеличиваются в большей степени, чем в подгруппах d-элементов, например
Как видно, в подгруппе мышьяка при переходе от Аs к Bi атомный ра-
о
диус увеличивается на 0,34 А, а в подгруппе ванадия при переходе от V к
о
Та— всего на 0,12 А.
Существенно подчеркнуть еще одну особенность для подгрупп d- элементов. Атомные и ионные радиусы d-элементов V и VI периодов данной подгруппы примерно одинаковы. Это объясняется тем, что увеличение радиусов за счет возрастания числа электронных слоев при переходе от V к VI периоду компенсируется 4f-сжатием, вызванным заполнением 4f-подслоя у d-элементов VI периода. При аналогичной структуре валентных электронных слоев и примерно одинаковых размерах атомов и ионов d-элементы V и VI периодов данной подгруппы проявляют между собой особую близость свойств.
97
7. ХИМИЧЕСКАЯ СВЯЗЬ. ОБРАЗОВАНИЕ И СТРУКТУРА МОЛЕКУЛ
Учение о химической связи — центральная проблема современной химии. Без знания природы взаимодействия атомов в веществе нельзя понять причины многообразия химических соединений и механизм их образования, их состав, строение и реакционную способность.
Согласно современным представлениям, химическая связь имеет электрическое происхождение. Она осуществляется в основном так называемыми валентными электронами. У s- и p-элементов валентными являются электроны внешнего слоя, а у d-элементов — электроны s-состояния внешнего и d- состояния предвнешнего уровней.
В зависимости от характера распределения валентных электронов в веществе различают три основных типа химической связи: ковалентную, ионную и металлическую.
7.1. Ковалентная связь
Основные положения теории химической связи рассмотрим на примере образования молекулы водорода из атомов
Н + Н = Н2 + 431 кДж
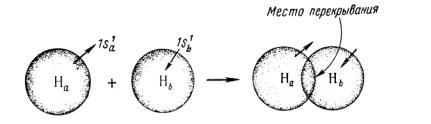
Согласно квантовомеханическим представлениям, ядро свободного атома водорода окружает электронное облако шаровой симметрии, соответствующее ls-электрону (рис. 7.1). При сближении атомов На и Нb между ними возникают электростатические силы двух типов: во-первых, силы притяжения между ядром одного атома (На или Нb) и электроном другого (lsb или 1sa); во-вторых, силы отталкивания между ядрами На и Нb и электронами 1sa и lsb.
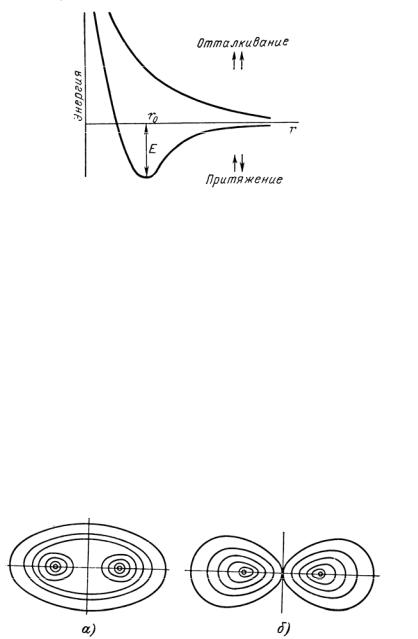
Как показывает квантовомеханический расчет, по мере сближения атомов водорода, электроны которых имеют антипараллельные спины, вначале преобладают силы притяжения, а в дальнейшем — силы отталкивания (рис. 7.2)
Рис. 7.1. Перекрывание электронных облаков при образовании молекулы водорода
Минимум на энергетической кривой показывает выигрыш энергии Е при образовании молекул из свободных атомов и отвечает наиболее устойчивому
98
межъядерному расстоянию r0 в молекуле Н2. При сближении же атомов водорода, у которых спины электронов параллельны, наблюдается только отталкивание (см. рис. 7.2).
Рис. 7.2. Изменение потенциальной энергии в системе из двух атомов водорода в зависимости от расстояния между ядрами
Возникновение молекул Н2 из атомов обязано перекрыванию атомных электронных облаков с образованием молекулярного двухэлектронного облака, которое окружает два положительно заряженных ядра (рис. 7.1 и 7.3а). В месте перекрывания облаков, т. е. в пространстве между ядрами, электронная плотность связывающего облака оказывается максимальной. Увеличение плотности отрицательного заряда в области между ядрами соответствует значительному возрастанию сил притяжения между положительными и отрицательными зарядами по сравнению с таковыми в отдельных атомах, т. е. выделению энергии.
Когда же спины электронов параллельны, перекрывание атомных облаков не происходит, и молекула не образуется (рис. 7.3б).
Рис. 7.3. Распределение электронной плотности при взаимодействии двух атомов водорода с противоположными (а) и параллельными (б) спинами электронов
Для описания химической связи в молекулах в настоящее время широкое распространение получили два метода: метод валентных связей (метод ВС) и метод молекулярных орбиталей (метод МО).
99
7.2. Метод валентных связей
Основу метода валентных связей (электронных пар) составляет положение, что связи между атомами в молекуле осуществляются за счет электронных пар.
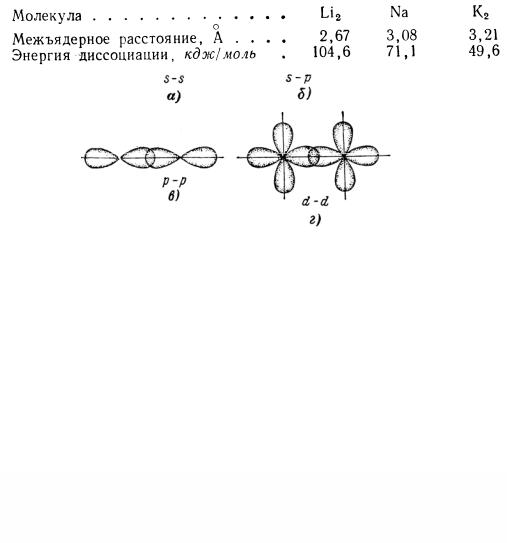
Например, за счет перекрывания внешних s-электронных облаков
(рис. 7.4,а) возникает молекула Li2 (Li : Li); за счет перекрывания
р-облаков (рис. 7.4,в) образуется молекула F2 |
. . . . |
(: F : F :); при перекрывании |
|
|
. . . . |
s-электронного облака атома Н и р-облака атома С1 (рис. 7.4,б) образуется
. .
молекула НС1 ( H : CL :)и т. д.
. .
Рис. 7.4. Характер перекрывания электронных облаков при образовании химической связи (σ-связи)
Мерой прочности химической связи является количество энергии, необходимое для ее разрыва. Ковалентная связь тем прочнее, чем выше степень перекрывания электронных облаков. Степень перекрывания, в свою очередь, зависит от размеров и формы электронных облаков и способа их перекрывания. Так, в ряду Li2 — Na2 — К2 по мере увеличения размеров перекрывающихся облаков (уменьшения их плотности) степень перекрывания уменьшается, и прочность связи падает. Об этом же свидетельствует уменьшение энергии диссоциации молекул и увеличение межъядерного расстояния
2
Ковалентная связь характеризуется насыщаемостью, направленностью и поляризуемостью.
100
7.3. Насыщаемость ковалентной связи
Квантовомеханическая теория валентности. Число ковалентных свя-
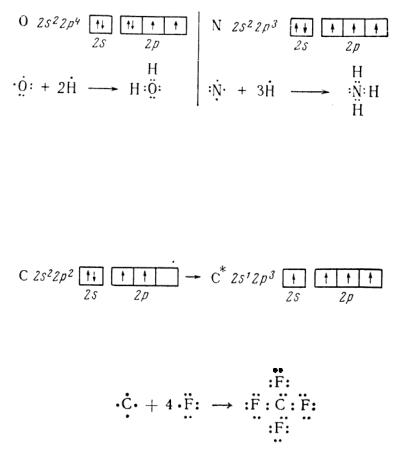
зей, которые образует атом, называется ковалентностью. Поскольку пребывание двух электронов с противоположными спинами в поле действия двух ядер энергетически выгоднее, чем нахождение каждого электрона в поле только своего ядра, в образовании ковалентных связей принимают участие все имеющиеся одноэлектронные облака. Например, как видно из электронных формул, атомы кислорода и азота могут соединяться с двумя и тремя (соответственно) одноковалентными атомами водорода
В ряде случаев число неспаренных электронов увеличивается в результате возбуждения атома, при котором двухэлектронные облака распадаются на одноэлектронные. Например, атом углерода в основном состоянии имеет два неспаренных электрона (2s22р2), а при возбуждении одного из 2sэлектронов в 2р-состояние возникают четыре непарных электрона (2s12р3)
Вследствие этого атом углерода может соединиться, например, с четырьмя атомами фтора (2s22р5), имеющими по одному непарному электрону
Возбуждение атомов до нового валентного состояния требует затраты определенной энергии. Поэтому распаривание электронов возможно лишь в тех случаях, когда затрата энергии компенсируется энергией, выделяемой при образовании дополнительных связей.
7.4. Донорно-акцепторный механизм образования ковалентной связи
Ковалентная связь может образоваться не только за счет перекрывания одноэлектронных облаков, но и за счет двухэлектронного облака одного атома (донора) и свободной орбитали другого (акцептора). По указанному механизму возникает ковалентная связь, например, при образовании сложного
