- •Лекция № 34-37. Химия биогенных элементов
- •Классификации элементов
- •1. Биосфера,круговорот биогенных элементов.Кларки элементов.
- •2. Классификацииэлементов
- •3. Топография важнейших биогенных элементов в организме человека
- •4. Биологическая роль основных классов элементов в организме
- •5. Биологическая рольs-элементов iа-группы.Их применение в медицине
- •6. Биологическая роль s-элементов iIa-группы. Бериллий
- •Кальций
- •Стронций
- •Рубидий и цезий
- •7. Биологическая рольp-элементов
- •8. Биологическая роль d-элементов iб-группы. Биологическая роль ионов меди.
- •Соединения золотаи серебра,их токсичность иприменение в медицине
- •9. Биологическая роль d-элементов viб-группы. Их применение в медицине
- •Молибден
- •10. Биологическая роль d-элементов семейства железа. Применение их соединений в медицине
7. Биологическая рольp-элементов
p-Элементы IIIА-группы входят в состав биомолекул, связываясь с атомами кислорода. Исключение составляет таллий, для которого характерно образование связи с атомами серы. Очевидно, с этим связана высокая токсичность таллия, блокирующего сульфгидрильные (—SН) группы ферментов:
Элементы IVА-группы входят в состав биомолекул, связываясь с атомами различных элементов. Углерод образует полимерные гомоцепи и соединяется с водородом, кислородом, азотом, серой, селеном и иодом. Остальные же элементы этой группы образуют преимущественно связи через атом кислорода, а свинец и через серу. Очевидно, различный характер связи элементов этой группы обусловливает практическое отсутствие их взаимозамещаемости, а склонность свинца образовать связь, с атомами серы определяет его токсическое действие (блокирование сульфгидрильных групп ферментов).
p-Элементы VА-группы также входят в состав биомолекул, образуя связи с атомами различных элементов. Для азота в биомолекулах характерны связи с углеродом и водородом. Фосфор связывается через кислород, мышьяк, сурьма и висмут — через кислород и серу. Это обусловливает отсутствие взаимозамещаемости азота и фосфора, а также этих элементов с мышьяком, сурьмой и висмутом. Наоборот, склонность мышьяка, сурьмы и висмута образовать связи с серой определяет их взаи-мозамещаемость в организме. Обычно они выступают как синергисты.
Элементы VIА-группы образуют в биомолекулах связи с различными элементами, в том числе и друг с другом. Для кислорода характерны связи О—Н, О—С, О—N, О—Р, О—О; для серы S—Н, S—С, S—N, S—S, S—O. Кислород резко отличается по физико-химическим характеристикам от серы и селена, в то время как эти элементы сходны по свойствам и могут взаимно замещаться в биохимических реакциях, например в процессах белкового обмена. Обычно они выступают в качестве синергистов.
p-Элементы VIIА-группы — бром и хлор обычно находятся в организме в виде гидратированных ионов, а фтор и иод — в связанном состоянии. Иод в организме образует соединения со связью С—I. Фтор связывается с металлами (Са, Мg, Fе). По физико-химическим характеристикам и склонности к координации с биогенными элементами фтор резко отличается от других галогенов, поэтому он мало участвует в замещении ионов хлора, брома и иода. Три последних элемента близки по свойствам и замещают друг друга в организме. При этом они проявляют как синергизм, так и антагонизм.
Синергизм и антагонизм элементов изучен еще недостаточно. Исследование этого вопроса чрезвычайно важно, так как решение его позволяет раскрыть биологическую роль элементов, создавать новые лекарственные препараты.
8. Биологическая роль d-элементов iб-группы. Биологическая роль ионов меди.
Медь является необходимым микроэлементом растительных и животных организмов. По значимости она относится к металлам жизни. В организме человека содержится около 1,1 ммоль меди. В основном медь концентрируется в печени, в головном мозге, в крови.
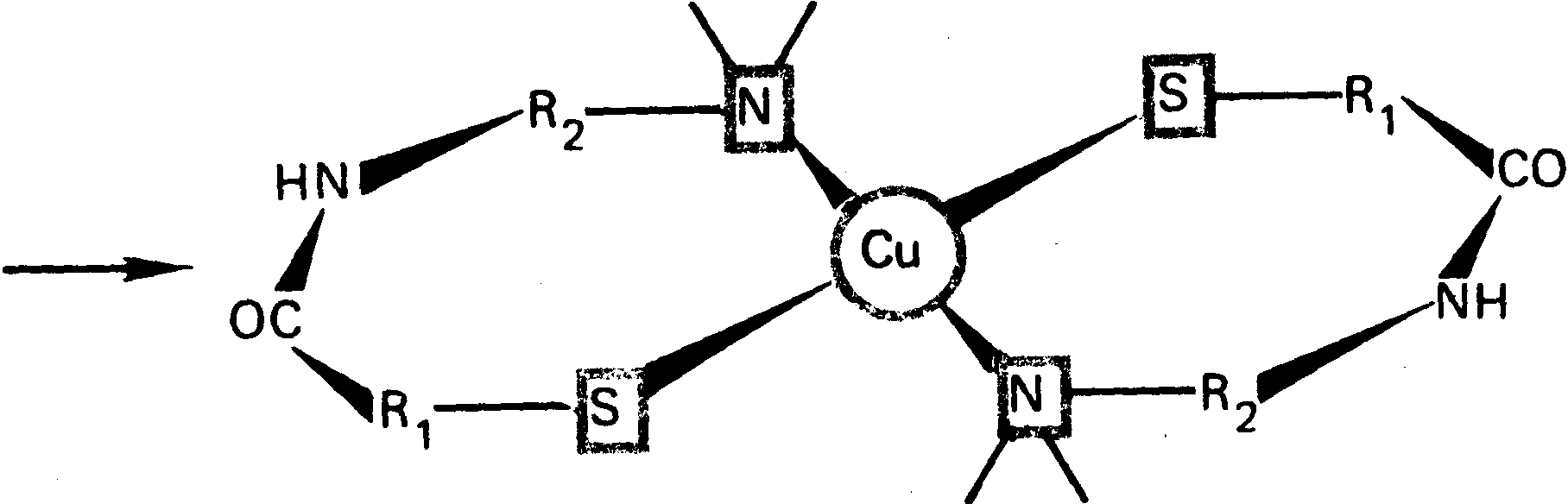
Имеются данные, что в биологических системах медь входит в состав соединений со степенью окисления +1 и +2. Медь (II) чаще всего связывается с карбоксильными, фенольными и аминогруппами белков, а медь (I) более прочно связывается с серосодержащими лигандами. В комплексах медь (I) имеет координационное число, равное 4, которому соответствует тетраэдрическая структура. Для меди (II) более характерно координационное число 6, ему соответствует искаженная ромбическая геометрия комплекса, например металлосвязывающий центр фермента в оксигемоцианине.
В настоящее время известно около 25 медьсодержащих белков и ферментов. Часть ферментов катализирует взаимодействие кислорода с субстратом. Эти ферменты активируют молекулу кислорода, которая участвует в процессе окисления органических соединений. Они составляют группу так называемых оксигеназ и гидроксилаз. Механизм действия этих ферментов различен. Гидроксилазы присоединяют только один атом кислорода. Оксигеназы присоединяют оба атома кислорода с образованием пероксидной цепочки. Кислород играет роль акцептора электронов, а медь, входящая в фермент, выполняет роль донора электронов. В медьсодержащих ферментах медь находится в степени окисления + 1 и кислород легко окисляет ее до +2, электродный потенциал системы Cu + + е- = Cu2+ равен (E° == 0,167 В).
Имеется большая группа медьсодержащих белков, которые катализируют окислительно-восстановительные реакции с переносом протона или электронов от окисляемого вещества непосредственно на молекулярный кислород — это так называемые оксидазы. Для них характерно высокое сродство к кислороду, а также высокое значение окислительно-восстановительных потенциалов. Следует отметить, что именно этот потенциал определяет роль металла: будет ли он участвовать в транспорте электронов или переносить молекулярный кислород, или окисляться кислородом. На потенциал влияет также природа лигандов, которые могут стабилизировать (или дестабилизировать) степень окисления металла, а также влиять на структуру комплекса.
К оксидазам относится такой важнейший дыхательный фермент, как цитохромоксидаза (ЦХО), которая катализирует завершающий этап тканевого дыхания. Все ферменты тканевого дыхания связаны с внутренними мембранами митохондрий. В ходе каталитического процесса степень окисления меди цитохромоксидазы обратимо изменяется. Окисленная форма цитохромоксидазы (Си2+) принимает электроны, переходя в восстановительную (Cu+) форму, окисляющуюся молекулярным кислородом, который сам при этом восстанавливается. Затем кислород присоединяет протоны из окружающей среды и превращается в воду. Механизм действия цитохромоксидазы не полностью расшифрован. Однако доказано, что на завершающем этапе тканевого дыхания ЦХО осуществляет перенос электронов на кислород и это укладывается в следующую схему:
4Н++4[ЦXО•Си+] + O2 = 4 [ЦХО.Си2+] +2Н2O
Очень важным медьсодержащим белком, который содержится плазме крови млекопитающих, является церулоплазмин (ЦП) (“голубая” оксидаза). Церулоплазмин содержит восемь атомов меди на 1 молекулу белка. Установлено, что в окисленном церулоплазмине четыре атома меди имеют степень окисления +2, а четыре других — степень окисления + 1. Проведенные исследования показали, что ЦП участвует в окислении железа:
Fе2+ + [ЦПСи2+] = [ЦПСи+] +Fе3+
В то же время ЦП катализирует восстановление кислорода до воды. Таким образом, церулоплазмин подобно цитохромоксидазе осуществляет четырехэлектронное восстановление молекулярного кислорода.
Вместе с тем церулоплазмин, образуя комплекс с ионами меди, транспортирует их в органы. Выполняя транспортную функцию, ЦП регулирует баланс меди и обеспечивает выведение избытка меди из организма.
Известны медьсодержащие белки, например супероксиддисмутаза (СОД), которые выполняют важную физиологическую функцию: они ускоряют реакцию разложения супероксид-иона O2, представляющего собой свободный радикал. Этот радикал, вступая во взаимодействие с органическими компонентами клетки, разрушает ее. СОД переводит супероксид-ион в пероксид водорода, который является относительно слабым окислителем и быстро разлагается в организме под действием фермента каталазы.
Одним из медьсодержащих белков, обратимо присоединяющих молекулярный кислород, является гемоцианин (НС). Гемоцианин, встречающийся у моллюсков и членистоногих, содержит 0,15—0,26 % меди.
Состав гемоцианина изучен недостаточно, однако известно, что он представляет собой сложное внутрикомплексное соединение, центральным атомом которого является медь со степенью окисления + 1. По структуре гемоцианин подобен гемоглобину. Доказано, что в процессе связывания и освобождения кислорода имеет место окисление и восстановление меди в гемоцианине:
[НС • Си+] + O2 = [НС • Си2+ O2 + е-]
Показано также, что гемоцианин в окислительной форме (Си2+) имеет синий цвет, а восстановительная форма (Си+) практически бесцветна.
Медь вместе с железом участвует в кроветворении. Известно, что при дефиците меди в организме нарушается обмен железом между плазмой крови и эритроцитами, это может привести к разрушению эритроцитов.
Потребность человека в меди 2—3 мг в сутки. Она полностью обеспечивается потребляемой пищей.
Известна болезнь Коновалова — Вильсона, которая связана с избыточным количеством меди в организме. Считается, что этот избыток накапливается из-за того, что нарушается синтез церуплазмина, а поэтому и не обеспечивается выведение избытка меди, поступающего с пищей.
В опытах на животных показано, что недостаток меди приводит к тяжелым отклонениям в обмене веществ: медная анемия (или так называемая лизуха), экзотическая атаксия и др. Атаксия—нарушение координации движения. Вылечить животных можно введением растворимых солей меди в рацион их питания.
В больших концентрациях растворимые соли меди токсичны. Так, например, меди сульфат (медный купорос) массой до 2 г вызывает сильное отравление с возможным смертельным исходом. Токсическое ;действие меди объясняется тем, что медь образует с белками нерастворимые бионеорганические хелаты-альбуминаты, т. е. свертывает белки. Ионы меди образуют прочную связь с аминным азотом и с группой —SН белков, что приводит к инактивации тиоферментов. В упрощенном виде такое взаимодействие можно показать в виде схемы: