
метод фольгарда
.docxЮжно-Уральский
Государственный Университет. Химический
факультет.



Лабораторная работа №8
Осадительное титрование.
Фольгарда
Выполнила: студентка гр. Хим-215 Татарникова Юлия
Проверил: Иняев Игорь Викторович.
Осадительное титрование.
1.ОПРЕДЕЛЕНИЕ СЕРЕБРА В СПЛАВАХ МЕТОДОМ ФОЛЬГАРДА
Сущность метода:
Метод основан на растворении навески сплава серебра в азотной кислоте и последующем титровании азотнокислого раствора по методу Фольгарда.
Для определения серебра по методу Фольгарда в качестве титранта используют стандратный раствор роданида аммония или калия:
Ag+ + SCN– AgSCN.
Индикатором служат ионы железа (III), способные образовывать с роданид-ионом растворимые в воде комплексные ионы, окрашенные в интенсивно-красный цвет:
Fe3+ + SCN–
Пока не достигнута точка эквивалентности, концентрация в растворе роданид-ионов настолько мала, что образования комплексов железа, в частности, [Fe(SCN)]2+, не происходит, но первая же избыточная капля раствора роданида повысит эту концентрацию настолько, что указанная реакция произойдет и раствор приобретет более или менее интенсивную красно-бурую окраску.
Титрование следует проводить в кислой среде для предупреждения осаждения железа (III) в виде гидроксида и для улучшения фиксации точки эквивалентности. Определению мешают катионы металлов, имеющие интенсивную собственную окраску (розовую – в случае солей кобальта, зеленую – солей никеля, синюю – солей меди (II) и т. д.), катионы металлов, образующих малорастворимые роданиды, особенно катионы ртути и палладия, фторид-ионы, способные связывать железо (III) в комплекс. В растворе не должно быть окислителей и особенно продуктов восстановления азотной кислоты (окислов азота и HNO2), способных окислить SCN– или образующих окрашенный в красный цвет продукт взаимодействия HNO2 с роданид-ионом.
Реактивы:
KSCN, стандартный 0,05 н. раствор.
Индикатор: Fe2(SO4)3, 5%-ный раствор в 1 М HNO3.
HNO3, 10%-ный раствор.
Ход определения:
На аналитических весах определяют точную массу навески сплава серебра, содержащей приблизительно 0,5–0,6 г серебра. Навеску помещают в термостойкую колбу емкостью 250 мл и растворяют при нагревании в 20 мл 10%-ной азотной кислоты. Полученный раствор нагревают до кипения, затем кипятят в течение 1–2 минут для удаления оксидов азота. Снимают колбу с плитки, осторожно добавляют 100 мл дистиллированной воды и вновь нагревают раствор до кипения. Затем раствор охлаждают, количественно переводят в мерную колбу объемом 250 мл, разбавляют до метки дистиллированной водой и перемешивают. Если раствор помутнел в результате выпадения гидроксидов и основных солей легко гидролизующихся металлов (Sb, Sn, Bi), то его выдерживают 30–40 мин для формирования ("старения") осадка и затем фильтруют через бумажный фильтр.
Аликвоту полученного раствора, равную 25,00 мл, помещают в колбу для титрования, добавляют 50 мл дистиллированной воды и 10 мл раствора индикатора – сульфата железа (III). Титруют 0,05 н. раствором KSCN, энергично перемешивая титруемый раствор. Титрование продолжают до появления неисчезающей в течение 1 мин красно-бурой окраски.
Массовую долю серебра в сплаве вычисляют по формуле:
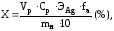
где Vр – объем роданида, пошедший на титрование, мл;
Cр – концентрация раствора роданида, моль/л;
ЭAg – молярная масса эквивалента серебра, г/моль;
fa – фактор аликвотирования;
mн – масса навески сплава серебра, г.
Результаты,
полученные всеми студентами лабораторной
подгруппы, проверяют на наличие грубой
погрешности (промаха), усредняют и
представляют в виде (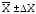 )%.
)%.
Все осадки и растворы, содержащие ионы серебра, нельзя выливать в канализацию, их необходимо собирать в специально предназначенный сосуд.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Осадительное титрование.
Реакция осаждения, результатом которой является образование малорастворимого соединения, используется в титриметрическом и гравиметрическом анализах.
Раздел титриметрии, основанный на реакции осаждения, называется седиметрия. Хотя подобных реакций известно очень много, в седиметрии могут использоваться только те, в которых:
1) образуется практически нерастворимый осадок
2) выпадение осадка происходит быстро и не сопровождается соосаждением посторонних ионов;
3) должна иметься возможность обнаружения окончания реакции осаждения;
4) осадок образуется из известного, строго определенного химического состава, в результате стехиометрического взаимодействия определяемого вещества и вещества титранта.
Метод Фольгарда основан на титровании раствора, содержащего ионы серебра, стандартными растворами NH4NCS или KNCS:
Ag+ + NCS- ↔ AgNCS↓
Индикатором в этом методе являются ионы Fe3+. После осаждения ионов серебра в виде белого осадка AgNCS избыточная капля титранта реагирует с индикатором - раствором железоаммонийных квасцов NH4[Fe(SO4)2] ∙12Н2О с образованием растворимого красного комплекса:
Fе3+ + 3NCS- ↔ [Fе(NСS)3]
Ионы Fe3+ образуют с NCS- -ионами окрашенные комплексы различного состава: [Fe(NCS)]2+, [Fe(NCS)2]+ ∙ [Fе(NСS)6]3- и другие, но образование комплексов различного состава не влияет на результаты титрования, так как все комплексы окрашены.При определении по методу Фольгарда применяют прямое и обратное титрование. В качестве стандартных растворов используют:
а) в методе прямого титрования - растворы аммония тиоцианата или калия тиоцианата; б) в методе обратного титрования - растворы серебра нитрата и аммония или калия тиоцианата.
Приготовление раствора NH4NCS. Аммония тиоцианат не являяется стандapтным веществом, так как соль гигроскопична. Поэтому из нее готовят раствор требуемой концентрации - приблизительно 0,1 или 0,05 моль/дм3, а затем его стандартизуют по стандартному веществу AgNО3 или по стандартному раствору АgNО3.
Условия титрования по методу Фольгарда:
1. Титрование следует выполнять в кислой среде для предотвра-щения гидролиза индикатора - ионов Fe3+:Fe3+ + Н2О ↔ FeOH2+ + Н+
2. При титровании раствор необходимо энергично перемешивать для уменьшения ошибки за счет адсорбции ионов на поверхности осадка.
3. В анализируемом растворе должны отсутствовать:а) соли ртути (1) и (II), реагирующие с NCS- -ионами:Hg22+ + 2NCS- ↔ Hg2(NCS)2↓ ; Hg22+ + 2NCS- ↔ [Hg(NCS)2]
б) окислители КвrО3, КМnO4 и другие, окисляющие NСS-ионы;
в) анионы F-, PO43-, C2О42- и другие, образующие прочные комплексы с индикатором: Fe3+ + 6F- ↔ [FеF6]3-
Способы индикации конца титрования в аргентометрии:
|
|
|||||
|
Метод |
Индикатор |
Принцип действия индикатора |
|
Определяемые ионы |
|
|
|
|
|
|
|
|
|
Гей-Люссака |
Безындикаторный |
Титрование до просветления, т.е. когда новая порция титранта не вызывает помутнения раствора |
|
Br - |
|
|
Мора |
K2Cr2O7 |
Появление в щелочной среде кирпичного цвета осадка Ag2CrO4 при избытке титранта |
|
Cl - , Br - |
|
|
Фольгарда |
FeCl3 |
Появление красного окрашивания при избытке раствора NH4CNS в качестве титранта |
|
Ag+ (прямое титрование); Cl - , CN - , CrO42-, CO32-, PO43 - и др. (обратное титрование) |
|
