- •1.3. Равновесный состав газовой атмосферы
- •1.3.1. Общая методика термодинамического анализа и расчета состава газовой фазы
- •Равновесия в системе с – н – о
- •1.3.2. Упрощения расчетов равновесного состава газовой фазы
- •2,2 % Со2; 13,6 % со; 18,6 % н2; 10,9 % н2о; 54,7 % n2.
- •1.3.3. Роль углерода в формировании состава и свойств газовой фазы
2,2 % Со2; 13,6 % со; 18,6 % н2; 10,9 % н2о; 54,7 % n2.
Равновесное давление кислорода находим из выражения для константы равновесия реакции (1):
 атм,
атм,
где 2,6∙1010
=
![]() при 1600 К (см. пример 1.8).
при 1600 К (см. пример 1.8).
Равновесное давление метана находим
из выражения для константы равновесия
реакции (3). Константу равновесия
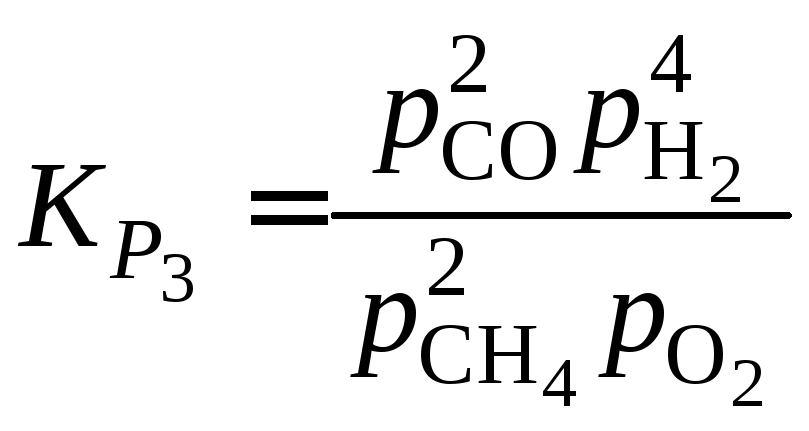 вычисляем
из уравнения
вычисляем
из уравнения
![]() (Дж) (см. пример 1.2). При 1600 К она равна
(Дж) (см. пример 1.2). При 1600 К она равна
![]() .Тогда
.Тогда
 атм.
атм.
Следует сделать
вывод, что, действительно,
![]() и
и![]() весьма малы.
весьма малы.
Пример 1.10. Проба газа, взятая из печи при 1000 К иР= 1,1 атм, по результатам анализа содержит, % (об): 18,5 % СО2, 20,5 % СО, 14 % Н2, 2,3 % Н2О, 5,5 % СН4, 39,2 %N2. Считая, что в печи достигнуто равновесие, установить, произошли ли изменения состава газа при охлаждении пробы до комнатной температуры и, если – да, то в каком направлении изменились содержания всех компонентов в пробе?
Решение. При отсутствии в газовой фазе измеримого содержания О2 считаем, что равновесный состав смеси определяется реакциями (5)–(7), из которых только две являются независимыми. Выбираем реакции (5) и (6).
Для ответа на вопрос о равновесности газовой пробы применяем уравнение изотермы реакции:

Константу равновесия
 вычисляем
из уравнения
вычисляем
из уравнения
![]() (см. пример 1.8). При 1000 К она равна
(см. пример 1.8). При 1000 К она равна
![]() .Тогда
.Тогда


Константу равновесия реакции (6)
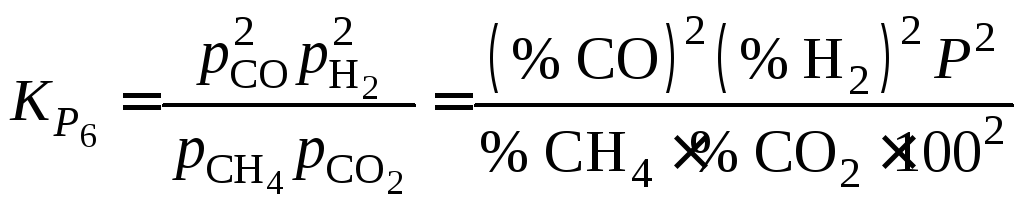
находим из выражения
![]() ,
,
где
![]() .
.
Определив при 1000 К
![]() ,
вычисляем
,
вычисляем![]() :
:


Так как
![]() ,
то проба газа –неравновесная.
При этом
,
то проба газа –неравновесная.
При этом![]()
![]() Значит, реакции (5) и (6) должны идти в
прямом направлении при нагреве пробы
газа с
Значит, реакции (5) и (6) должны идти в
прямом направлении при нагреве пробы
газа с![]() до
до![]() .
.
Равновесный газ
должен отличаться от охлажденного (в
пробе) меньшим
% ![]() и %
и %
![]() и
большим % СО
и %
и
большим % СО
и %
![]() .
Содержание
водорода (%
.
Содержание
водорода (%
![]() )
по реакциям (5)
и (6) изменяется противоположно. Но
так как
)
по реакциям (5)
и (6) изменяется противоположно. Но
так как
![]() ,
то преимущественно должна протекать
реакция (6). Поэтому в равновесном газе%
,
то преимущественно должна протекать
реакция (6). Поэтому в равновесном газе%
![]() > 14.
> 14.
Преимущественное
протекание реакции (6) приводит к
увеличению общего числа моль газа.
Поэтому при сохранении в газе постоянного
абсолютного количества
![]() его относительное содержание в равновесном
газе (%
его относительное содержание в равновесном
газе (% ![]() )
должно быть меньше, чем в пробе.
)
должно быть меньше, чем в пробе.
1.3.3. Роль углерода в формировании состава и свойств газовой фазы
Пример 1.11.Рассчитать состав газовой
фазы СО – ![]() находящейся в равновесии с твердым
углеродом, в интервале 700…1200 К для двух
значений давления 1 и 10 атм. Вычислить
равновесные давления кислорода в газовой
смеси. Результаты расчета представить
графически в координатах % СО –Ти
находящейся в равновесии с твердым
углеродом, в интервале 700…1200 К для двух
значений давления 1 и 10 атм. Вычислить
равновесные давления кислорода в газовой
смеси. Результаты расчета представить
графически в координатах % СО –Ти![]() –Т. На основе
термодинамического анализа системы
обозначить на графиках области
устойчивости углерода и его оксидов,
относящиеся к состояниям приР = 1
атм.
–Т. На основе
термодинамического анализа системы
обозначить на графиках области
устойчивости углерода и его оксидов,
относящиеся к состояниям приР = 1
атм.
Решение.
Для частной системы С – О
при наличии твердого углерода число
степеней свободы
![]() ,
то есть для количественного описания
равновесного состояния достаточно
значенийT
и P
в качестве независимых параметров. На
первом этапе расчета пренебрегаем малой
величиной
,
то есть для количественного описания
равновесного состояния достаточно
значенийT
и P
в качестве независимых параметров. На
первом этапе расчета пренебрегаем малой
величиной
![]() .Определяющим
является равновесие реакции газификации
углерода (10). Связь переменных можно
отразить системой уравнений:
.Определяющим
является равновесие реакции газификации
углерода (10). Связь переменных можно
отразить системой уравнений:

![]() .
.
Решение системы уравнений приводит к выражениям

Величину
![]() находим из выражения
находим из выражения реакции (2).Значения
реакции (2).Значения
![]() и
и![]() определяем из выражения
определяем из выражения![]() .
.
Необходимые для
расчета величины
![]() вычисляем из справочных зависимостей:
вычисляем из справочных зависимостей:![]() (Дж) и
(Дж) и![]() (Дж).Удобнее на
основе указанных выражений получить
температурные зависимости в виде
(Дж).Удобнее на
основе указанных выражений получить
температурные зависимости в виде
![]() и
и![]() и использовать их для расчетов,
результаты которых представлены
в табл. 1.2 и графически
(рис. 1.7 и 1.8).
и использовать их для расчетов,
результаты которых представлены
в табл. 1.2 и графически
(рис. 1.7 и 1.8).
Анализ полученных
данных указывает на увеличение
концентрации СО с увеличением температуры,
что согласуется с эндотермическим
характером реакции газификации (![]() ).
Уменьшение % CO
с ростом давления связано с увеличением
объема (числа моль газов) системы (
).
Уменьшение % CO
с ростом давления связано с увеличением
объема (числа моль газов) системы (![]() )
при превращении
)
при превращении
![]() в СО по реакции (10). С ростом температуры
и давления растет
в СО по реакции (10). С ростом температуры
и давления растет
![]() в
системе в соответствии с происходящими
изменениями в ее составе. Количественно
это отражено кривыми линиями на рис. 1.7
и 1.8.
в
системе в соответствии с происходящими
изменениями в ее составе. Количественно
это отражено кривыми линиями на рис. 1.7
и 1.8.
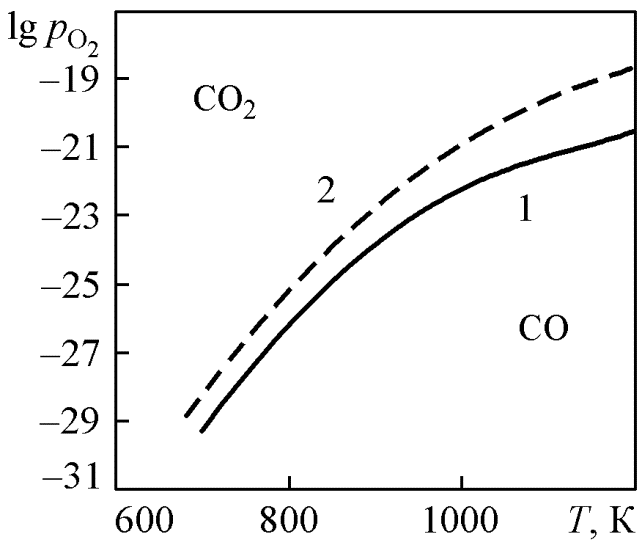
Рассмотрим состояние системы при Р = 1 атм.
Изобара 1 (см. рис. 1.7) разделяет диаграмму на две области различных состояний по отношению к равновесным. Запишем уравнение изотермы реакции (10)
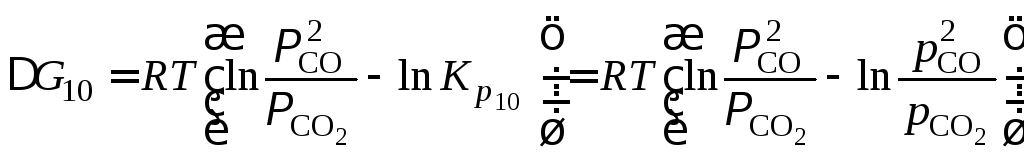 ,
,
где
![]() и
и![]() – фактические, а
– фактические, а![]() и
и![]() – равновесные давления газов.
– равновесные давления газов.
В области выше
равновесной кривой
1 при заданной
Т фактический
% СО больше
равновесного % СО
(точка кривой
1), значит,
![]() .
Поэтому здесь
.
Поэтому здесь
![]() ;
реакция (10)
должна идти
в обратном
направлении, в сто-
;
реакция (10)
должна идти
в обратном
направлении, в сто-
Таблица 1.2
Результаты расчета равновесного состава газа в системе С – О
|
Т, К |
|
|
|
|
|
|
|
| |||
|
Р= 1 атм |
| ||||||||||
|
700 |
2,65·10–4 |
1,1·1033 |
0,016 |
1,6 |
0,016 |
3,4·10–30 |
–29,5 |
| |||
|
800 |
0,011 |
5,8·1027 |
0,098 |
9,8 |
0,11 |
1,4·10–26 |
–25,8 |
| |||
|
900 |
0,19 |
4,6·1023 |
0,351 |
35,1 |
0,54 |
7,4·10–24 |
–23,1 |
| |||
|
1000 |
1,9 |
2,4·1020 |
0,724 |
72,4 |
2,62 |
6,0·10–22 |
–21,2 |
| |||
|
1100 |
12,5 |
5,0·1017 |
0,931 |
93,1 |
13,5 |
1,1·10–20 |
–19,9 |
| |||
|
1200 |
60,3 |
2,9·1015 |
0,984 |
98,4 |
61,5 |
9,1·10–20 |
–19,1 |
| |||
|
Р= 10 атм |
| ||||||||||
|
700 |
2,65·10–4 |
1,1·1033 |
0,051 |
0,51 |
0,005 |
3,5·10–29 |
–28,5 |
| |||
|
800 |
0,011 |
5,8·1027 |
0,33 |
3,3 |
0,034 |
1,5·10–25 |
–24,8 |
| |||
|
900 |
0,19 |
4,6·1023 |
1,29 |
12,9 |
0,15 |
9,9·10–23 |
–22,0 |
| |||
|
1000 |
1,9 |
2,4·1020 |
35,1 |
35,1 |
0,54 |
1,4·10–20 |
–19,8 |
| |||
|
1100 |
12,5 |
5,0·1017 |
65,6 |
65,6 |
1,91 |
5,5·10–19 |
|
| |||
|
1200 |
60,3 |
2,9·1015 |
87,3 |
87,3 |
6,9 |
7,2·10–18 |
|
| |||
|
|
| ||||||||||
|
|
| ||||||||||
|
Рис. 1.7. Изобары равновесного состава газа СО – СО2 над твердым углеродом: 1 – 1 атм; 2 – 10 атм |
Рис. 1.8. Температурная
зависимость
| ||||||||||
рону распада
СО с образованием
твердого углерода
и
![]() .
Таким образом,
oбласть выше
изобары –
это область устойчивости
углерода в контакте
с
.
Таким образом,
oбласть выше
изобары –
это область устойчивости
углерода в контакте
с
![]() ,
область распада
СО. Обратные соотношения
характерны для области ниже изобары.
Это значит, что если поддерживать состав
газовой фазы, удовлетворяющий соотношению
,
область распада
СО. Обратные соотношения
характерны для области ниже изобары.
Это значит, что если поддерживать состав
газовой фазы, удовлетворяющий соотношению![]() ,
то углерод будет непрерывно
расходоваться на взаимодействие с
,
то углерод будет непрерывно
расходоваться на взаимодействие с
![]() с образованием устойчивого оксида
СО. Соответственно данному анализу на
диаграммах обозначены области устойчивости
оксидов
углерода.
с образованием устойчивого оксида
СО. Соответственно данному анализу на
диаграммах обозначены области устойчивости
оксидов
углерода.
IIpимep
1.12. Определить
состав равновесной
газовой смеси,
полученной при
взаимодействии обогащенного
кислородом воздуха
с твердым
углеродом, для
заданных в таблице условий.
Рассчитать равновесное
давление кислородав смеси.
Результаты представить
графически в
координатах % СО – Т;![]() – Т
и сравнить с
результатами примера
1.11.
– Т
и сравнить с
результатами примера
1.11.
|
Состав обогащенного воздуха, об.% |
Температура, К |
Давление, атм | |||||||
|
|
| ||||||||
|
75 |
25 |
700 |
800 |
900 |
1000 |
1100 |
1200 |
1 |
10 |
Решение. Взаимодействие
газовой смеси
кислорода и
азота с
твердым углеродом
при избытке
последнего приводит
к образованию
смеси СО,
![]() ,
,
![]() и ничтожно малого
количества
и ничтожно малого
количества
![]() .
Равновесная система
является трехкомпонентной
и двухфазной
и по правилу
фаз имеет
число степеней
свободы равное
трем. Поэтому
заданы 3 независимые
переменные: Р,
Т и
.
Равновесная система
является трехкомпонентной
и двухфазной
и по правилу
фаз имеет
число степеней
свободы равное
трем. Поэтому
заданы 3 независимые
переменные: Р,
Т и![]()
![]() .
Расчет без
определения
.
Расчет без
определения
![]() представляет решение
системы трех уравнений:
представляет решение
системы трех уравнений:
 или
или
![]()

Здесь
![]() и
и![]() .
.
Решение системы возможнона ЭВМ или из выражений:

Результаты расчета представлены в табл. 1.3 и графически (рис. 1.9 и 1.10). Относительное содержание СО и СО2 в смеси находим из выражений:
![]() и
и
![]() Сравнение
полученных
результатов
с
данными
при
тех же
температурах
и давлениях
примера
1.11
показывают,
что
введение
азота
Сравнение
полученных
результатов
с
данными
при
тех же
температурах
и давлениях
примера
1.11
показывают,
что
введение
азота
в смесь
СО – ![]() приводит
к
увеличению
равновесного
отношения
приводит
к
увеличению
равновесного
отношения
![]() за
счет
увеличения
СО
и
уменьшения
за
счет
увеличения
СО
и
уменьшения
![]() в смеси.
Иначе,
равновесие реакции
газификации (10)
смещается вправо
в сторону
увеличения числа
молей –
эффект совпадает
с влиянием давления
при уменьшении
последнего. Действительно,
при разбавлении
смеси азотом
– газом,
не участвующим
в реакции,
уменьшается сумма
парциальных давлений
реагентов СО
и
в смеси.
Иначе,
равновесие реакции
газификации (10)
смещается вправо
в сторону
увеличения числа
молей –
эффект совпадает
с влиянием давления
при уменьшении
последнего. Действительно,
при разбавлении
смеси азотом
– газом,
не участвующим
в реакции,
уменьшается сумма
парциальных давлений
реагентов СО
и
![]() ,
что равноценно
уменьшению давления
в реакционной системе.
,
что равноценно
уменьшению давления
в реакционной системе.
Таблица 1.3
Результаты расчета равновесного состава газа в системе С – О – N
|
T, К |
|
|
Состав газовой смеси, об. % |
|
|
|
Относительное содержание в смеси, об. % | ||||
|
|
|
N2 |
|
| |||||||
|
|
|
|
Давление 1 атм | ||||||||
|
700 |
1,1·1033 |
2,6·10–4 |
0,81 |
24,49 |
74,70 |
0,03 |
8,5·10–31 |
–30,1 |
3,2 |
96,8 | |
|
800 |
5,8·1027 |
0,011 |
4,86 |
21,96 |
73,18 |
0,22 |
3,5·10–27 |
–26,5 |
18,1 |
81,9 | |
|
900 |
4,6·1023 |
0,19 |
16,68 |
14,57 |
68,74 |
1,14 |
1,7·10–24 |
–23,8 |
53,4 |
46,6 | |
|
1000 |
2,4·1020 |
1,9 |
31,61 |
5,24 |
63,15 |
6,03 |
1,1·10–22 |
–21,9 |
85,8 |
14,2 | |
|
1100 |
5,0·1017 |
12,5 |
38,14 |
1,16 |
60,70 |
32,80 |
1,9·10–21 |
–20,7 |
97,0 |
3,0 | |
|
1200 |
2,9·1015 |
60,3 |
39,58 |
0,26 |
60,16 |
151,6 |
1,5·10–20 |
–19,8 |
99,3 |
0,7 | |
|
|
|
|
Давление 10 атм | ||||||||
|
700 |
1,1·1033 |
2,6·10–4 |
0,26 |
24,84 |
74,90 |
0,01 |
8,6·10–30 |
–29,1 |
1,0 |
99,0 | |
|
800 |
5,8·1027 |
0,011 |
1,61 |
23,99 |
74,40 |
0,07 |
3,9·10–26 |
–25,4 |
6,3 |
93,7 | |
|
900 |
4,6·1023 |
0,19 |
6,34 |
21,04 |
72,62 |
0,30 |
2,4·10–23 |
–22,6 |
23,2 |
76,8 | |
|
1000 |
2,4·1020 |
1,9 |
16,67 |
14,58 |
68,75 |
1,14 |
3,2·10–21 |
–20,5 |
53,3 |
46,7 | |
|
1100 |
5,0·1017 |
12,5 |
29,14 |
6,79 |
64,07 |
4,29 |
1,1·10–19 |
–19,0 |
81,1 |
18,9 | |
|
1200 |
2,9·1015 |
60,3 |
36,46 |
2,21 |
61,33 |
16,46 |
1,2·10–18 |
–17,9 |
94,3 |
5,7 | |
Пример 1.13.Составить систему уравнений
связи между переменными для расчета
при заданных значенияхР= 1 атм иТ = 2000 К равновесного состава
газовой смеси, образующейся в реакторе
с твердым углеродом при подаче в него
воздуха с относительной
влажностью 80 % при 20 °С. Состав сухого
воздуха принять: 21 %![]() и 79 %
и 79 %
![]() (по объему). Упругость пара воды при 293
К равна 17,7 мм рт. ст.
Вычислить
значения необходимых для расчета
величин.
(по объему). Упругость пара воды при 293
К равна 17,7 мм рт. ст.
Вычислить
значения необходимых для расчета
величин.
|
|
|
|
Рис. 1.9. Изобары равновесного состава газа СО – CO2 в присутствии азота над твердым углеродом: 1 – 1 атм; 2 – 10 атм |
Рис.
1.10. Температурная зависимость
|
Решение.
Исходный газ состоит из
![]() ,
,
![]() и
и
![]() .
При взаимодействии с
.
При взаимодействии с ![]() образуются
образуются
![]() ,
,
![]() ,
,
![]() .Cистема
С – Н – О – N
– четырехкомпонентная, двухфазная,
четырехвариантная (
.Cистема
С – Н – О – N
– четырехкомпонентная, двухфазная,
четырехвариантная (![]() ).
Для расчета равновесного состава
газовой смеси необходимы четыре
независимые переменные. ЭтоРиТ,
а также два концентрационных параметра
).
Для расчета равновесного состава
газовой смеси необходимы четыре
независимые переменные. ЭтоРиТ,
а также два концентрационных параметра![]() и
и ![]() .Тогда
.Тогда
![]()
![]()
![]()
![]()
![]()
![]() – неизвестные
(вычисляемые) переменные. Парциальным
давлением
– неизвестные
(вычисляемые) переменные. Парциальным
давлением![]() при 2000 К пренебрегаем. Система уравнений
связи:
при 2000 К пренебрегаем. Система уравнений
связи:
![]()


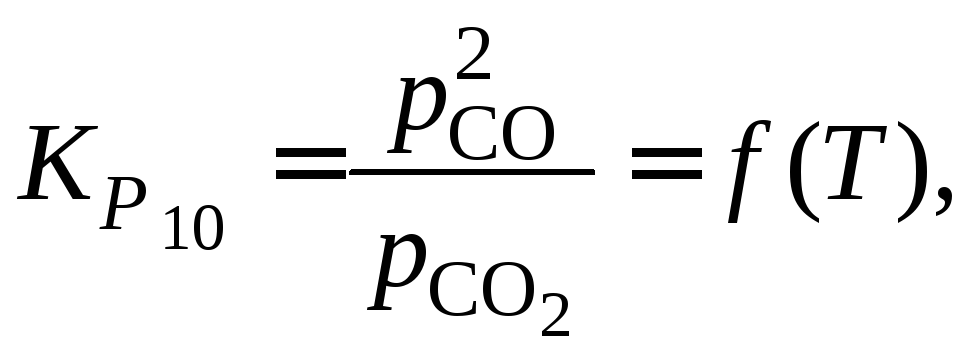

Константы равновесия реакций (10) и (5) находим из выражений:
![]() и
и
![]() (см. примеры 1.8–1.11).
(см. примеры 1.8–1.11).
При 2000 К константы
равны:
![]() и
и![]() .
Концентрационные параметры определяем
из заданного состава воздуха. СодержаниеН2О
в воздухе соответствует
.
Концентрационные параметры определяем
из заданного состава воздуха. СодержаниеН2О
в воздухе соответствует
![]() мм рт. ст. и составляет
мм рт. ст. и составляет![]() «Штрих» относится
к исходному составу воздуха. Содержание
«Штрих» относится
к исходному составу воздуха. Содержание
![]() и
и
![]() в воздухе:
в воздухе:
об. %
![]() %,
%,
об. %
![]() %.
%.
Тогда


Значения параметров
![]() ,
,![]() ,
,
![]() ,
,
![]() и
и![]() подставляем в систему уравнений
и решаем ее (с помощью
ЭВМ).
подставляем в систему уравнений
и решаем ее (с помощью
ЭВМ).