- •Количественный анализ
- •1. Весовой анализ
- •1.1. Введение
- •1.2. Лабораторная работа «Определение содержания железа весовым методом»
- •2. Объемный анализ
- •2.1. Введение
- •2.2. Кислотно-основное титрование
- •2.3. Окислительно-восстановительное титрование
- •2.4. Комплексонометрия
- •2.5. Лабораторная работа «Определение содержания соды в присутствии щелочи»
- •2.7. Лабораторная работа «Йодометрическое определение содержания меди»
- •2.8. Лабораторная работа «Определение содержания кальция и магния в совместном присутствии»
- •2.9. Лабораторная работа «Определение содержания цветных металлов трилонометрическим методом»
- •3. Задачи для решения.
2.2. Кислотно-основное титрование
Аналитическая реакция – нейтрализация кислоты щелочью или, наоборот, щелочи кислотой. Расчет результатов ведут по уравнению, вытекающему из (2.1):
![]() ,
экв/л. (2.2)
,
экв/л. (2.2)
Эквивалентную точку определяют обычно с помощью цветных индикаторов. Индикаторами являются слабые органические кислоты или основания, у которых ионная и молекулярная формы имеют различную окраску. Например, фенолфталеин содержит фенольную функциональную группу, метилоранж – ароматическая сульфокислота с функциональной группой SO3H. Процесс их диссоциации в общем виде можно представить уравнением:
![]()
Константа диссоциации индикатора равна:
![]() (2.3)
(2.3)
Концентрации
ионной и молекулярной форм в середине
области перехода окраски индикатора
равны между собой и рНпер=
рKd.
При
![]() цвет раствора будет обусловлен окраской
ионной формы индикатора и, наоборот,
при
цвет раствора будет обусловлен окраской
ионной формы индикатора и, наоборот,
при
![]() раствор будет окрашен молекулярной
формой индикатора. Поэтому переход
окраски происходит в области рН = pKd
1.
раствор будет окрашен молекулярной
формой индикатора. Поэтому переход
окраски происходит в области рН = pKd
1.
Фенолфталеин является очень слабой кислотой, поэтому он изменяет окраску от бесцветной к малиновой в слабощелочной области, при рН = 8,3 – 10. Метиловый оранжевый – кислота средней силы, изменяет окраску от красной к желтой в слабокислой области при рН = 3,7 – 5,1. Лакмус изменяет окраску от красной к синей в нейтральной области, при рН около 7.
Так как индикатор должен изменять окраску в эквивалентной точке, для правильного его выбора необходимо знать зависимость рН от объема добавленного в ходе анализа титранта. Эти зависимости называют кривыми титрования.
Кривая титрования сильной кислоты щелочью
Возьмем аликвоту раствора сильной кислоты объемом 10 мл (0,01 л) и будем титровать её 0,1 н. раствором щелочи. Концентрацию кислоты в примере выберем 0,1 н. В таблице приведены рассчитанные значения рН в ходе титрования. Зависимость рН от объема добавленного титранта дана на рис. 1.
Таблица 1. Данные для построения кривой титрования
|
VЩ, мл |
Vобщ, мл |
Число эквивалентов ионов Н+ или ОН (nЭ) |
[H+] = nЭ/Vобщ, моль/л |
рН = lg[H+] |
|
0 |
10 |
nH+ = СКVК = 0,10,01 = 103 |
103/0,01 = 0,1 |
1 |
|
9 |
19 |
103СЩVЩ = 1030,10,009 = 104 |
104/0,019 = 5,26103 |
2,28 |
|
9,9 |
19,9 |
nH+ = 10 0,0099 = 105 |
5,025104 |
3,30 |
|
9,99 |
19,99 |
nH+ = 10 |
5,05105 |
4,30 |
|
10 |
20 |
nH+= nOH-=107 |
107 |
7,00 |
|
10,01 |
20,01 |
nOH- = 106 |
1,981010 |
9,70
|
|
10,1 |
20,1 |
nOH- = 105 |
2,01011 |
10,7
|
|
11 |
21 |
nOH- = 104 |
2,11012 |
11,68
|
|
20 |
40 |
nOH- = 103 |
4,01013 |
12,4 |
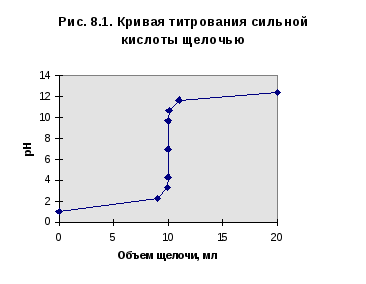
Точка эквивалентности соответствует объему титранта 10 мл. Обращает внимание резкий скачок величины рН в этой области. Объем одной капли раствора обычно составляет не менее 0,01-0,02 мл. В области эквивалентной точки при добавлении капли щелочи рН возрастает на 3-6 единиц. Поэтому эквивалентную точку можно засечь с помощью любого цветного индикатора, изменяющего окраску в области значений рН от 4 до 10.
Кривая титрования щелочи кислотой будет зеркальным отражением построенной зависимости.
Кривая титрования слабой кислоты щелочью
Для титрования возьмем в качестве примера аликвоту объемом 10 мл 0,1 М раствора уксусной кислоты и будем титровать её 0,1 М раствором щелочи. Результаты расчета кривой титрования приведены в табл. 2.
Таблица 2. Данные для построения кривой титрования
|
VЩ, мл |
тип раствора |
Формулы для расчета |
рН |
|
0 |
Слабая кислота |
рН = ½ (pKdlgC) = ½ (4,756lg0,1) |
2,88 |
|
1 |
Область буферных растворов типа 1: |
pH = pKd + lg(CC/CК) = 4,756 + + lg(104/ 9104) |
3,80 |
|
3 |
Слабая кислота плюс её соль |
рН = 4,756 + lg(3/7) |
4,39 |
|
5 |
СН3СООН + NaСН3СОО |
pH = pKd |
4,756 |
|
7 |
(соль является продуктом |
рН = 4,756 + lg(7/3) |
5,12 |
|
9 |
нейтрализации) |
рН = 4,756 + lg9 |
5,71 |
|
10 |
гидролизующаяся соль NaСН3СОО |
[OH] = (KhC)½ = (5,710100,05)½ = =5,34106; pOH = -lg5,34106 = 5,27; |
8,73 |
|
10,01 |
избыток щелочи |
рОН = -lgСЩ; рН = 14 рОН; Расчет избыточной СЩ в табл. 1. |
9,7 |
|
10,1 |
|
|
10,7 |
|
11 |
|
|
11,68 |
|
20 |
|
|
12,4 |
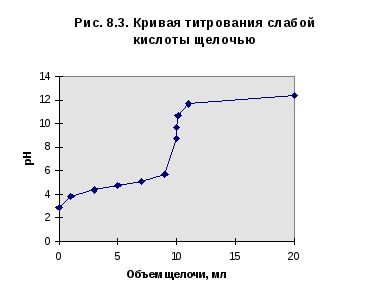
При рассмотрении кривой титрования обращает внимание то, что точка эквивалентности лежит в щелочной области. Скачок значений рН вблизи эквивалентной точки меньше, чем на рис.1, не превышает 1-2-х единиц при добавлении одной капли титранта. Для титрования следует выбирать индикатор, изменяющий окраску в щелочной среде, в примере - при рН=9-10. Таковым является фенолфталеин.
Кривая титрования слабого основания кислотой, например, раствора аммиака или его органического производного - амина, будет зеркальным отображением графика 3. Точка эквивалентности при этом окажется в кислой области. Для её определения необходим индикатор, изменяющий окраску в выбранном примере в области значений рН = 4-5. Таковым является метиловый оранжевый.
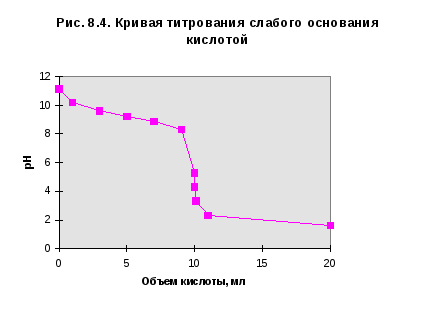
Кривая титрования раствора соли слабого электролита
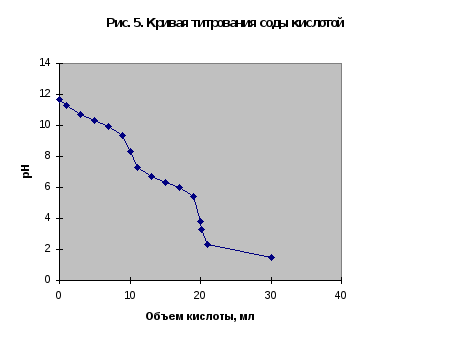
Рассмотрим в качестве примера кривую титрования раствора соды. Так как ионы слабой угольной кислоты связывают катионы Н+, карбонатные растворы можно титровать кислотами. Нейтрализация протекает в две ступени:
СО32 + Н+ НСО3;
НСО3 + Н+ Н2СО3.
Соответственно, на кривой титрования выделяют две эквивалентные точки. Результаты расчета титрования аликвоты объемом 10 мл 0,1 M раствора соды 0,1 M соляной кислотой приведены в табл.3 и на рис.5.
Таблица 3. Данные расчета кривой титрования соды кислотой
|
VК, мл |
Тип раствора |
Формулы для расчета |
РН |
|
0 |
Гидролизующаяся соль |
[OH] = (Kh,1C)½ = (2,131040,1)½; pOH = -lg[OH]; pH = 14 pOH |
11,66 |
|
1 |
Область буферных растворов типа 2: |
рН = pKd,2 + lg(CC/CK) = 10,33 + lg9 |
11,28 |
|
3 |
смесь средней и кислой солей |
рН = 10,33 + lg(7/3) |
10,70 |
|
5 |
Na2CO3 + NaHCO3 |
pH = pKd,2 = 10,33 |
10,33 |
|
7 |
|
pH = 10,33 + lg(3/7) |
9,96 |
|
9 |
|
pH = 10,33 + lg(1/9) |
9,38 |
|
10 |
Кислая соль слабой кислоты
|
РН = ½(pKd,1 + pKd,2) = ½(6,35 + 10,33) |
8,34 |
|
11 |
Область буферных растворов типа 1: |
рН = pKd,1 + lg(CC/CK) = 6,35 + lg9 |
7,30 |
|
13 |
Слабая кислота плюс её соль |
рН = 6,35 + lg(7/3) |
6,72 |
|
15 |
H2CO3 + Na2CO3 |
pH = pKd,1 |
6,35 |
|
17 |
|
pH = 6,35 + lg(3/7) |
5,98 |
|
19 |
|
pH = 6,35 + lg(1/9) |
5,40 |
|
20 |
Слабая кислота Н2СО3 |
РН = ½(pKd,1 lgC) = ½(6,35 lg0,05) |
3,83 |
|
20,1 |
Избыток сильной кислоты |
рН = -lg[H+]ИЗБ = -lg(5104) |
3,30 |
|
21 |
|
pH = -lg(4,76103) |
2,32 |
|
30 |
|
pH = -lg0,033 |
1,48 |
На кривой титрования выделяются две эквивалентные точки, соответствующие добавлению 10 и 20 мл кислоты. Скачки рН в них невелики, менее 2 единиц. Первую точку эквивалентности можно определить по обесцвечиванию фенолфталеина при рН=8,3, вторую - по переходу окраски метилового оранжевого из желтой в красную в области рН около 3,7.
Кривая титрования смеси сильной и слабой кислот
Кривая титрования получается совмещением соответствующих участков рис. 1 и 3. Первый участок соответствует титрованию сильной кислоты. Поэтому в первой эквивалентной точке рН раствора определяется присутствием слабой кислоты. Далее кривая титрования аналогична таковой на рис. 3. В качестве примера рассмотрим титрование аликвоты объемом 10 мл, содержащей 0,1 М соляную и 0,1 М уксусную кислоты, 0,1 н. раствором щелочи.
При расчете первого участка кривой титрования следует учесть вклад слабой кислоты в концентрацию ионов Н+, который значителен вблизи первой эквивалентной точки и приводит к её сдвигу от значения рН=7 в кислую область. Формулу для расчета концентрации ионов Н+ получим из условия баланса зарядов, пренебрегая вкладом в него ионов гидроксила, который мал в кислой среде:
Баланс зарядов: [H+] + [Na+] = [Cl] + [CH3COO];
В этом уравнении произведем следующие подстановки:
[Na+] = CЩVЩ / VОБЩ = 0,1VЩ / VОБЩ;
[Cl] = CHClVHCl / VОБЩ = 103/ VОБЩ;
[CH3COO] = Kd[CH3COOH] / [H+] = Kd103/ VОБЩ[H+];
После подстановок получаем уравнение 2й степени для вычисления [H+]:
[H+]2 (103 0,1VЩ)[H+] / VОБЩ Kd103/ VОБЩ = 0;
Решение находим по формуле:
[H+] = (103 0,1VЩ) / 2VОБЩ +
{(103 0,1VЩ)2 / 4VОБЩ2 + Kd103/ VОБЩ}½ (2.4)
Таблица 4. Данные расчета кривой титрования смеси соляной и уксусной кислот щелочью
|
VЩ, мл |
Тип раствора |
Формулы для расчета |
рН |
|
0 |
Сильная кислота |
рН = -lgCHCl |
1 |
|
5 |
смесь кислот |
по (2.4) |
1,48 |
|
9 |
|
|
2,26 |
|
9,5 |
|
|
2,54 |
|
10 |
слабая кислота |
рН = ½(pKdlgC) = ½(4,756lg0,1) |
2,88 |
|
11 |
область буферных растворов типа 1: |
pH = pKd + lg(CC/CК) = 4,756 + + lg(104/ 9104) |
3,80 |
|
13 |
слабая кислота плюс её соль |
рН = 4,756 + lg(3/7) |
4,39 |
|
15 |
СН3СООН + NaСН3СОО |
pH = pKd |
4,756 |
|
17 |
(соль является продуктом |
рН = 4,756 + lg(7/3) |
5,12 |
|
19 |
нейтрализации) |
рН = 4,756 + lg9 |
5,71 |
|
20 |
гидролизующаяся соль NaСН3СОО |
[OH] = (KhC)½ = (5,710100,05)½ = =5,34106; pOH = -lg5,34106 = 5,27; |
8,73 |
|
20,01 |
избыток щелочи |
РОН = -lgСЩ; рН = 14 рОН; Расчет избыточной СЩ в табл. 1. |
9,7 |
|
20,1 |
|
|
10,7 |
|
21 |
|
|
11,68 |
|
30 |
|
|
12,4 |
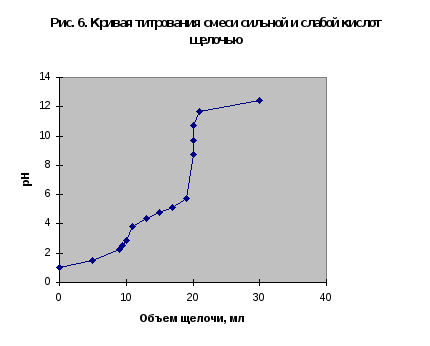
Первой точке эквивалентности, соответствующей содержанию в пробе сильной кислоты, в рассматриваемом примере отвечает слабый скачок значений рН, который можно зафиксировать с помощью рН-метра или, менее точно, по желтому окрашиванию динитрофенола. Если вторая кислота слабее уксусной, например, фенол с Kd=1010, то первая точка эквивалентности будет выражена резче, но слабее проявится вторая эквивалентная точка.
Кривая титрования слабой многоосновной кислоты щелочью
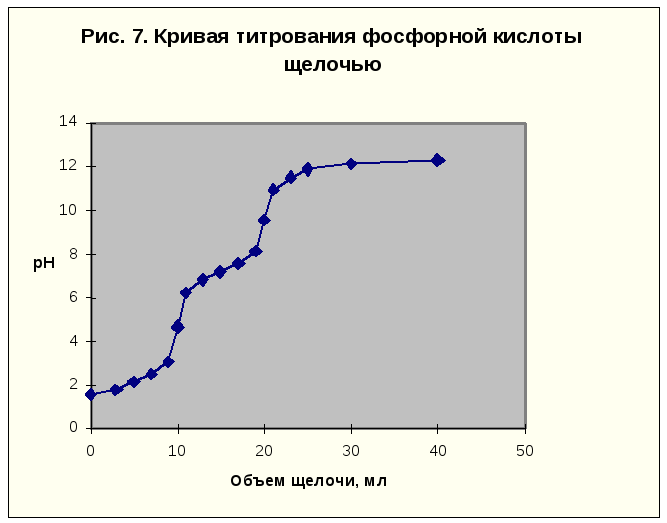
Если слабая кислота многоосновная, то на кривой титрования будет несколько эквивалентных точек, соответственно числу ступеней диссоциации. Рассмотрим кривую титрования 10 мл 0,1 М фосфорной кислоты 0,1 н. щелочью.
Таблица 5. Данные расчета кривой титрования фосфорной кислоты щелочью
|
VЩ, мл |
Тип раствора |
Формулы для расчета |
рН |
|
0 |
Слабая кислота |
рН = ½(pKd,1lgC) = ½(2,148lg0,1) |
1,57 |
|
3 |
Буферный раствор типа слабая |
рН = pKd,1 + lg(CC/CK) = 2,148 + lg(3/7) |
1,78 |
|
5 |
Кислота плюс её |
рН = pKd,1 |
2,148 |
|
7 |
соль Н3РО4 + |
рН = 2,148 + lg(7/3) |
2,52 |
|
9 |
NaH2PO4 |
pH = 2,148 + lg9 |
3,10 |
|
10 |
кислая соль слабой кислоты NaH2PO4 |
pH = ½(pKd,1 + pKd,2) = ½(2,148 + 7,198) |
4,67 |
|
11 |
Буфер NaH2PO4 (слабая кислота) + |
pH = pKd,2 + lg[HPO42] / [H2PO4] = = 7,198 + lg(1/9) |
6,24 |
|
13 |
+ Na2HPO4 |
pH = 7,198 + lg(3/7) |
6,83 |
|
15 |
(её соль) |
pH = pKd,2 |
7,20 |
|
17 |
|
pH = 7,198 + lg(7/3) |
7,57 |
|
19 |
|
pH = 7,198 + lg9 |
8,15 |
|
20 |
кислая соль слабой кислоты Na2HPO4 |
PH = ½(pKd,2 + pKd,3) = ½(7,198 + 11,90) |
9,55 |
|
21 |
Буфер Na2HPO4 (слабая кислота) + |
pH = pKd,3 + lg[PO43] / [HPO42] = 11,90 + lg(1/9) |
10,95 |
|
23 |
Na3PO4 (её соль) |
pH = 11,90 + lg(3/7) |
11,53 |
|
25 |
|
pH = pKd,3 |
11,90 |
|
30 |
Гидролизующаяся соль Na3PO4 |
[OH] = (KhC)½ = (7,941030,025)½ |
12,15 |
|
40 |
Избыток щелочи |
рОН = -lgCЩ; рН = 14 рОН |
12,30 |
Следует отметить, что вследствие малой константы диссоциации кислоты по третьей ступени, на кривой титрования фосфорной кислоты можно выделить только 2 скачка значений рН, соответствующих двум эквивалентным точкам. Первую из них при рН около 4,7 удобно определять с помощью индикатора бромкрезолового зеленого по переходу окраски из желтой в голубую, вторую эквивалентную точку при рН в районе 9,6 можно определить с тимоловым голубым.