
- •Количественный анализ
- •1. Весовой анализ
- •1.1. Введение
- •1.2. Лабораторная работа «Определение содержания железа весовым методом»
- •2. Объемный анализ
- •2.1. Введение
- •2.2. Кислотно-основное титрование
- •2.3. Окислительно-восстановительное титрование
- •2.4. Комплексонометрия
- •2.5. Лабораторная работа «Определение содержания соды в присутствии щелочи»
- •2.7. Лабораторная работа «Йодометрическое определение содержания меди»
- •2.8. Лабораторная работа «Определение содержания кальция и магния в совместном присутствии»
- •2.9. Лабораторная работа «Определение содержания цветных металлов трилонометрическим методом»
- •3. Задачи для решения.
1.2. Лабораторная работа «Определение содержания железа весовым методом»
Студенты получают для анализа раствор, содержащий Fe2+ и Fe3+. Из раствора мерной пипеткой отбирают в химический стакан аликвоту объемом 5 мл, добавляют около 1 мл 2 н. азотной кислоты и разбавляют раствор в стакане дистиллированной водой до 50 мл. Раствор нагревают на песчаной бане до кипения, при этом происходит окисление железа до 3-валентного. Так как осаждаемый гидроксид железа аморфный, в горячий раствор добавляют избыток концентрированного раствора аммиака. Раствор с осадком нагревают ещё несколько минут, в течение которых заканчивается коагуляция гидроксида железа с образованием крупных хлопьев. Горячий раствор отделяют от осадка на бумажном беззольном фильтре. Осадок количественно, без потерь, переносят на фильтр, а стаканчик и палочку вытирают влажными кусочками фильтровальной бумаги, которые также помещают на фильтр. Осадок промывают на фильтре 2-3 раза горячей дистиллированной водой, в которую добавляют несколько капель раствора аммиака. Затем фильтр с осадком переносят в фарфоровый тигель, предварительно прокаленный до постоянного веса.
Осадок высушивают на песчаной бане и озоляют фильтр в муфельной печи при открытой дверце. Если осадок плохо высушен, в горячей печи может произойти разбрызгивание. При озолении фильтра необходимо избегать образования пламени, которое может быть причиной выброса осадка из тигля. Дверцу муфеля при озолении приоткрывают, чтобы обеспечить избыток кислорода. Иначе может произойти восстановление весовой формы углеродом фильтра. Прокаливание ведут 40-60 минут при температуре 800-9000С, при которой гидроксид железа полностью переходит в весовую форму Fe2O3 по реакции:
2Fe(OH)3 Fe2O3 + 3H2O.
Тигель с оксидом железа охлаждают в эксикаторе над осушителем и взвешивают на аналитических весах. Концентрацию взятого на анализ раствора вычисляют по формуле:
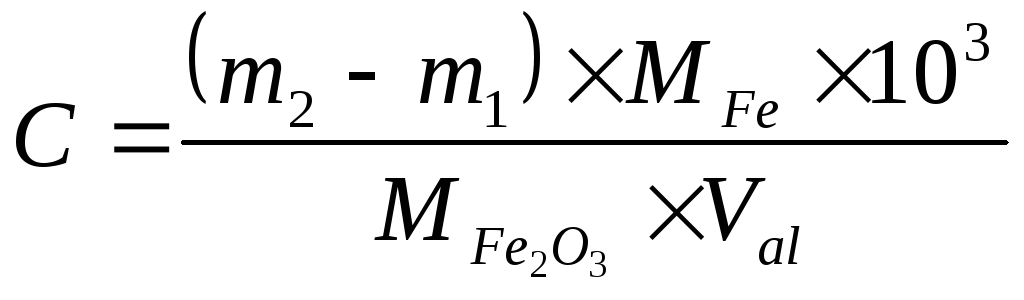 г/л,
г/л,
где
![]() и
и![]() - массы пустого тигля и тигля с осадком
в граммах,
- массы пустого тигля и тигля с осадком
в граммах,![]() и
и![]() -
молярные массы железа и оксида железа
(Ш),
-
молярные массы железа и оксида железа
(Ш),![]() - объем взятой для анализа аликвоты
раствора в мл.
- объем взятой для анализа аликвоты
раствора в мл.
2. Объемный анализ
2.1. Введение
Объемным анализом называют группу методов, основанных на измерении объема раствора с известной концентрацией, который необходимо добавить к пробе для протекания аналитической реакции в соответствии со стехиометрическим уравнением. Добавляемый реагент называют титрантом, а его раствор с заданной концентрацией – титрованным раствором. Для анализа с помощью мерной пипетки отбирают от растворенной пробы точный объем, называемый аликвотным. Задача состоит в определении эквивалентной точки – состояния системы, в котором полностью, в эквивалентных соотношениях, прореагировали определяемый элемент и титрант. Эту задачу решают путем титрования – добавления по каплям к аликвоте пробы раствора титранта. Первая избыточная капля титранта вызывает изменение окраски индикатора или физико-химических свойств раствора (электропроводности, электродного потенциала и т.п.), по которому определяют эквивалентную точку. Соответствующий ей объем титранта называют эквивалентным.
В точке эквивалентности число эквивалентов определяемого элемента равно числу эквивалентов титранта. Поскольку число эквивалентов равно произведению нормальной концентрации на объем раствора, в данном состоянии системы выполняется соотношение, называемое законом эквивалентов для растворов:
![]() ,
(2.1)
,
(2.1)
где
![]() - нормальная концентрация раствора
пробы,
- нормальная концентрация раствора
пробы,![]() - объем аликвоты,
- объем аликвоты,![]() - нормальная концентрация раствора
титранта,
- нормальная концентрация раствора
титранта,![]() - измеренный эквивалентный объем. Из
данной формулы можно рассчитать
концентрацию пробы.
- измеренный эквивалентный объем. Из
данной формулы можно рассчитать
концентрацию пробы.
По типу аналитической реакции в объемном анализе выделяют несколько методов, которые будут рассмотрены ниже.
