
fizika_zachet_1-5_1_1_(1)
.pdf
1.Термодинамическая система. Основные параметры состояния.
Термодинамика – это наука о закономерностях перехода энергии между системами Т. система – совокупность объектов, взаимосвязь между которыми больше, чем с объектами внешней среды. Термодинамические системы:
Изолированные (∆m=0, ∆E=0) – не обменивается с внешней средой ни объемом, ни энергией.
Закрытые (∆m=0, ∆E≠0) – то же, но возможен обмен энергией
Открытые (∆m≠0, ∆E≠0)
Состояния:
1.Равновесное состояние системы – параметры системы постоянны, нет вещества и потока энергии.
2.Стационарное состояние – параметры системы не изменяются, при наличии потока вещества и энергии.
3.Переходное состояние – параметры системы изменяются.
Термодинамические системы бывают трех видов:
1.Изолированные (нет обмена ни веществом, ни энергией с окружающей средой). Пример – герметичный сосуд с газом с теплоизоляционной оболочкой, Вселенная в целом.
2.Замкнутые (нет обмена веществом с окружающей средой). Пример – герметичный сосуд.
3.Открытые (есть и энерго- и массообмен с окружающей средой). Пример – костер, человек.
Энергия – количественная мера определенного вида движения материи при еѐ превращениях (Дж) 1кал=4,184Дж Состояния систем характеризуются параметрами состояния и функциями состояния.
Параметры состояния системы – это свойства, однозначно характеризующие однородные части системы. Например, для идеального газа параметрами являются четыре свойства – давление P, объѐм V, температура T и количества молей m . Любые три из них – независимы. Это означает, что, задав произвольно любые три из четырех параметров, мы по уравнению состояния (в данном случае это будет уравнение КлапейронаМенделеева) найдем четвертый:
PV= m RT
Для более сложных систем могут появиться дополнительные параметры состояния – например, химический состав.
Параметры делятся на интенсивные и экстенсивные. Интенсивные параметры не зависят от количества вещества в системе (давление, температура, напряженность электрического поля и др.), а экстенсивные – зависят (объем, масса, заряд и др.)
Для описания термодинамической системы вводят так называемые термодинамические величины — набор физических величин, значения которых определяют термодинамическое состояние системы. Примерами термодинамических величин являются:
температура
давление
объем
внутренняя энергия
энтропия
энтальпия
свободная энергия Гельмгольца
энергия Гиббса
Если термодинамическое состояние системы не меняется со временем, то говорят, что система находится в состоянии равновесия. Строго говоря, термодинамические величины, приведѐнные выше, могут быть определены только в состоянии термодинамического равновесия.
2.Первый закон термодинамики, его приложение к биосистемам. Закон Гессе
1-й з-н терм-ки: количество теплоты, переданное системе, идѐт на изменение еѐ внутренней энергии и совершения спонтанной работы. Q=∆U+A (является законом сохранения энергии)(А=∆U). Определяет не возможность создания вечного двигателя первого рода.
Изохорические процессы: V=constQ=∆U Изобарические: p=constQ=∆U+p∆V

Изотермические: t=const
Для изобарного процесса: A= -p∆VQ=∆U+p∆V Для биосистемы характерны изобар.процессы.
Энтальпия (Н) –термодинамическая характеристика или функциональное состояние системы приращения которой равно теплоте, полученной в изобарном процессе. H=U+pV
Первый закон термодинамики – закон сохранения энергии – гласит: энергия не создается и не исчезает, она превращается из одной формы в другую. В результате превращений энергии определено, что никогда нельзя получить энергии больше чем затрачено - нельзя из ничего получить нечто. На выходе из системы энергия преобразуется в иные формы.
Любая преобразовательная деятельность человека не в состоянии ни создать, ни уничтожить ни единого атома вещества, а лишь позволяет перевести из одного состояния в другое. С точки зрения природопользования необходимо усвоить, что любой процесс будет создавать отходы, которые также являются частью преобразовательного природного вещества.
3.Эффективность энергетических процессов. Терморегуляция.
Вработу может быть преобразована только часть внутренней энергии системы называется свободной энергией, остальная связанная. U=G+Eсвяз
Работа, процессы для которой (A=∆G) совершенная работа равна свободной энергии является обратимой. Для обр.проц.: А1=А2, для необр.проц.: А1‹А2 Организм человека, совершает работу используя энергию химических связей органических веществ поступающих с пищей. ∆U=Eпищи – Q – A
Внорме для стационарного состояния организма человека изменение внутренней энергии = 0 (∆U=0) Eпищи= Q+A
Терморегуляция включает:
1.Химическая терморегуляция-это усиление обмена веществ и соответственно теплопродукции при t среды ниже +15, и ослабление при t выше +30.
2.Физическая терморегуляция осуществляется путем изменений отдачи тепла организмом. Особо важное значение она приобретает в поддержании постоянства температуры тела во время пребывания организма в условиях повышенной температуры окружающей среды. Теплоотдача осуществляется путем теплоизлучения (радиационная теплоотдача)(длинна волны=10мкм, в состоянии покоя при tсреды=20, 70%тепла отводится во внешнюю среду), конвекции, т. е. движения и перемешивания нагреваемого телом воздуха, теплопроведе-ния,
т. е. отдачи тепла веществам, непосредственно соприкасающимся с поверхностью тела = − ; И испарения воды с поверхности кожи и легких.QE=Lm (L-удельная теплота испарения)
4.Второе начало термодинамики, его приложение к биосистемам. Энтропия. Энергия Гиббса.
Теплота не может самопроизвольно переходить от тела с меньшейt к телу с большей t.
Энтропия (S) –это термодинамическая функция состояния, которая служит мерой неупорядоченного расположения частиц системы; самопроизвольные процессы характеризующиеся увеличением энтропии.
Понятие энтропии было впервые введено в 1865 году Рудольфом Клаузиусом. Он определил изменение энтропии термодинамической системы при обратимом процессе как отношение изменения общего количества тепла ΔQ к величине
абсолютной температуры T:
2-е начало термодинамики – энтропия изолированной системы возрастает в необратимых процессах и остается неизменной в обратимых термодинамических процессах. ∆S≥∆Q/T
Второй закон термодинамики утверждает: при любых превращениях энергия переходит в форму, наименее пригодную для использования и наиболее легко рассеивающуюся. Этот закон устанавливает, что любые превращения энергии не позволяют получить ее больше, чем было затрачено изначально, то есть любой материальный объект на Земле при любых физических, химических или иных изменениях может лишь видоизменять энергию из одного вида в другой, но не добиться ее возникновения или исчезновения.
При определении любого энергетического процесса, текущего самопроизвольно, происходит переход энергии из концентрированной формы в рассеянную, то есть всегда существуют потери энергии (в виде недоступного для использования тепла), при этом стопроцентный переход из одного вида энергии в другой невозможен. Характерно действие этого закона при переходе из одной формы в другую в живых системах: солнечная энергия в растениях при
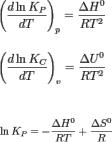
помощи фотосинтеза преобразуется в органическое вещество и далее в пище консументов преобразуется в движение мышц, работу мозга и другие проявления жизни.
На каждом этапе высококачественная энергия переходит с одного уровня на другой, и при этом ее основная часть превращается в низкокачественное тепло и рассеивается в окружающей среде. В открытых системах энтропия (мера количества связанной энергии, которая в изотермическом процессе недоступна для использования, мера беспорядка, неупорядоченности системы) переходит не в полезную работу, а в тепло и рассеивается в пространстве и снижается до определенной минимальной величины, но всегда большей нуля.
Энергия Гиббса
Определяет возможность самопроизвольного протекания процесса с учетом энтальпийного и энтропийного факторов ∆G=∆H-T∆S, если ∆G<0 – такой процесс разрешен и будет происходить, если ∆G>0 – запрещен и в данных условиях не может происходить.
Термодинамические запрещенные процессы могут быть реализованы за счет механизмов энергетического сопряжения.
5.Организм как открытая термодинамическая система. Принцип Ле-Щателье. Уравнение Пригожина.
Биосистемы относятся к открытому типу термодинамических систем. Для открытых: ∆S=∆Si+∆Se, где ∆Si – изменение энтропии, обусловленное необратимыми процессами в системе, ∆Se – изменение энтропии, вызванное взаимодействием систем с внешними телами.
Теорема Пригожина: в стационарном состоянии скорость возникновения энтропии вследствии необратимых процессов имеет минимальное значение при данных условиях dSi/dt→min
Принцип Ле-Шателье: если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какоелибо из условий равновесия (температура, давление, концентрация, внешнееэлектромагнитное поле), то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия.
Влияние температуры зависит от знака теплового эффекта реакции. При повышении температуры химическое равновесие смещается в направлении эндотермической реакции, при понижении температуры — в направленииэкзотермической реакции. В общем же случае при изменении температуры химическое равновесие смещается в сторону процесса, знак изменения энтропии в котором совпадает со знаком изменения температуры. Зависимость константы равновесия от температуры в конденсированных системах описывается уравнением изобары Вант-Гоффа:
в системах с газовой фазой — уравнением изохоры Вант-Гоффа
В небольшом диапазоне температур в конденсированных системах связь константы равновесия с температурой выражается следующим уравнением:
Например, в реакции синтеза аммиака
N2 + 3H2 2NH3 + Q
тепловой эффект в стандартных условиях составляет +92 кДж/моль, реакция экзотермическая, поэтому повышение температуры приводит к смещению равновесия в сторону исходных веществ и уменьшению выхода продукта. Давление существенно влияет на положение равновесия в реакциях с участием газообразных веществ, сопровождающихся изменением объѐма за счѐт изменения количества вещества при переходе от исходных веществ к продуктам:
При повышении давления равновесие сдвигается в направлении, в котором уменьшается суммарное количество молей газов и наоборот.
В реакции синтеза аммиака количество газов уменьшается вдвое: N2 + 3H2 ↔ 2NH3
Значит, при повышении давления равновесие смещается в сторону образования NH3, о чем свидетельствуют следующие данные для реакции синтеза аммиака при 400 °C:
Введение в реакционную смесь или образование в ходе реакции инертных газов действует так же, как и понижение давления, поскольку понижается парциальное давление реагирующих веществ. Следует отметить, что в данном случае в качестве инертного газа рассматривается газ, не участвующий в реакции. В системах с уменьшением количества молей газов инертные газы смещают равновесие в сторону исходных веществ, поэтому в производственных процессах, в которых могут образовываться или накапливаться инертные газы, требуется периодическая продувка газоводов. Влияние концентрации на состояние равновесия подчиняется следующим правилам:
При повышении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов реакции;

При повышении концентрации одного из продуктов реакции равновесие сдвигается в направлении образования исходных веществ.
6 Современные представления о строении биомембраны. Самоорганизация липидных молекул.
Основу структуры любой мембраны представляет двойной липидный слой (фосфолипиды). Молекулы липидов, образующие мембрану, являются амфипатическими соединениями, т.е. состоят из двух различных частей: гидрофильной головки и гидрофобного хвоста. Двойной липидный слой обр. из двух монослоев липидов так, что гидрофобные хвосты обоих слоев направлены внутрь.
В настоящее время наиб. Распространение имеет предложенная в 1972 г. Синджером и Николсоном жидкомозаичная модель, в основе которой лежит все та же липидная бислойная мембрана. Эта фосфолипидная основа представляет собой как бы двумерный растворитель, в котором плавают погруженные белки. За счет белков осуществляются специфические ф-ции мембраны – проницаемость, активный перенос через мембрану и т.д.
Мембраны не являются неподвижными структурами. Липиды и белки обмениваются местами и перемещаются как вдоль плоскости мембраны – латеральная диффузия, так и поперек ее – «флип - флоп».
7 Фазовые переходы в липидномбислое. Роль физического состояния липидов в функционировании мембраны.
При изменении температуры в мембране можно наблюдать фазовые переходы: плавление липидов при нагревании и кристаллизацию при охлаждении. Фазовые переходы связаны с изменением энергии и поэтому могут быть обнаружены по увеличению теплоемкостиспри изменении температуры. Жидкокристаллическое состояние бислоя имеет меньшую вязкость и большую растворимость различных веществ, чем твердое состояние. Толщина жидкокристаллическогобислоя меньше, чем твердого. Конформация молекул в жидком и твердом состояниях различна. В жидкой фазе молекулы фосфолипидов могут образовывать полоски, в которые способны внедряться молекулы диффундирующего вещества. Перемещение полоски в этом случае будет приводить к диффузии молекулы поперек мембраны.
8 Простая диффузия. Уравнение Фика, уравнение Нернста – Планка.
Диффузия – самопроизвольное движение в-в из области большей концентрации в область меньшей концентрации. Простая диффузия может осуществляться через:
Липидный бислой
Белковый канал
Поры в липидномбислое
Ур-иеФика описывает диффузию в однородной среде:
= − |
|
знак «-» показывает, что суммарная плотность потока в-ва при диффузии направлена |
в сторону |
|
|
||||
|
|
|
уменьшения концентрации.
– плотность потока (кол-во в-ва , переносимое через единицу площади за единицу времени) С- молярная концентрация
D – коэффициент диффузии
Уравнение НернстаПланка:
= − |
|
− |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
– подвижные диффундирующие частицызаряд ионапостоянная Фарадея
с - молярная концентрация ионовградиент мембранного потенциала.
9 Облегченная диффузия на примере антибиотиков валиномицина и грамицидина.
Валиномицин- подвижный переносчик. Он формирует гидрофобный комплекс с транспортирующим ионом. Особенности химического строения валиномицина позволяют образовывать комплекс с ионами калия, попадающими внутрь молекулы-манжетки, и в то же время валиномицин растворим в липидной фазе мембраны, так как снаружи его молекула неполярна. Ионы калия удерживаются внутри молекулы за счет сил ион-дипольного взаимодействия. Молекулы валиномицина, оказавшиеся у поверхности мембраны, могут захватывать из окружающего раствора ионы калия. Диффундируя в мембране, молекулы переносят калий через мембрану и отдают ионы в раствор по другую сторону мембраны. Таким образом и происходит челночный перенос ионов калия через мембрану. Грамицидин-фиксирующий переносчик. Он встраивается в мембрану, формируя гидрофильный канал.

Особенности облегченной диффузии:
Обязат. концентрационный градиент
При увеличении концентрационного градиента плотность потока увеличивается до стадии насыщения
Возможна конкуренция между веществами близкими по структуре.
10.ОСМОС И 11. ФИЛЬТРАЦИЯ

12. Активный транспорт веществ. Опыт Уссинга. Принцип работы ионных насосов.


13. потенциал покоя: механизм образования, био.значение.


