
- •1. Зависимость скорости реакции от концентрации субстрата
- •2. Зависимость от концентрации фермента
- •3. Зависимость скорости реакции от температуры
- •4. Зависимость скорости реакции от рН
- •1. Метаболизм феиилаланина
- •2. Особенности обмена тирозина в разных тканях.
- •55. Функции воды в организме. Регуляция обмена воды антидиуретическим гормоном.
- •56. Функции минеральных веществ. Регуляция солевого обмена альдостероном и гормонами предсердий. Биохимические механизмы развития почечной гипертензии.
- •57. Регуляция обмена кальция и фосфора. Роль паратгормона и тиреокальцитонина. Витамин д. Роль 1,25-дигидроксикальциферола в регуляции кальция и фосфатов. Рахит.
1. Метаболизм феиилаланина
Основное количество фенилаланина расходуется по 2 путям: 1)включается в белки;2)превращается в тирозин.
Превращение фенилаланина в тирозин прежде всего необходимо для удаления избытка фенилаланина, так как высокие концентрации его токсичны для клеток. Образование тирозина не имеет большого значения, так как недостатка этой аминокислоты в клетках практически не бывает.
Основной путь метаболизма фенилаланина начинается с его гидроксилирования (рис. 9-29), в результате чего образуется тирозин. Эта реакция катализируется специфической монооксиге-назой - фенилаланингидр(жсилазой, кофермен-том которой служит тетрагидробиоптерин (Н4БП). Активность фермента зависит также от наличия Fe2+. Реакция необратима. Н4БП в результате реакции окисляется в дигидробиоптерин (Н2БП). Регенерация последнего происходит при участии дигидроптеридинредуктазы с использованием NADPH + H+.
2. Особенности обмена тирозина в разных тканях.
Обмен тирозина значительно сложнее, чем обмен фенилаланина. Кроме использования в синтезе белков, тирозин в разных тканях выступает предшественником таких соединений, как катехоламины, тироксин, меланины, и ка-таболизируется до СО2 и Н2О. Катаболизм тирозина в печени. В печени происходит катаболизм тирозина до конечных продуктов. Специфический путь катаболизма включает несколько ферментативных реакций, завершающихся образованием фумарата и ацетоацетата.
Т рансаминирование
тирозина с ос-кетоглутаратом катализирует
тирозинаминотрансфе-раза (кофермент
ПФ) - индуцируемый фермент печени
млекопитающих. В результате образуется
п-гидроксифенилпируват. В реакции
окисления п-гидроксифенилпирувата в
гомогентизиновую кислоту происходит
декарбоксилирование, гидроксилирование
ароматического кольца и миграция боковой
цепи. Реакцию катализирует фермент
п-гидроксифенилпируватдиоксигеназа,
кофакторами которого выступают витамин
С и Fe2+. Превращение гомогентизиновой
кислоты в фумарилацетоацетат сопровождается
расщеплением ароматического кольца.
Эта реакция катализируется диоксигеназой
гомогентизиновой кислоты, в качестве
кофермента содержащей Fe2+. Обмен
фенилаланина и тирозина связан со
значительным количеством реакций
гидроксилирования, которые катализируют
оксигеназы. Ферменты оксигеназы
(гидроксилазы) используют молекулу О2
и кофермент-донор водорода (чаще - Н4БП).
Для катализа оксигеназам не
обходимы
кофакторы - Fe2+ или гем (для некоторых -
Сu+), а для многих ещё и витамин С. Оксигеназы
делят на 2 группы: Монооксигеназы - один
атом О2 присоединяют к продукту реакции,
другой используют для образования Н2О;
Диоксигеназы - оба атома О2 используют
для образования продукта реакции. Почти
все процессы расщепления ароматических
колец в биологических системах
катализируются диоксигеназами. В
результате разрыва бензольного кольца
образуется малеилацетоацетат, который
в процессе цис- и транс-изомеризации
превращается в фумарилацетоацетат.
рансаминирование
тирозина с ос-кетоглутаратом катализирует
тирозинаминотрансфе-раза (кофермент
ПФ) - индуцируемый фермент печени
млекопитающих. В результате образуется
п-гидроксифенилпируват. В реакции
окисления п-гидроксифенилпирувата в
гомогентизиновую кислоту происходит
декарбоксилирование, гидроксилирование
ароматического кольца и миграция боковой
цепи. Реакцию катализирует фермент
п-гидроксифенилпируватдиоксигеназа,
кофакторами которого выступают витамин
С и Fe2+. Превращение гомогентизиновой
кислоты в фумарилацетоацетат сопровождается
расщеплением ароматического кольца.
Эта реакция катализируется диоксигеназой
гомогентизиновой кислоты, в качестве
кофермента содержащей Fe2+. Обмен
фенилаланина и тирозина связан со
значительным количеством реакций
гидроксилирования, которые катализируют
оксигеназы. Ферменты оксигеназы
(гидроксилазы) используют молекулу О2
и кофермент-донор водорода (чаще - Н4БП).
Для катализа оксигеназам не
обходимы
кофакторы - Fe2+ или гем (для некоторых -
Сu+), а для многих ещё и витамин С. Оксигеназы
делят на 2 группы: Монооксигеназы - один
атом О2 присоединяют к продукту реакции,
другой используют для образования Н2О;
Диоксигеназы - оба атома О2 используют
для образования продукта реакции. Почти
все процессы расщепления ароматических
колец в биологических системах
катализируются диоксигеназами. В
результате разрыва бензольного кольца
образуется малеилацетоацетат, который
в процессе цис- и транс-изомеризации
превращается в фумарилацетоацетат.
Гидролиз фумарилацетоацетата при действии фумарилацетоацетатгидролазы приводит к образованию фумарата и ацетоацетата. Фумарат может окисляться до СО2 и Н2О или использоваться для глюконеогенеза. Ацетоацетат - кетоновое тело, окисляемое до конечных продуктов с выделением энергии. Превращение тирозина в меланоцитах. В пигментных клетках (меланоцитах) тирозин выступает предшественником тёмных пигментов - меланинов. Среди них преобладают 2 типа: эумеланины и феомеланины. Эумеланины (чёрного и коричневого цвета) - нерастворимые высокомолекулярные гетерополимеры 5,6-дигидроксииндола и некоторых его предшественников. Феомеланины - жёлтые или красновато-коричневые полимеры, растворимые в разбавленных щелочах. Находятся они, в основном, в составе волос. Меланины присутствуют в сетчатке глаз. Цвет кожи зависит от распределения меланоцитов и количества в них разных типов меланинов. Первую реакцию - превращение тирозина в ДОФА - катализирует тирозиназа, использующая в качестве кофактора ионы Сu+. Превращение тирозина в щитовидной железе. В щитовидной железе синтезируются и выделяются гормоны йодтиронины: тироксин (тет-райодтиронин) и трийодтиронин. Эти гормоны представляют собой йодированные остатки тирозина, которые попадают в клетки щитовидной железы через базальную мембрану. Превращения тирозина в надпочечниках и нервной ткани (синтез катехоламинов) .В мозговом веществе надпочечников и нервной ткани тирозин является предшественником катехоламинов (дофамина, норадреналина и адреналина). При образовании катехоламинов, которое происходит в нервной ткани и надпочечниках, и меланина в меланоцитах промежуточным продуктом служит диоксифенилаланин (ДОФА) . Однако гидроксилирование тирозина в клетках различных типов катализируется различными ферментами: Тирозиназа в меланоцитах является Сu+-зависимым ферментом (см. выше). Тирозингидроксилаза (1) в надпочечниках и ка-техоламинергических нейронах не нуждается в ионах меди. Это - Fе2+-зависимый фермент, аналогично фенилаланингидроксилазе в качестве кофермента использующий Н4БП. Физиологическая роль тирозингидроксилазы чрезвычайно велика, так как этот фермент является регуляторным и определяет скорость синтеза катехоламинов.
Активность тирозингидроксилазы значительно изменяется в результате:
1. Аллостерической регуляции (ингибитор - норадреналин);
2.Фосфорилирования/дефосфорилирования: в результате фосфорилирования с участием протеинкиназы А снижаются Кm для кофермента Н4БП и сродство фермента к норадреналину, в результате чего происходит активация тирозингидроксилазы.
К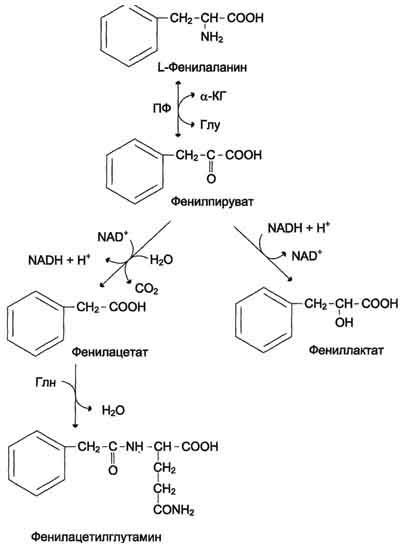 оличество
фермента регулируется на уровне
транскрипции. ДОФА-декарбоксилаза (2)
(кофермент - ПФ) катализирует образование
дофамина, который при участии
дофамингидроксилазы (3) (монооксигеназы)
превращается в норадреналин. Для
функционирования фермента необходимы
ионы Сu+, витамин С и тетрагидробиоптерин.
В мозговом веществе надпочечников
фенилэтаноламин-N-метилтрансфераза (4)
катализирует метилирование норадреналина,
в результате чего образуется адреналин.
Источником метальной группы служит
&АМ. Дофамин и норадреналин служат
медиаторами в синаптической передаче
нервных импульсов, а адреналин - гормон
широкого спектра действия, регулирующий
энергетический обмен. Одна из функций
катехоламинов - регуляция деятельности
ССС.Известно несколько наследственныхзаболеваний,
связанных с дефектом ферментов обмена
фенилаланина и тирозина в разных тканях.
Фенилкетонурия.
В печени здоровых людей небольшая часть
фенилаланина (∼10%)
превращается в фенил-лактат и
фенилацетилглутамин. Этот путь
катаболизма фенилаланина становится
главным при нарушении основного пути
- превращения в тирозин, катализируемого
фенил-аланингидроксилазой. Такое
нарушение сопровождается гиперфенилаланинемией
и повышением в крови и моче содержания
метаболитов альтернативного пути:
фенилпирувата, фенилацетата, фениллактата
и фенилацетилглу-тамина. Дефект
фенилаланингидроксилазы приводит к
заболеванию фенилкетонурия (ФКУ).
Выделяют 2 формы ФКУ: Классическая
ФКУ
- наследственное заболевание, связанное
с мутациями в гене фенилаланингидроксилазы,
которые приводят к снижению активности
фермента или полной его инактивации.
При этом концентрация фенилаланина
повышается в крови в 20-30 раз (в норме -
1,0-2,0 мг/дл), в моче - в 100-300 раз по сравнению
с нормой (30 мг/дл). Концентрация
фенилпирувата и фениллактата в моче
достигает 300-600 мг/дл при полном отсутствии
в норме. Наиболее тяжёлые проявления
ФКУ - нарушение умственного и физического
развития, судорожный синдром, нарушение
пигментации. При отсутствии лечения
больные не доживают до 30 лет. Частота
заболевания - 1:10 000 новорождённых.
Заболевание наследуется по
аутосомно-рецессивному типу. Тяжёлые
проявления ФКУ связаны с токсическим
действием на клетки мозга высоких
концентраций фенилаланина, фенилпирувата,
фениллактата. Большие конце
нтрации
фенилаланина ограничивают транспорт
тирозина и триптофана через
гематоэнцефаличеекий барьер и тормозят
синтез нейро-медиаторов (дофамина,
норадреналина, серотонина).
оличество
фермента регулируется на уровне
транскрипции. ДОФА-декарбоксилаза (2)
(кофермент - ПФ) катализирует образование
дофамина, который при участии
дофамингидроксилазы (3) (монооксигеназы)
превращается в норадреналин. Для
функционирования фермента необходимы
ионы Сu+, витамин С и тетрагидробиоптерин.
В мозговом веществе надпочечников
фенилэтаноламин-N-метилтрансфераза (4)
катализирует метилирование норадреналина,
в результате чего образуется адреналин.
Источником метальной группы служит
&АМ. Дофамин и норадреналин служат
медиаторами в синаптической передаче
нервных импульсов, а адреналин - гормон
широкого спектра действия, регулирующий
энергетический обмен. Одна из функций
катехоламинов - регуляция деятельности
ССС.Известно несколько наследственныхзаболеваний,
связанных с дефектом ферментов обмена
фенилаланина и тирозина в разных тканях.
Фенилкетонурия.
В печени здоровых людей небольшая часть
фенилаланина (∼10%)
превращается в фенил-лактат и
фенилацетилглутамин. Этот путь
катаболизма фенилаланина становится
главным при нарушении основного пути
- превращения в тирозин, катализируемого
фенил-аланингидроксилазой. Такое
нарушение сопровождается гиперфенилаланинемией
и повышением в крови и моче содержания
метаболитов альтернативного пути:
фенилпирувата, фенилацетата, фениллактата
и фенилацетилглу-тамина. Дефект
фенилаланингидроксилазы приводит к
заболеванию фенилкетонурия (ФКУ).
Выделяют 2 формы ФКУ: Классическая
ФКУ
- наследственное заболевание, связанное
с мутациями в гене фенилаланингидроксилазы,
которые приводят к снижению активности
фермента или полной его инактивации.
При этом концентрация фенилаланина
повышается в крови в 20-30 раз (в норме -
1,0-2,0 мг/дл), в моче - в 100-300 раз по сравнению
с нормой (30 мг/дл). Концентрация
фенилпирувата и фениллактата в моче
достигает 300-600 мг/дл при полном отсутствии
в норме. Наиболее тяжёлые проявления
ФКУ - нарушение умственного и физического
развития, судорожный синдром, нарушение
пигментации. При отсутствии лечения
больные не доживают до 30 лет. Частота
заболевания - 1:10 000 новорождённых.
Заболевание наследуется по
аутосомно-рецессивному типу. Тяжёлые
проявления ФКУ связаны с токсическим
действием на клетки мозга высоких
концентраций фенилаланина, фенилпирувата,
фениллактата. Большие конце
нтрации
фенилаланина ограничивают транспорт
тирозина и триптофана через
гематоэнцефаличеекий барьер и тормозят
синтез нейро-медиаторов (дофамина,
норадреналина, серотонина).
Вариантная ФКУ (коферментзависимая гиперфенилаланинемия) - следствие мутаций в генах, контролирующих метаболизм Н4БП. Клинические проявления - близкие, но не точно совпадающие с проявлениями классической ФКУ. Частота заболевания - 1-2 случая на 1 млн новорождённых. Н4БП необходим для реакций гидроксилирования не только фенилаланина, но также тирозина и триптофана, поэтому при недостатке этого кофермента нарушается метаболизм всех 3 аминокислот, в том числе и синтез ней-ромедиаторов. Заболевание характеризуется тяжёлыми неврологическими нарушениями и ранней смертью ("злокачественная" ФКУ). Прогрессирующее нарушение умственного и физического развития у детей, больных ФКУ, можно предотвратить диетой с очень низким содержанием или полным исключением фенилаланина. Если такое лечение начато сразу после рождения ребёнка, то повреждение мозга предотвращается. Считается, что ограничения в питании могут быть ослаблены после 10-летнего возраста (окончание процессов миелинизации мозга).
Некоторые нарушения катаболизма тирозина в печени приводят к тирозинемии и тирозинурии:
Тирозинемия типа 1 (тирозиноз). Причиной заболевания является, вероятно, дефект фермента фумарилацетоацетатгидролазы, катализирующего расщепление фумарилацетоа-цетата на фумарат и ацетоацетат (рис. 9-28). Накапливающиеся метаболиты снижают активность некоторых ферментов и транспортных систем аминокислот. Патофизиология этого нарушения достаточно сложна. Острая форма тирозиноза характерна для новорождённых. Клинические проявления - диарея, рвота, задержка в развитии. Без лечения дети погибают в возрасте 6-8 мес из-за развивающейся недостаточности печени. Хроническая форма характеризуется сходными, но менее выраженными симптомами. Гибель наступает в возрасте 10 лет. Содержание тирозина в крови у больных в несколько раз превышает норму. Для лечения используют диету с пониженным содержанием тирозина и фенилаланина.
Тирозинемия типа II (синдром Рихнера-Ханхорта). Причина - дефект фермента тирозина-минотрансферазы. Концентрация тирозина в крови больных повышена. Для заболевания характерны поражения глаз и кожи, умеренная умственная отсталость, нарушение координации движений.
Тирозинемия новорождённых (кратковременная). Заболевание возникает в результате снижения активности фермента п-гидроксифенилпируватдиоксигеназы, превращающего п-гидроксифенилпируват в гомогентизиновую кислоту. В результате в крови больных повышается концентрация п-гидроксифенилацетата, тирозина и фенил-аланина. При лечении назначают бедную белком диету и витамин С.
Алкаптонурия ("чёрная моча"). Причина заболевания - дефект диоксигеназы гомогентизиновой кислоты. Для этой болезни характерно выделение с мочой большого количества гомогентизиновой кислоты, которая, окисляясь кислородом воздуха, образует тёмные пигменты алкаптоны. Клиническими проявлениями болезни, кроме потемнения мочи на воздухе, являются пигментация соединительной ткани (охроноз) и артрит. Частота - 2-5 случаев на 1 млн новорождённых.
Альбинизм. Причина метаболического нарушения - врождённый дефект тирозиназы. Этот фермент катализирует превращение тирозина в ДОФА в меланоцитах. В результате дефекта тирозиназы нарушается синтез пигментов меланинов. Клиническое проявление альбинизма (от лат. albus - белый) - отсутствие пигментации кожи и волос. У больных часто снижена острота зрения, возникает светобоязнь. Длительное пребывание таких больных под открытым солнцем приводит к раку кожи. Частота заболевания 1:20 000. Нарушение синтеза катехоламинов может вызывать различные нервно-психические заболевания, причём патологические отклонения наблюдаются как при снижении, так и при увеличении их количества.
Болезнь Паркинсона. Заболевание развивается при недостаточности дофамина в чёрной субстанции мозга. Это одно из самых распространённых неврологических заболеваний (частота 1:200 среди людей старше 60 лет). При этой патологии снижена активность тирозингидроксилазы, ДОФА-декарбоксилазы. Заболевание сопровождается тремя основными симптомами: акинезия (скованность движений), ригидность (напряжение мышц), тремор (непроизвольное дрожание). Дофамин не проникает через гематоэнцефалический барьер и как лекарственный препарат не используется. Для лечения паркинсонизма предлагаются следующие принципы: *заместительная терапия препаратами-предшественниками дофамина (производными ДОФА) - леводопа, мадопар, наком и др. *подавление инактивации дофамина ингибиторами МАО (депренил, ниаламид, пиразидол и др.). Депрессивные состояния часто связаны со снижением в нервных клетках содержания дофамина и норадреналина. Гиперсекреция дофамина в височной доле мозга наблюдается при шизофрении.
Значение глицина: «+» образование гемма, переходит в серин, образует креатин, желчные кислоты, глутатион; «-» превращается в щевелеуксусную кислоту-> оксалаты(соли в почках => камни)Значение серина: из него синтезируется пируват, цистеин, сфинголипиды, фосфолипиды, 3-фосфоглоцерат-> глюкоза Значение метионина- необходим для синтеза белков, участвует в реакции дезаминирования, является источником атома серы для синтеза цистеина.
Роль реакции превращения серина в глицин состоит в образовании активной формы тетрагидрофолиевой кислоты – N5,N10-метилен-ТГФК. Одновременно данная реакция является первой на пути катаболизма серина. Несмотря на простоту строения, глицин и серин являются весьма востребованными аминокислотами в клетках. Благодаря взаимопревращению перечень возможных путей метаболизма этих аминокислот еще больше расширяется.
О
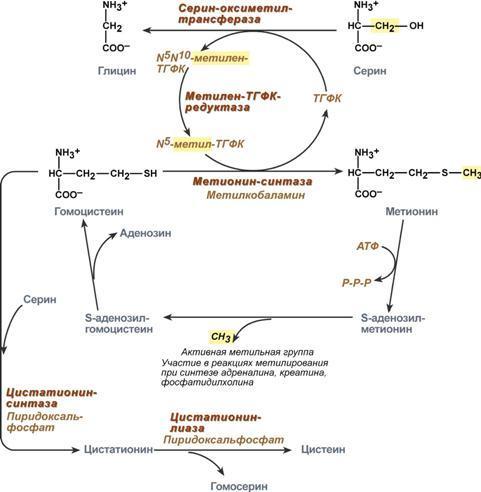
 бразованный
в реакции распада серина до глицина
N5,N10-метилен-ТГФК при участии фермента
метилен-ТГФК-редуктазы превращается в
N5-метил-ТГФК. Ее метильный остаток
участвует в метионин-синтазной реакции
реметилирования гомоцистеина в метионин.
В печени, кроме метил-ТГФК, источником
метильной группы может быть вещество
бетаин (триметилглицин).Метионин
впоследствии присоединяет аденозильный
остаток и превращается в активную форму
метионина – S-аденозилметионин,
участвующий во многих реакциях
метилирования, в частности, при синтезе
креатина, карнитина, фосфатидилхолина,
адреналина. В результате перемещения
метильной группы и отщепления аденозина
остается гомоцистеин, имеющий два пути
метаболизма:Первый путь превращений
гомоцистеина – реметилирование до
метионина и вновь участие в реакциях
метилирования и синтезе веществ. Второй
путь – взаимодействие с серином при
участии цистатионин-синтазы, превращение
в цистатионин с последующим распадом
в цистеин и гомосерин.
бразованный
в реакции распада серина до глицина
N5,N10-метилен-ТГФК при участии фермента
метилен-ТГФК-редуктазы превращается в
N5-метил-ТГФК. Ее метильный остаток
участвует в метионин-синтазной реакции
реметилирования гомоцистеина в метионин.
В печени, кроме метил-ТГФК, источником
метильной группы может быть вещество
бетаин (триметилглицин).Метионин
впоследствии присоединяет аденозильный
остаток и превращается в активную форму
метионина – S-аденозилметионин,
участвующий во многих реакциях
метилирования, в частности, при синтезе
креатина, карнитина, фосфатидилхолина,
адреналина. В результате перемещения
метильной группы и отщепления аденозина
остается гомоцистеин, имеющий два пути
метаболизма:Первый путь превращений
гомоцистеина – реметилирование до
метионина и вновь участие в реакциях
метилирования и синтезе веществ. Второй
путь – взаимодействие с серином при
участии цистатионин-синтазы, превращение
в цистатионин с последующим распадом
в цистеин и гомосерин.
3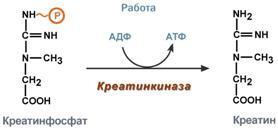 4.
Синтез креатина: последовательность
реакций, значение креатинфосфата.
Физиологическая креатинурия. Значение
креатинкиназы и креатинина в диагностике.
4.
Синтез креатина: последовательность
реакций, значение креатинфосфата.
Физиологическая креатинурия. Значение
креатинкиназы и креатинина в диагностике.
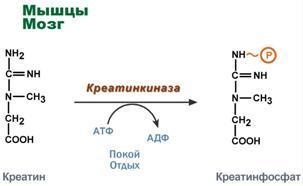
Креатин – вещество скелетных мышц, миокарда, нервной ткани. В виде креатинфосфата креатин является "депо" макроэргических связей, используется для быстрого ресинтеза АТФ во время работы клетки.
О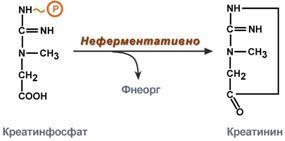
 собенно
показательна роль креатина в мышечной
ткани. Креатинфосфат обеспечивает
ресинтез АТФ в первые секунды работы
(5‑10
сек), когда ни анаэробный гликолиз, ни
аэробное окисление глюкозы и жирных
кислот еще не активировано, и кровоснабжение
мышцы не увеличено. В клетках нервной
ткани креатинфосфат поддерживает
жизнеспособность клеток при отсутствии
кислорода. При мышечной работе ионы
Са2+, высвободившиеся из саркоплазматического
ретикулума, являются активаторами
креатинкиназы. Реакция еще интересна
тем, что на ее примере можно наблюдать
обратную положительную связь — активацию
фермента продуктом реакции креатином.
Это позволяет избежать снижения скорости
реакции по ходу работы, которое должно
было бы произойти по закону действующих
масс из-за снижения концентрации
креатинфосфата в работающих мышцах.
Около 3% креатинфосфата постоянно в
реакции неферментативного дефосфорилирования
превращается в креатинин. Количество
креатинина, выделяемое здоровым человеком
в сутки, всегда почти одинаково и зависит
только от объема мышечной массы.
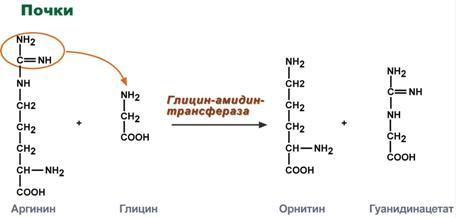
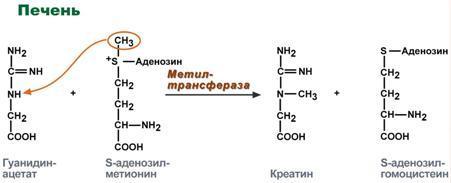
Синтез креатина
идет последовательно в почках и печени
в двух трансферазных реакциях. По
окончании синтеза креатин с током крови
доставляется в мышцы или мозг. Здесь
при наличии энергии АТФ (во время покоя
или отдыха) он фосфорилируется с
образованием креатинфосфата,который
после дефосфорилирования (необратимая
реакция) превращается в креатинин,
выделяющийся с мочой.
собенно
показательна роль креатина в мышечной
ткани. Креатинфосфат обеспечивает
ресинтез АТФ в первые секунды работы
(5‑10
сек), когда ни анаэробный гликолиз, ни
аэробное окисление глюкозы и жирных
кислот еще не активировано, и кровоснабжение
мышцы не увеличено. В клетках нервной
ткани креатинфосфат поддерживает
жизнеспособность клеток при отсутствии
кислорода. При мышечной работе ионы
Са2+, высвободившиеся из саркоплазматического
ретикулума, являются активаторами
креатинкиназы. Реакция еще интересна
тем, что на ее примере можно наблюдать
обратную положительную связь — активацию
фермента продуктом реакции креатином.
Это позволяет избежать снижения скорости
реакции по ходу работы, которое должно
было бы произойти по закону действующих
масс из-за снижения концентрации
креатинфосфата в работающих мышцах.
Около 3% креатинфосфата постоянно в
реакции неферментативного дефосфорилирования
превращается в креатинин. Количество
креатинина, выделяемое здоровым человеком
в сутки, всегда почти одинаково и зависит
только от объема мышечной массы.
Синтез креатина
идет последовательно в почках и печени
в двух трансферазных реакциях. По
окончании синтеза креатин с током крови
доставляется в мышцы или мозг. Здесь
при наличии энергии АТФ (во время покоя
или отдыха) он фосфорилируется с
образованием креатинфосфата,который
после дефосфорилирования (необратимая
реакция) превращается в креатинин,
выделяющийся с мочой.
Е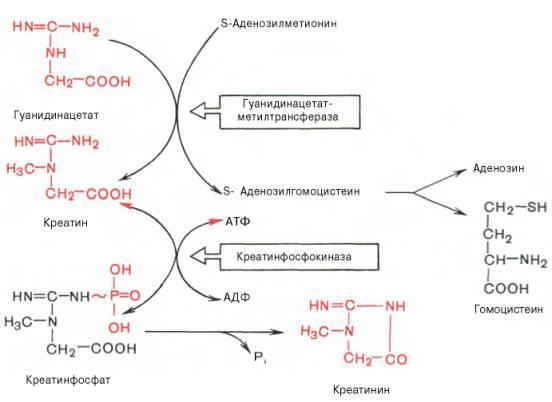 сли
синтез креатина опережает возможности
его фиксации в мышечной ткани, то
развиваетсякреатинурия
– появление креатина в моче. Физиологическая
креатинурия
наблюдается в первые годы жизни ребенка.
Иногда к физиологической относят и
креатинурию стариков, которая возникает
как следствие атрофии мышц и неполного
использования образующегося в печени
креатина. При заболеваниях мышечной
системы (при миопатии или прогрессирующей
мышечной дистрофии) в моче наблюдаются
наибольшие концентрации креатина –
патологическая
креатинурия.
сли
синтез креатина опережает возможности
его фиксации в мышечной ткани, то
развиваетсякреатинурия
– появление креатина в моче. Физиологическая
креатинурия
наблюдается в первые годы жизни ребенка.
Иногда к физиологической относят и
креатинурию стариков, которая возникает
как следствие атрофии мышц и неполного
использования образующегося в печени
креатина. При заболеваниях мышечной
системы (при миопатии или прогрессирующей
мышечной дистрофии) в моче наблюдаются
наибольшие концентрации креатина –
патологическая
креатинурия.
Креатинин является конечным продуктом азотистого обмена. Образуется в мышечной ткани из креатинфосфата. Креатинин попадает в мочу преимущественно путем клубочковой фильтрации и в крайне небольшом количестве за счет активной канальцевой секреции.
Норма: мужчины 7,1-17,7 ммоль/сут, женщины 5,3‑15,9 Клинико‑диагностическое значение. Выводимое количество мало зависит от содержания белков в диете, а связано с объемом мышечной ткани и ее активностью.
Увеличение концентрации креатинина может быть связано с повышенной физической активностью, с лихорадочными состояниями, отмечается при выраженной недостаточности функции печени, при сахарном диабете, инфекциях. Снижение обнаруживается при голодании, у больных с мышечной атрофией, с дегенерацией и амилоидозом почек, лейкемией.
Креатин образуется в последовательных реакциях в почках и печени и далее доставляется в скелетные мышцы, миокард и нервную ткань. Здесь он фосфорилируется и выполняет роль резервного макроэрга.
В норме в моче нет. Клинико‑диагностическое значение. В первые годы жизни ребенка возможна физиологическая креатинурия, что объясняется его усиленным синтезом, опережающим рост мускулатуры. Креатинурия возможна и в пожилом возрасте как следствие атрофии мышц и снижения использования образующегося в печени креатина. У взрослых увеличение содержания креатина в крови свыше 0,12 ммоль/л сопровождается появлением его в моче. Выделение креатина возрастает при беременности и в раннем послеродовом периоде. Накопление в моче отмечается при поражениях мышечной системы (миопатии, мышечная дистрофия), при сахарном диабете, эндокринных расстройствах (гипертиреоз, аддисонова болезнь, акромегалия), инфекционных заболеваниях, системной красной волчанке, переломах костей, ожогах, белковом голодании, недостатке витамина Е.
Креатинфосфокиназа (Креатинкиназа), магнийзависимый фермент, содержится исключительно в цитоплазме и митохондриях миокарда, скелетной мускулатуры и ткани мозга, где катализирует реакцию: Креатин + АТФ АДФ + Креатинфосфат
Равновесие реакции при щелочных значениях pH сдвинуто в сторону образования АТФ.
Высокая активность фермента обнаружена в мышечной и нервной ткани, в которых значительная часть энергии переносится между клеточными компартментами в виде креатинфосфата. Среди различных типов мышечной ткани активность КФК распределяется следующим образом: поперечно‑полосатые мышцы > сердечные мышцы > мышцы беременной матки > мышцы матки > гладкие мышцы.
Фермент является гетерогенным белком, состоящим из 2‑х типов субъединиц — В и М. В связи с этим выделяют три изофермента: ММ (содержится в скелетной мускулатуре и миокарде), ВВ (преимущественно в мозге и гладких мышцах) и МВ (в сердечной мышце). Изоферменты различаются по физико‑химическим и иммунологическим свойствам.
Наиболее широкое применение исследование активности КФК нашло при диагностике инфаркта миокарда: активность фермента возрастает уже через 2‑3 часа после поражения миокарда и через 14‑30 часов достигает максимума, нормализация показателей наступает обычно на вторые-третьи сутки после приступа, длительное удерживание гиперэнзимемии наблюдается у больных с выраженным нарушением коронарного кровообращения. Кроме инфаркта, увеличение активности фермента в сыворотке стимулируют миокардиты, сердечная недостаточнсть, сердечные аритмии, при этом отмечается 20‑30‑кратное превышение нормальных показателей. Увеличение идет в основном за счет MB‑фракции КФК. Значительно более высокая активность КФК обнаруживается при заболеваниях мышечной системы, прежде всего миогенного происхождения (полиомиелит, мышечная дистрофия, дерматомиозит). При прогрессирующей мышечной дистрофии (миопатии) увеличение активности КФК отмечается уже в первые стадии болезни. В конечной стадии, вследствие замещения мышечной ткани на соединительную и жировую, активность фермента приходит в норму. Подъем активности может наблюдаться при травматическом повреждении ткани мозга, инфаркте мозга, менингите, гипотиреозе, отравлениях снотворными, кровоизлияниях в мозг. Снижение активности не имеет практического значение, отражая либо малую мышечную массу, либо сидячий образ жизни.
35. Нуклеозиды, нуклеотиды и нуклеиновые кислоты, строение, значение. Отличия ДНК и РНК. Нуклеопротеиды. Переваривание нуклеопротеидов.
Нуклеиновые кислоты — высокомолекулярные соединения со строго определенной линейной последовательностью мономеров (мононуклеотидов), носители генетической информации обо всех белках, работающих в организме. В каждом живом организме присутствуют 2 типа нуклеиновых кислот: рибонуклеиновая кислота (РНК) и дезоксирибонуклеиновая кислота (ДНК). В состав нуклеиновых кислот входят азотистые основания двух типов: пуриновые - аденин (А), гуанин (G) и пиримидиновые - цитозин (С), тимин (Т) и урацил (U). Пентозы в нуклеотидах представлены либо рибозой (в составе РНК), либо дезоксирибозой (в составе ДНК). Пентозу соединяет с основанием N-гликозидная связь, образованная С1-атомом пентозы (рибозы или дезоксирибозы) и N1 -атомом пиримидина или N9-aтомом пурина.
Нуклеозиды — это гликозиламины, содержащие азотистое основание, связанное с сахаром (рибозой или дезоксирибозой).
Нуклеоти́ды — фосфорные эфиры нуклеозидов, нуклеозидфосфаты. Мономерные единицы из которых состоит ДНК и РНК. Свободные нуклеотиды, в частности АТФ, цАМФ, АДФ, играют важную роль в энергетических и информационных внутриклеточных процессах, а также являются составляющими частями нуклеиновых кислот и многих коферментов.
Нуклеиновые кислоты по своему строению относят к классу линейных полимеров. Остов нуклеиновой кислоты имеет одинаковое строение по всей длине молекулы и состоит из чередующихся групп - пентоза-фосфат-пентоза- . Вариабельными группами в полинуклеотидных цепях служат азотистые основания - пурины и пиримидины. В РНК входят (А), (U), (G) и (С), в ДНК - (А), (Т), (G) и (С).
Первичная структура ДНК - порядок чередования дезоксирибонуклеозидмонофосфатов (дНМФ) в полинукпеотидной цепи. Каждая фосфатная группа в полинукпеотидной цепи, за исключением фосфорного остатка на 5'-конце молекулы, участвует в образовании двух эфирных связей с участием 3'- и 5'-углеродных атомов двух соседних дезоксирибоз, поэтому связь между мономерами обозначают 3', 5'-фосфодиэфирной. Концевые нуклеотиды ДНК различают по структуре: на 5'-конце находится фосфатная группа, а на 3'-конце цепи - свободная ОН-группа. Эти концы называют 5'- и 3'-концами. Азотистые основания почти нерастворимы в воде, но некоторые атомы пуринового и пиримидинового циклов способны образовывать водородные связи. Вторичная структура - Двойная спираль правозакрученная, полинуклеотидньхе цепи в ней антипараллельны. Все основания цепей ДНК расположены внутри двойной спирали, а пентозофосфатный остов - снаружи. Полинуклеотидные цепи удерживаются относительно друг друга за счёт водородных связей между комплементарными пуриновыми и пиримидиновыми азотистыми основаниями А и Т (две связи) и между G и С (три связи). Правило Чаргаффа: « число пуриновых оснований (А + G) равно числу пиримидиновых оснований (Т + С)».
Комплементарые основания уложены в стопку в сердцевине спирали. Между основаниями двухцепочечной молекулы в стопке возникают гидрофобные взаимодействия, стабилизирующие двойную спираль. В образованной структуре различают две бороздки – большую и малую. Азотистые основания в их области взаимодействуют со специфическими белками, участвующими в организации структуры хроматина. Нуклеопротеиды — комплексы нуклеиновых кислот с белками., а хроматин относятся как раз к этим комплексам (Кроме этого разнообразные вирусные нуклеопротеиды). Каждая молекула ДНК упакована в отдельную хромосому. Компактизация и суперспирализация ДНК осуществляются с помощью гистоновых белков. Гистоны - белки содержащие много остатков аргинина и лизина. Благодаря положительному заряду гистоны образуют ионные связи с отрицательно заряженными фосфатными группами, расположенными на внешней стороне двойной спирали ДНК. Молекула ДНК "накручивается" на поверхность гистонового октамера. акой комплекс гистоновых белков с ДНК служит основной структурной единицей хроматина, её называют "нуклеосома".
Первичная структура РНК - порядок чередования рибонуклеозидмонофосфатов (НМФ) в полинуклеотидной цепи. В РНК, как и в ДНК, нук-леотиды связаны между собой 3',5'-фосфодиэфирными связями. Концы полинуклеотидных цепей РНК неодинаковы. На одном конце находится фосфорилированная ОН-группа 5'-углеродного атома, на другом конце - ОН-группа 3'-углеродного атома рибозы, поэтому концы называют 5'- и 3'-концами цепи РНК. Гидроксильная группа у 2'-углеродного атома рибозы делает молекулу РНК нестабильной. Так, в слабощелочной среде молекулы РНК гидролизуются даже при нормальной температуре, тогда как структура цепи ДНК не изменяется. Вторичная структура РНК - Молекула рибонуклеиновой кислоты построена из одной полинуклеотидной цепи. Отдельные участки цепи РНК образуют спирализованные петли - "шпильки", за счёт водородных связей между комплементарными азотистыми основаниями A-U и G-C. Участки цепи РНК в таких спиральных структурах антипараллельны, но не всегда полностью комплементарны, в них встречаются неспаренные нуклеотидные остатки или даже одноцепочечные петли, не вписывающиеся в двойную спираль. Наличие спирализованных участков характерно для всех типов РНК. Одноцепочечные РНК характеризуются компактной и упорядоченной третичной структурой, возникающей путём взаимодействия спирализованных элементов вторичной структуры. Так, возможно образование дополнительных водородных связей между нуклеотидными остатками, достаточно удалёнными друг от друга, или связей между ОН-группами остатков рибо-зы и основаниями. Третичная структура РНК стабилизирована ионами двухвалентных металлов, например ионами Mg2+, связывающимися не только с фосфатными группами, но и с основаниями. В цитоплазме клеток присутствуют 3 типа рибонуклеиновых кислот - транспортные РНК (тРНК), матричные РНК (мРНК) и рибосомальные РНК (рРНК). Они различаются по первичной структуре, молекулярной массе, конфор-мации, продолжительности жизни и, самое главное, по функциональной активности.
Отличия РНК и ДНК.1)Молекулярная масса РНК 25кД, ДНК от 1000 до 1000000 кД. 2)Моносахарид (пентоза) в РНК представлен рибозой, в ДНК дезоксирибозой. 3)Азотистые основания в РНК- аденин, урацил, гуанин, цитозин; в ДНК- аденин, Тимин, гуанин, цитозин. 4)Первичная структура РНК нестабильна, в отличии от ДНК, т.к. имеет гидроксильную группу у 2`- углеводного атома рибозы. Переваривание нуклеопротеидов. Нуклеиновый компонент отделяется от белка в кислой среде желудка. Катаболизм нуклеиновых кислот начинается с гидролиза 3',5'-фосфодиэфирной связи под действием ферментов нуклеаз. 1. ДНКазы - расщепляют ДНК. 2. РНКазы - расщепляют РНК.
Среди ДНКаз и РНКаз различают: 1) экзонуклеазы (5' и 3'); 2) эндонуклеазы - специфичны к мононуклеотидной последовательности, есть высокоспецифичные: рестриктазы - используются в генной инженерии. Далее происходит отщепление фосфата от мононуклеотида с участием ферментов нуклеотидаз с образованием нуклеозидов. Нуклеозид может расщепляться путем гидролиза под действием фермента нуклеозидазы на азотистое основание и пентозу, но чаще происходит фосфоролиз - при этом нуклеозид расщепляется на азотистое основание и фосфорибозу. Продукты гидролиза полинуклеотидов — мононуклеотиды под действием нуклеотидаз и нуклеозидаз расщепляются на азотистые основания, пентозы (рибоза или дезоксирибоза) и фосфорную кислоту, которые всасываются.
Нуклеазы очень многообразны. Различают ДНКазы и РНКазы. Отличаются друг от друга по месту действия. Бывают эндонуклеазы (расщепляют внутренние 3'5'-фосфодиэфирные связи) и экзонуклеазы (отщепляют концевые мононуклеотиды). Встречается 2 типа экзонуклеаз: 3'-экзонуклеазы - отщепляют мононуклеотид с 3'-конца молекулы, и 5'-экзонуклеазы - отщепляют 5'-концевой мононуклеотид.
Нуклеазы могут отличаться друг от друга и по специфичности. Пищеварительные нуклеазы и нуклеазы лизосомальные отличаются низкой специфичностью, у них упрощенное строение активного центра. У высокоспецифичных нуклеаз очень сложное строение активного центра. Они способны "узнавать" целую последовательность нуклеотидов из 4-10 пар и расщеплять одну-единственную связь в строго определенном месте. Такие высокоспецифичные ДНКазы называются рестриктазами. Участки ДНК, "узнаваемые" рестриктазами, называются полиндромными последовательностями.
Пентозы, образующиеся в ходе катаболизма нуклеиновых кислот, могут быть утилизированы во II-м этапе ГМФ-пути. Азотистые основания также подвергаются дальнейшему катаболизму, но по-разному, в зависимости от их типа - пуриновых (аденина, гуанина) или пиримидиновых (тимина, цитозина и урацила).
36. Катаболизм пуриновых и пиримидиновых оснований. Гиперурикемия. Подагра.
Катаболизм пуриновых оснований. Распад начинается с отщепления. От АМФ и аденозина аминогруппа удаляется гидролитически аденозиндезаминазой с образованием ИМФ или инозина. ИМФ и ГМФ превращаются в соответствующие нуклеозиды: инозин и гуанозин под действием 5´-нуклеотидазы. Пуриннуклеозидфосфорилаза катализирует расщепление N-гликозидной связи в инозине и гуанозине с образованием рибозо-1-фосфата и азотистых оснований: гуанина и гипоксантина. Гуанин дезаминируется и превращается в ксантин, а гипоксантин окисляется в ксантин с помощью ксантиноксидазы, которая катализирует и дальнейшее окисление ксантина в мочевую кислоту. Образовавшийся инозин подвергается фосфоролизу, и далее гипоксантин подвергается двукратному окислению путем отнятия водорода с одновременным присоединением воды. Эти две одинаковые реакции катализирует один и тот же фермент - ксантиноксидаза. Ксантиноксидаза - аэробная оксидоредуктаза.Она может существовать в двух формах:1) D-форма - дегидрогеназная; 2) O-форма - оксидазная. Формы отличаются друг от друга по способности передавать 2 атома водорода. D-форма передает водород на главную дыхательную цепь митохондриального окисления, а O-форма - сразу на кислород с образованием H2O2. D-форма может переходить в О-форму путем ограниченного протеолиза при отщеплении небольшого участка молекулы.
Образование мочевой кислоты происходит главным образом в печени. Мочевая кислота — основной продукт катаболизма пуриновых нуклеотидов у человека. В организме ежесуточно обра¬зуется 0,5 — 1 г мочевой кислоты, которая выводится через почки. Мочевая кислота плохо растворима в воде и жидких средах организма. В норме ее концентрация на пределе растворимости и составляет 0,1 — 0,4 ммоль/л. Если концентрация мочевой кислоты становится выше нормальной, происходит отложение ее солей (уратов) в суставах и почках. Повышение концентрации мочевой кислоты в крови называется гиперурикемией. Однако повышенное содержание мочевой кислоты в крови (гиперурикемия) небезопасно. Сама мочевая кислота и, особенно, ее соли ураты (натриевые соли мочевой кислоты) плохо растворимы в воде. Даже при незначительном повышении концентрации они начинают начинают выпадать в осадок и кристаллизоваться, образуя камни. Кристаллы воспринимаются организмом как чужеродный объект. В суставах они фагоцитируются макрофагами, сами клетки при этом разрушаются, из них освобождаются гидролитические ферменты. Это приводит к воспалительной реакции, сопровождающейся сильнейшими болями в суставах. Такое заболевание называется подагра. Другое заболевание, при котором кристаллы уратов откладываются в почечной лоханке или в мочевом пузыре, известно как мочекаменная болезнь. Классическая подагра обусловлена тремя факторами — увеличенным синтезом мочевой кислоты, снижением содер¬жания в плазме уратсвязывающего белка и замедленным выведением с мочой. Клинические проявления подагры: 1 Повторяющиеся приступы острого воспаления суставов, чаще всего мелких (подагрический криз); обычно болезнь начинается с воспаления первого плюснефалангового сустава большого пальца ноги. Подагрический криз связан с отложением кристаллов мононатриевой соли мочевой кислоты в суставе. 2. Подагрические узлы (тофусы), возникают в результате местного отложения и накопления уратов; локализация — мелкие суставы, сухожилия, хрящи, кожа. Для лечения подагры применяются: 1) ингибиторы фермента ксантиноксидазы. Например, аллопуринол - вещество пуриновой природы, является конкурентным ингибитором фермента. Действие этого препарата приводит к повышению концентрации гипоксантина. Гипоксантин и его соли лучше растворимы в воде, и легче выводятся из организма.2) диетическое питание, исключающее продукты, богатые нуклеиновыми кислотами, пуринами и их аналогами: икра рыб, печень, мясо, кофе и чай. 3) соли лития, поскольку они лучше растворимы в воде, чем ураты натрия.
Катаболизм пиримидиновых нуклеотидов. Превращения пиримидиновых оснований в результате деза-минирования и декарбоксилирования идет до (3-аланина, угле¬кислого газа, аммиака и (3-аминоизомасляной кислоты. Пиримидиновые основания при участии дигидропиримидиндегидрогеназы присоединяют 2 атома водорода по двойной связи кольца с образованием дигидроурацила или дигидротимина. Оба гетероцикла могут взаимодействовать с водой в реакции, катализируемой дигидропиримидинциклогидролазой, и дигидроурацил превращается в β-уреидопропионовую кислоту, а дигидротимин - в β-уреидоизомасляную кислоту. Оба β-уреидопроизводных под действием общего для них фермента уреидопропионазы расщепляются с образованием СО2, NH4+ и β-аланина или β-аминоизомасляной кислоты соответственно. β-Аланин обнаруживают в плазме крови и многих тканях. Он используется в мышцах на образование дипептидов: карнозина и анзерина. Под действием бактериальной микрофлоры кишечника β-аланин включается в пантотеновую кислоту, которая всасывается и используется на образование КоА. Часть β-аланина и β-аминбутирата трансами-нируется с α-кетоглутаратом и даёт малонил полуальдегид или метилмалонил полуальдегид соответственно, которые превращаются в малонил-КоА и сукцинил-КоА и используются в соответствующих метаболических путях, либо окисляются до СО2 и Н2О. Частично β-аминобутират экскретируется с мочой.
37. Биосинтез пуриновых и пиримидиновых нуклеотидов. Биосинтез дезоксирибонуклеотидов. Регуляция этих процессов.
Синтез пуриновых оснований происходит во всех клетках организма, главным образом в печени. Исключение составляют эритроциты, полиморфноядерные лейкоциты, лимфоциты.
Условно все реакции синтеза можно разделить на 4 этапа:
1 .
Синтез 5'-фосфорибозиламина
.
Синтез 5'-фосфорибозиламина
Первая реакция синтеза пуринов заключается в активации углерода в положении С1 рибозо-5-фосфата, это достигается синтезом 5-фосфорибозил-1-дифосфата (ФРДФ). Рибозо-5-фосфат является тем якорем, на основе которого синтезируется сложный пуриновый цикл.
Вторая реакция – это перенос NH2-группы глутамина на активированный атом С1 рибозо-5-фосфата с образованием 5'-фосфорибозиламина. Указанная NH2-группа фосфорибозиламина уже принадлежит будущему пуриновому кольцу и ее азот будет атомом номер 9.
Параллельно фофорибозилдифосфат используется при синтезе пиримидиновых нуклеотидов. Он реагирует с оротовой кислотой и рибозо-5-фосфат связывается с ней, образуя оротидилмонофосфат (реакция).
2. Синтез инозинмонофосфата
5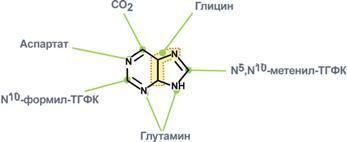
 -фосфорибозиламин
вовлекается в девять реакций, и в
результате образуется первый пуриновый
нуклеотид – инозинмонофосфорная кислота
(ИМФ). В этих реакциях источниками атомов
пуринового кольца являются глицин,
аспартат, еще одна молекула глутамина,
углекислый газ и производные
тетрагидрофолиевой кислоты (ТГФК). В
целом на синтез пуринового кольца
затрачивается энергия 6 молекул АТФ.
-фосфорибозиламин
вовлекается в девять реакций, и в
результате образуется первый пуриновый
нуклеотид – инозинмонофосфорная кислота
(ИМФ). В этих реакциях источниками атомов
пуринового кольца являются глицин,
аспартат, еще одна молекула глутамина,
углекислый газ и производные
тетрагидрофолиевой кислоты (ТГФК). В
целом на синтез пуринового кольца
затрачивается энергия 6 молекул АТФ.
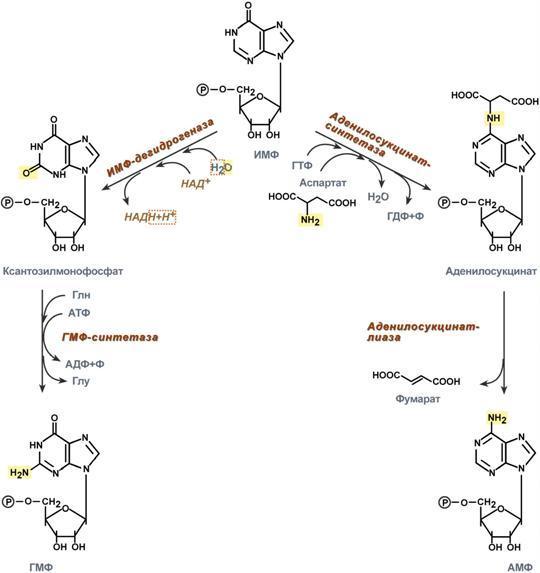
3. Синтез аденозинмонофосфата и гуанозинмонофосфата
а) Гуанозинмонофосфат (ГМФ) образуется в двух реакциях – сначала он окисляется ИМФ-дегидрогеназой до ксантозилмонофосфата, источником кислорода является вода, акцептором водорода – НАД. После этого работает ГМФ-синтетаза, она использует универсальный клеточный донор NH2-групп – глутамин, источником энергии для реакции служит АТФ.
б) Аденозинмонофосфат (АМФ) также образуется в двух реакциях, но в качестве донора NH2-группы выступает аспарагиновая кислота. В первой, аденилосукцинат-синтетазной, реакции на присоединение аспартата используется энергия распада ГТФ, во второй реакции аденилосукцинат-лиаза производит удаление части аспарагиновой кислоты в виде фумарата.
4. Образование нуклеозидтрифосфатов АТФ и ГТФ.
С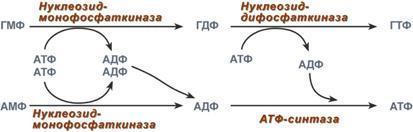 интез
ГТФ осуществляется в 2 стадии посредством
переноса макроэргических фосфатных
групп от АТФ. Синтез АТФ происходит
несколько иначе. АДФ из АМФ образуется
также за счет макроэргических связей
АТФ. Для синтеза же АТФ из АДФ в митохондриях
есть фермент АТФ-синтаза, образующий
АТФ в реакциях окислительного
фосфорилирования.
интез
ГТФ осуществляется в 2 стадии посредством
переноса макроэргических фосфатных
групп от АТФ. Синтез АТФ происходит
несколько иначе. АДФ из АМФ образуется
также за счет макроэргических связей
АТФ. Для синтеза же АТФ из АДФ в митохондриях
есть фермент АТФ-синтаза, образующий
АТФ в реакциях окислительного
фосфорилирования.
В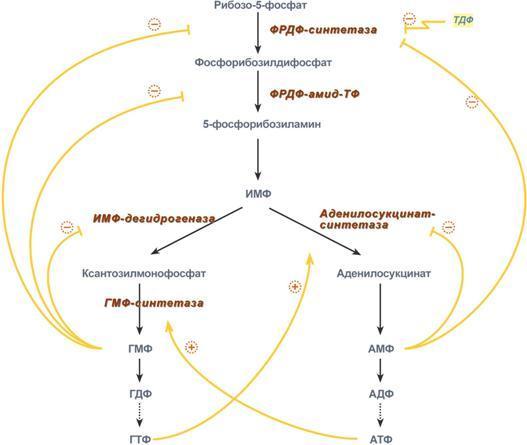 нутриклеточная
регуляция:
Регуляция синтеза пуринов (пуриновых
нуклеотидов) происходит по механизму
обратной отрицательной связи, т.е.
продукт реакции (или совокупности
реакций) ингибирует начальные этапы
процесса. Для синтеза пуринов такими
ингибиторами являются АМФ и ГМФ. ГМФ
блокирует первые две реакции синтеза
ИМФ, а также ИМФ-дегидрогеназную реакцию.
АМФ блокирует первую реакцию синтеза
ИМФ и аденилосукцинатсинтетазную
реакцию. Кроме этого, имеется положительная
перекрестная регуляция со стороны АТФ
и ГТФ, а именно – как участник реакций
каждый из них оказывает стимулирующее
влияние на синтез другого нуклеотида.
Это заключается в том, что АТФ, принимая
участие в ГМФ-синтетазной реакции,
облегчает синтез ГМФ. В свою очередь,
ГТФ является донором энергии для синтеза
АМФ, участвуя в аденилосукцинат-синтетазной
реакции. Пиримидиновый нуклеотид
тимидиндифосфат (ТДФ) также блокирует
фермент ФРДФ-синтетазу, что снижает
синтез ФРДФ, который используется при
синтезе пуринов и пиримидинов.
Лекарственная
регуляция.
При разработке новых противоопухолевых
средств были предложены ингибиторы
ферментов: ФРДФ-амидтрансфераза
(азосерин, диазонорлейцин), ИМФ-дегидрогеназа
(микофеноловая кислота, 6-‑меркаптопурин),
аденилосукцинат-лиаза (6-меркаптопурин).
нутриклеточная
регуляция:
Регуляция синтеза пуринов (пуриновых
нуклеотидов) происходит по механизму
обратной отрицательной связи, т.е.
продукт реакции (или совокупности
реакций) ингибирует начальные этапы
процесса. Для синтеза пуринов такими
ингибиторами являются АМФ и ГМФ. ГМФ
блокирует первые две реакции синтеза
ИМФ, а также ИМФ-дегидрогеназную реакцию.
АМФ блокирует первую реакцию синтеза
ИМФ и аденилосукцинатсинтетазную
реакцию. Кроме этого, имеется положительная
перекрестная регуляция со стороны АТФ
и ГТФ, а именно – как участник реакций
каждый из них оказывает стимулирующее
влияние на синтез другого нуклеотида.
Это заключается в том, что АТФ, принимая
участие в ГМФ-синтетазной реакции,
облегчает синтез ГМФ. В свою очередь,
ГТФ является донором энергии для синтеза
АМФ, участвуя в аденилосукцинат-синтетазной
реакции. Пиримидиновый нуклеотид
тимидиндифосфат (ТДФ) также блокирует
фермент ФРДФ-синтетазу, что снижает
синтез ФРДФ, который используется при
синтезе пуринов и пиримидинов.
Лекарственная
регуляция.
При разработке новых противоопухолевых
средств были предложены ингибиторы
ферментов: ФРДФ-амидтрансфераза
(азосерин, диазонорлейцин), ИМФ-дегидрогеназа
(микофеноловая кислота, 6-‑меркаптопурин),
аденилосукцинат-лиаза (6-меркаптопурин).
Синтез пиримидиновых оснований происходит во всех клетках организма. В реакциях синтеза участвует аспарагиновая кислота, глутамин, СО2, затрачивается 2 молекулы АТФ. В отличие от разветвленного синтеза пуринов этот синтез происходит линейно, т.е. пиримидиновые нуклеотиды образуются последовательно, друг за другом.Условно можно выделить 3 общих этапа синтеза и реакции синтеза УТФ и ЦТФ:
1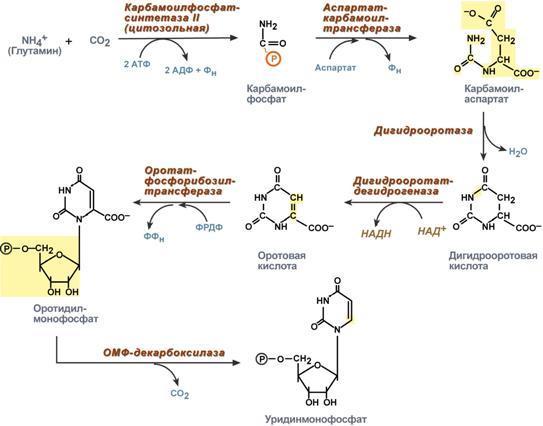 .
Образование карбамоилфосфата.
Образование карбамоилфосфата в отличие
от синтеза мочевины происходит в цитозоле
большинства клеток организма.
.
Образование карбамоилфосфата.
Образование карбамоилфосфата в отличие
от синтеза мочевины происходит в цитозоле
большинства клеток организма.
2. Образование пиримидинового кольца. Формирование пиримидинового кольца происходит после присоединения аспартата и реакций дегидратации и окисления. Первым пиримидиновым основанием является оротовая кислота.
3. Синтез оротидинмонофосфата и уридинмонофосфорной кислоты. В реакции с фосфорибозилдифосфатом (ФРДФ) к оротовой кислоте присоединяется рибозо-5-фосфат и образуется оротидилмонофосфат, при декарбоксилировании превращающийся в уридинмонофосфат (УМФ).
И![]() сточником
фосфорибозилдифосфата является первая
из двух реакций синтеза фосфорибозиламина
при образовании пуринов.
сточником
фосфорибозилдифосфата является первая
из двух реакций синтеза фосфорибозиламина
при образовании пуринов.
4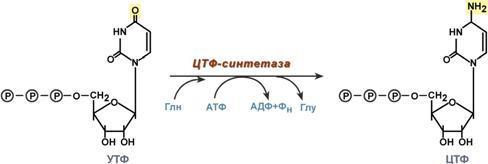 .
Синтез уридинтрифосфата.
Синтез УТФ осуществляется из УМФ в 2
стадии посредством переноса макроэргических
фосфатных групп от АТФ.
.
Синтез уридинтрифосфата.
Синтез УТФ осуществляется из УМФ в 2
стадии посредством переноса макроэргических
фосфатных групп от АТФ.
5. Синтез цитидинтрифосфата. Образование цитидинтрифосфата (ЦТФ) происходит из УТФ с затратой энергии АТФ при участии глутамина, являющегося донором NH2-группы.
Физиологическая
регуляция.
Регуляция синтеза пиримидинов
(пиримидиновых нуклеотидов) происходит
по механизму обратной отрицательной
связи, т.е. продукт реакции (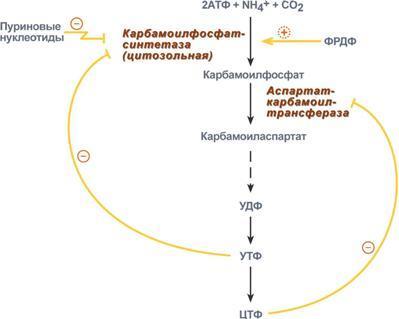 совокупности
реакций) ингибирует начальные этапы
процесса. Для синтеза пиримидинов такими
ингибиторами являются УТФ и ЦТФ. ЦТФ
ингибирует аспартаткарбамоилтрансферазу,
УТФ – карбамоилфосфатсинтетазу.
Одновременно синтез пиримидинов
отрицательно регулируется также
пуриновыми нуклеотидами АМФ и ГМФ.
Тимидилатдифосфат (ТДФ), в свою очередь,
блокирует синтез ФРДФ , который
используется как при синтезе пиримидинов,
так и при синтезе пуринов.Лекарственная
регуляция.
Исключительная роль тимидилатсинтазы
и фолиевой кислоты в синтезе ТМФ
обусловила поиск и использование
ингибиторов этой реакции для прекращения
синтеза тимидилового нуклеотида и, как
следствие, блока синтеза ДНК, что нашло
применение в противоопухолевой терапии
("бестиминовая смерть"). Фторурацил
– противоопухолевое (цитостатическое)
средство, механизм его действия
определяется превращением в
5-фтор-дезоксиуридинмонофосфат (5-FdУМФ)
и 5-фторуридинтрифосфат (5-FУТФ). 5-FdУМФ –
конкурентный ингибитор фермента
тимидилатсинтазы, что ведет к блокированию
синтеза ДНК. Метотрексат,
аминоптерин, триметоприм
являются ингибиторами дигидрофолатредуктазы,
что препятствует ресинтезу ТГФК и лишает
реакцию кофермента. Азидотимидин
(зидовудин) при синтезе ДНК на матрице
ретровирусной РНК встраивается вместо
dТТФ, т.к. вирусная ДНК-полимераза
("обратная транскриптаза") обладает
большим сродством к нему, чем к
естественному субстрату dТТФ.
совокупности
реакций) ингибирует начальные этапы
процесса. Для синтеза пиримидинов такими
ингибиторами являются УТФ и ЦТФ. ЦТФ
ингибирует аспартаткарбамоилтрансферазу,
УТФ – карбамоилфосфатсинтетазу.
Одновременно синтез пиримидинов
отрицательно регулируется также
пуриновыми нуклеотидами АМФ и ГМФ.
Тимидилатдифосфат (ТДФ), в свою очередь,
блокирует синтез ФРДФ , который
используется как при синтезе пиримидинов,
так и при синтезе пуринов.Лекарственная
регуляция.
Исключительная роль тимидилатсинтазы
и фолиевой кислоты в синтезе ТМФ
обусловила поиск и использование
ингибиторов этой реакции для прекращения
синтеза тимидилового нуклеотида и, как
следствие, блока синтеза ДНК, что нашло
применение в противоопухолевой терапии
("бестиминовая смерть"). Фторурацил
– противоопухолевое (цитостатическое)
средство, механизм его действия
определяется превращением в
5-фтор-дезоксиуридинмонофосфат (5-FdУМФ)
и 5-фторуридинтрифосфат (5-FУТФ). 5-FdУМФ –
конкурентный ингибитор фермента
тимидилатсинтазы, что ведет к блокированию
синтеза ДНК. Метотрексат,
аминоптерин, триметоприм
являются ингибиторами дигидрофолатредуктазы,
что препятствует ресинтезу ТГФК и лишает
реакцию кофермента. Азидотимидин
(зидовудин) при синтезе ДНК на матрице
ретровирусной РНК встраивается вместо
dТТФ, т.к. вирусная ДНК-полимераза
("обратная транскриптаза") обладает
большим сродством к нему, чем к
естественному субстрату dТТФ.
О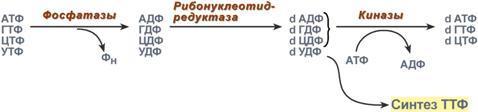
 собенностью
обмена пуринов и пиримидинов является
то, что они могут образовывать не только
рибонуклеотиды, но идезоксирибонуклеотиды.
Дезоксирибонуклеозидтрифосфаты
необходимы клетке для синтеза ДНК. Их
образование протекает в три реакции,
первая и третья реакции просты и понятны.
Главные события происходят во второй
реакции.
собенностью
обмена пуринов и пиримидинов является
то, что они могут образовывать не только
рибонуклеотиды, но идезоксирибонуклеотиды.
Дезоксирибонуклеозидтрифосфаты
необходимы клетке для синтеза ДНК. Их
образование протекает в три реакции,
первая и третья реакции просты и понятны.
Главные события происходят во второй
реакции.
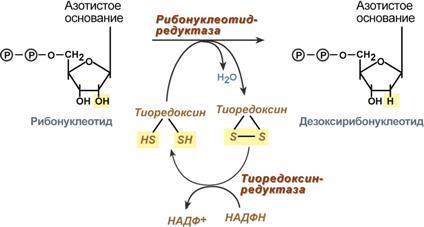
1. Реакция дефосфорилирования. В самом начале процесса происходит потеря рибонуклеозидтрифосфатами одной фосфатной группы и образуются АДФ, ГДФ, ЦДФ, УДФ.
2. Реакция восстановления. Во второй реакции фермент рибонуклеозид-редуктаза восстанавливает АДФ, ГДФ, ЦДФ, УДФ до дезоксирибонуклеозиддифосфатов dАДФ, dГДФ, dЦДФ, dУДФ. Донором водорода для восстановления рибозы является белок тиоредоксин, его SH-группы окисляются кислородом рибозы и образуется вода. Последующее восстановление тиоредоксина в рабочее состояние обеспечивается за счет НАДФН.
3. Реакция фосфорилирования. После образования dАДФ, dГДФ, dЦДФ фосфорилируются, а dУДФ используется для синтеза тимидилового нуклеотида.
Т ри
дезоксирибонуклеотида
– dАТФ, dГТФ, dЦТФ сразу после синтеза
используются для синтеза ДНК.
ри
дезоксирибонуклеотида
– dАТФ, dГТФ, dЦТФ сразу после синтеза
используются для синтеза ДНК.
Однако известно, что в составе ДНК нет уридиловых нуклеотидов, поэтому dУДФ не превращается в dУТФ, а идет на образование тимидилового нуклеотида. Участие в этом принимает фермент тимидилатсинтаза. Донором метильной группы является N5,N10-метиленТГФК.
Д алее
тимидилмонофосфат в фосфотрансферазных
реакциях фосфорилируется с образованием
тимидилтрифосфата ( ТТФ). Ресинтез
N5,N10-метиленТГФК. Важным элементом
реакции синтеза ТМФ является участие
N5,N10-тетрагидрофолиевой кислоты в
качестве источника метильной группы.
После реакции остается дигидрофолиевая
кислота, которую необходимо вернуть в
исходную форму. В этом процессе участвуют
два фермента: дигидрофолатредуктаза и
серин-оксиметилтрансфераза.
алее
тимидилмонофосфат в фосфотрансферазных
реакциях фосфорилируется с образованием
тимидилтрифосфата ( ТТФ). Ресинтез
N5,N10-метиленТГФК. Важным элементом
реакции синтеза ТМФ является участие
N5,N10-тетрагидрофолиевой кислоты в
качестве источника метильной группы.
После реакции остается дигидрофолиевая
кислота, которую необходимо вернуть в
исходную форму. В этом процессе участвуют
два фермента: дигидрофолатредуктаза и
серин-оксиметилтрансфераза.
38. Репликация ДНК: механизм и биологическое значение. Повреждение ДНК, репарация повреждений и ошибок репликации ДНК.
Р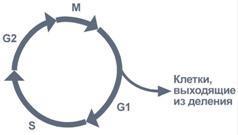
 епликация
(синтез) ДНК происходит не беспорядочно,
а в строго определенный период жизни
клетки. Всего выделяют 4 фазы клеточного
цикла: митоз (М), синтетическую (S),
пресинтетическую (G1, от англ. gap –
интервал), постсинтетическую (G2). Важное
участие в регуляции смены фаз клеточного
цикла занимают циклины – белки массой
35-90 кДа, уровень которых меняется в ходе
клеточного цикла. По функции циклины –
это активаторные субъединицы ферментов
циклин-зависимых киназ (ЦЗК). Активные
комплексы циклин-ЦЗК фосфорилируют
внутриклеточные белки, изменяя их
активность. Этим обеспечивается
продвижение по клеточному циклу. Синтез
(репликация, удвоение) ДНК происходит
в S-фазу клеточного цикла, когда клетка
готовится к делению. Механизм репликации,
как установили Мэтью Мезельсон и Франклин
Сталь в 1957 г, полуконсервативный, т.е.
на каждой нити материнской ДНК
синтезируется дочерняя копия.
епликация
(синтез) ДНК происходит не беспорядочно,
а в строго определенный период жизни
клетки. Всего выделяют 4 фазы клеточного
цикла: митоз (М), синтетическую (S),
пресинтетическую (G1, от англ. gap –
интервал), постсинтетическую (G2). Важное
участие в регуляции смены фаз клеточного
цикла занимают циклины – белки массой
35-90 кДа, уровень которых меняется в ходе
клеточного цикла. По функции циклины –
это активаторные субъединицы ферментов
циклин-зависимых киназ (ЦЗК). Активные
комплексы циклин-ЦЗК фосфорилируют
внутриклеточные белки, изменяя их
активность. Этим обеспечивается
продвижение по клеточному циклу. Синтез
(репликация, удвоение) ДНК происходит
в S-фазу клеточного цикла, когда клетка
готовится к делению. Механизм репликации,
как установили Мэтью Мезельсон и Франклин
Сталь в 1957 г, полуконсервативный, т.е.
на каждой нити материнской ДНК
синтезируется дочерняя копия.
Как любой матричный биосинтез, репликация требует наличия нескольких компонентов:
матрица – в ее роли выступает материнская нить ДНК,
растущая цепь – дочерняя нить ДНК,
субстраты для синтеза – dАТФ, dГТФ, dЦТФ, ТТФ,
источник энергии – dАТФ, dГТФ, dЦТФ, ТТФ,
ферменты.
Синтез ДНК начинается в определенных участках, получивших название точка ori (англ. origin – начало). На каждой ДНК млекопитающих точек ori насчитывается до 100. Репликация распространяется от этих участков в обе стороны по нитям ДНК с образованием репликативных "пузырей". В каждом таком "пузыре" имеются две репликативные "вилки", в которых происходит расплетание, раскручивание и непосредственный синтез ДНК. При этом репликативные вилки удаляются друг от друга. В целом репликация всех ДНК у эукариот заканчивается за 9 часов.
Синтез новой цепи ДНК идет в направлении от 5'-конца к 3'-концу, т.е. 5'-конец новой ДНК остается свободным, следующие нуклеотиды присоединяются к 3'-гидроксильной группе предыдущего нуклеотида со скоростью порядка 100 штук в секунду.
В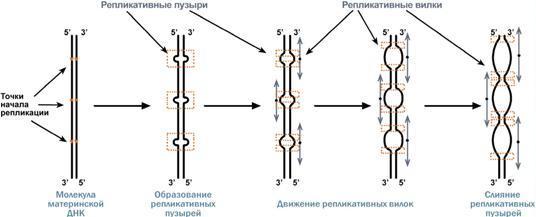
 репликативной вилке в направлении 5'→3'
непрерывно (т.е. обычным заурядным
присоединением последующих нуклеотидов
к предыдущим через С3 и С5) синтезируется
только одна нить, а именно та, для которой
направление синтеза совпадает с
направлением движения репликативной
вилки и соответствует направлению
материнской нити 3'→5'. По мере расплетания
ДНК и движения репликативной вилки на
этой материнской нити открываются
участки, где возможно безостановочное
удлинение ведущей дочерней нити.
Направление 5'→3' для другой дочерней
нити ДНК противоположно движению
репликативной вилки. Поэтому синтез
этой отстающей нити (в направлении
5'→3') возможен только после расплетания
части ДНК и освобождения участка для
синтеза. Т.о., синтез дочерней ДНК идет
фрагментарно. По имени японского
исследователя синтезируемые на отстающей
цепи отрезки ДНК назвали фрагменты
Оказаки.
репликативной вилке в направлении 5'→3'
непрерывно (т.е. обычным заурядным
присоединением последующих нуклеотидов
к предыдущим через С3 и С5) синтезируется
только одна нить, а именно та, для которой
направление синтеза совпадает с
направлением движения репликативной
вилки и соответствует направлению
материнской нити 3'→5'. По мере расплетания
ДНК и движения репликативной вилки на
этой материнской нити открываются
участки, где возможно безостановочное
удлинение ведущей дочерней нити.
Направление 5'→3' для другой дочерней
нити ДНК противоположно движению
репликативной вилки. Поэтому синтез
этой отстающей нити (в направлении
5'→3') возможен только после расплетания
части ДНК и освобождения участка для
синтеза. Т.о., синтез дочерней ДНК идет
фрагментарно. По имени японского
исследователя синтезируемые на отстающей
цепи отрезки ДНК назвали фрагменты
Оказаки.
В хронологическом порядке события репликации развертываются примерно следующим образом:
1.ДНК-топоизомеразы, находясь перед репликативной вилкой, разрезают молекулу ДНК для облегчения ее расплетания и раскручивания.
2. ДНК-хеликазы, следуя за топоизомеразами, раскручивают и расплетают молекулу ДНК.
3. ДНК-связывающие белки (ДСБ) связывают расплетенные нити ДНК и стабилизируют их, не допуская обратного "слипания" друг с другом.
4. ДНК-полимераза δ (греч.: δ – дельта), согласовано со скоростью движения репликативной вилки, осуществляет синтез ведущей цепи дочерней ДНК в направлении 5'→3' на матрице материнской нити ДНК по направлению от ее 3'-конца к 5'-концу (скорость до 100 пар нуклеотидов в секунду).Этим события на данной материнской нити ДНК ограничиваются.Далее описан синтез отстающей цепи дочерней ДНК.
5. Непосредственно сразу после расплетания и стабилизации другой нити материнской молекулы к ней присоединяется ДНК-полимераза α (α- альфа ) и в направлении 5'→3' синтезирует праймер (РНК-затравку) – последовательность РНК на матрице ДНК длиной от 10 до 200 нуклеотидов. После этого фермент удаляется с нити ДНК.Вместо ДНК-полимеразы α к 3'-концу праймера присоединяется ДНК-полимераза ε.
6. ДНК-полимераза ε (греч.: ε – эпсилон) как бы продолжает удлинять праймер, но в качестве субстрата встраивает дезоксирибонуклеотиды (в количестве 150-200 нуклеотидов). В результате образуется цельная нить из двух частей – РНК (т.е. праймер) и ДНК. ДНК-полимераза ε работает до тех пор, пока не встретит праймер предыдущего фрагмента Оказаки (синтезированный чуть ранее). После этого данный фермент удаляется с цепи.
7. ДНК-полимераза β (греч.: β – бета) встает вместо ДНК-полимеразы ε, движется в том же направлении (5'→3') и удаляет рибонуклеотиды праймера, одновременно встраивая дезоксирибонуклеотиды на их место. Фермент работает до полного удаления праймера, т.е. пока на его пути не встанет дезоксирибонуклеотид (еще более ранее синтезированный ДНК-полимеразой ε). Связать результат свой работы и впереди стоящую ДНК фермент не в состоянии, поэтому он сходит с цепи. В результате на матрице материнской нити "лежит" фрагмент дочерней ДНК. Он называется фрагмент Оказаки.
8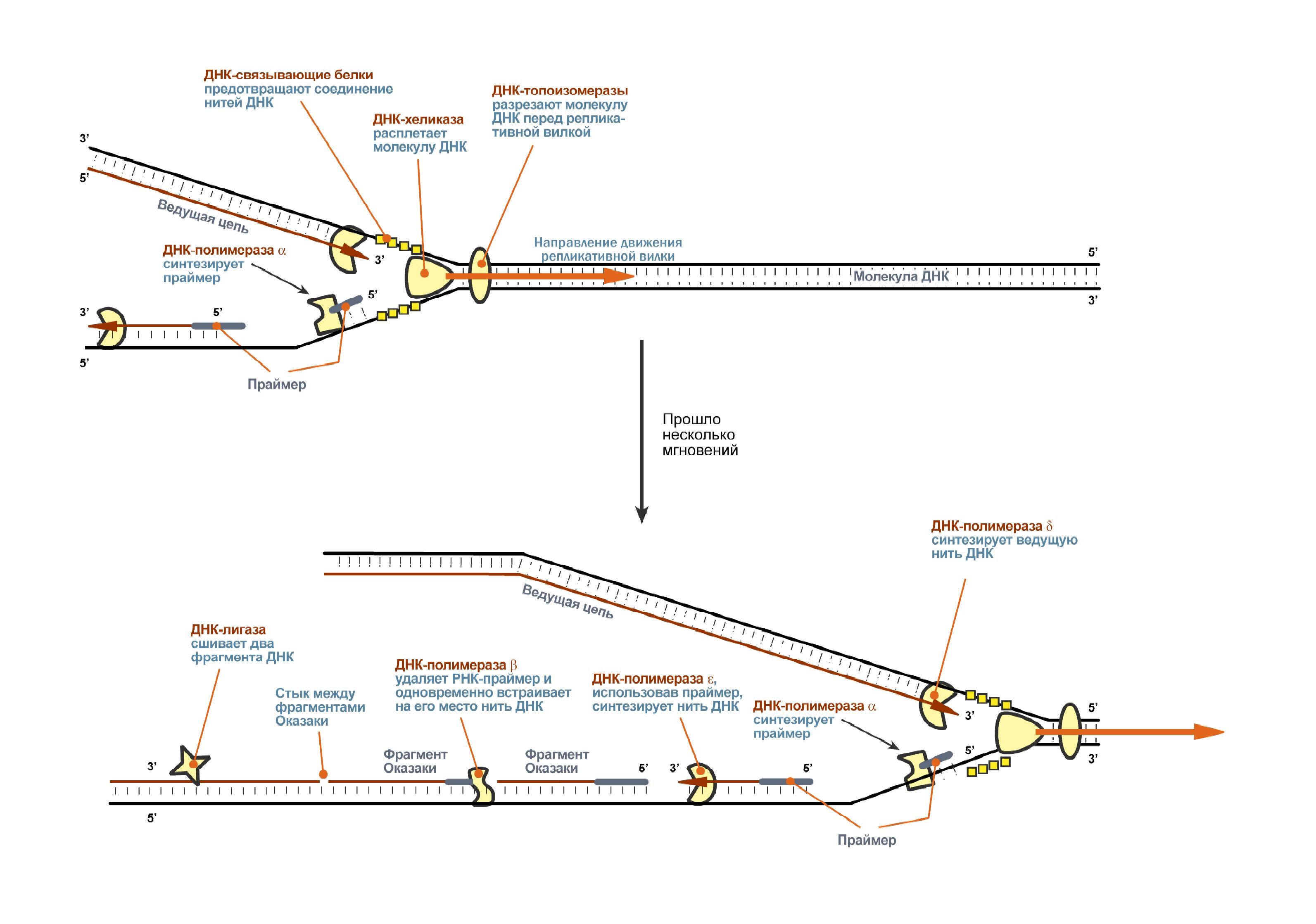 .
ДНК-лигаза производит сшивку двух
соседних фрагментов Оказаки, т.е. 5'-конца
отрезка, синтезированного ДНК-полимеразой
ε, и 3'-конца цепи, встроенного ДНК-полимеразой
β.
.
ДНК-лигаза производит сшивку двух
соседних фрагментов Оказаки, т.е. 5'-конца
отрезка, синтезированного ДНК-полимеразой
ε, и 3'-конца цепи, встроенного ДНК-полимеразой
β.
Повреждения и репарация ДНК. Так как на геном любой неделящейся клетки постоянно оказывает влияние окружающая среда, то вполне вероятны повреждения в составе нуклеотида, также возможно встраивание неправильного нуклеотида при репликации. Такие нарушения быстро определяются специальными ферментами, пораженный участок удаляется экзонуклеазами, заполняется ДНК-полимеразой β и сшивается ДНК-лигазой.
В случае изменения структуры основания (например, его дезаминирование) это основание удаляется ДНК-N-гликозидазой, затем другими ферментами удаляется дезоксирибоза и на ее место ДНК-полимеразой β и ДНК-лигазой встраивается нужный нуклеотид. Отрыв пуриновых и пиримидиновых оснований от дезоксирибозы устраняется ДНК-инсертазами, которые присоединяют к оставшейся дезоксирибозе соответствующие основания.
39. Типы РНК: особенности строения, размеры и разнообразие молекул, локализация в клетке, функции. Биосинтез РНК (транскрипция). Строение рибосом и полирибосом. Синтез аминоацил-тРНК. Субстратная специфичность аминоацил-тРНК-синтетаз.
Первичная структура РНК - порядок чередования рибонуклеозидмонофосфатов (НМФ) в полинуклеотидной цепи. В РНК, как и в ДНК, нук-леотиды связаны между собой 3',5'-фосфодиэфирными связями. Концы полинуклеотидных цепей РНК неодинаковы. На одном конце находится фосфорилированная ОН-группа 5'-углеродного атома, на другом конце - ОН-группа 3'-углеродного атома рибозы, поэтому концы называют 5'- и 3'-концами цепи РНК. Гидроксильная группа у 2'-углеродного атома рибозы делает молекулу РНК нестабильной. Так, в слабощелочной среде молекулы РНК гидролизуются даже при нормальной температуре, тогда как структура цепи ДНК не изменяется.
Вторичная структура РНК. Молекула рибонуклеиновой кислоты построена из одной полинуклеотидной цепи. Отдельные участки цепи РНК образуют спирализованные петли - "шпильки", за счёт водородных связей между комплементарными азотистыми основаниями A-U и G-C. Участки цепи РНК в таких спиральных структурах антипараллельны, но не всегда полностью комплементарны, в них встречаются неспаренные нуклеотидные остатки или даже одноцепочечные петли, не вписьюающиеся в двойную спираль. Наличие спирализованных участков характерно для всех типов РНК.
Третичная структура РНК .Одноцепочечные РНК характеризуются компактной и упорядоченной третичной структурой, возникающей путём взаимодействия спирализованных элементов вторичной структуры. Так, возможно образование дополнительных водородных связей между нуклеотидными остатками, достаточно удалёнными друг от друга, или связей между ОН-группами остатков рибо-зы и основаниями. Третичная структура РНК стабилизирована ионами двухвалентных металлов, например ионами Mg2+, связывающимися не только с фосфатными группами, но и с основаниями.
О сновные
типы РНК:
В цитоплазме клеток присутствуют 3 типа
рибонуклеиновых кислот - транспортные
РНК (тРНК), матричные РНК (мРНК) и
рибосомальные РНК (рРНК). Они различаются
по первичной структуре, молекулярной
массе, конформации, продолжительности
жизни и по функциональной активности.
сновные
типы РНК:
В цитоплазме клеток присутствуют 3 типа
рибонуклеиновых кислот - транспортные
РНК (тРНК), матричные РНК (мРНК) и
рибосомальные РНК (рРНК). Они различаются
по первичной структуре, молекулярной
массе, конформации, продолжительности
жизни и по функциональной активности.
Транспортные РНК (тРНК). Пространственную структуру любых тРНК, независимо от различий в последовательности нук-леотидов, описывают универсальной моделью "клеверного листа". В каждой молекуле тРНК есть участки цепи, не участвующие в образовании водородных связей между нуклеотидными остатками. К ним, в частности, относят участок, ответственный за связывание с аминокислотой на 3'-конце молекулы и антикодон - специфический триплет нуклеотидов, взаимодействующий комплементарно с кодоном мРНК. В состав нуклеотидов тРНК входят минорные основания (в среднем 10-12 оснований на молекулу). Они представлены метилированными основаниями, изомерами и аналогами пиримидинов. Минорные основания выполняют 2 функции: они делают тРНК устойчивыми к действию нук-леаз цитоплазмы и поддерживают определённую третичную структуру молекулы, так как не могут участвовать в образовании комплементарных пар, и препятствуют спирализации определённых участков в полинуклеотидной последовательности тРНК.
Матричные РНК (мРНК). Первичная структура всех мРНК, независимо от уникальности их кодирующей последовательности, имеет одинаковое строение 5'- и З'-концов. Так, на 5'- конце присутствует модифицированный нуклеотид 7-метилгуанозин-5'-трифосфат (кэп). Несколько десятков нуклеотидов отделяют кэп от инициирующего кодона, обычно это триплет -AUG-. За кодирующим участком следует один из терминирующих кодонов -UGA-, -UUA-, -UAG-. На 3'-конце большинства мРНК присутствует последовательность нуклеотидов из 100-200 аденозинмонофосфатных остатков.
Рибосомальные РНК (рРНК). Рибосомальные РНК имеют многочисленные спирализованные участки. Различают рРНК - 5S, 5,8S, 28S и 18S (S - коэффициент седиментации). Рибосомальные РНК содержат несколько модифицированных нуклеотидов, чаще всего это метилированные производные азотистых оснований или рибозы (2'-метилрибоза). рРНК образуют комплексы с белками, которые называют рибосомами. Каждая рибосома состоит из двух субъединиц - малой (40S) и большой (60S). Субъединицы рибосом различаются не только набором рРНК, но и количеством и структурой белков.
Прежде чем начнут синтезироваться белки, информацию об их строении необходимо "достать" из ДНК и доставить ее к месту синтеза белков. Этим занимаются информационные или матричные РНК. Одновременно клетке нужны транспортеры аминокислот – транспортные РНК и структурные компоненты органелл, синтезирующих белок, – рибосомальные РНК. Вся информация о строении транспортных и рибосомальных РНК также находится в ДНК. Поэтому существует процесс переписывания или транскрипции данных с ДНК на РНК – биосинтез РНК на матрице ДНК.
Как в любом матричном биосинтезе в транскрипции выделяют 5 необходимых элементов:
1)матрица – одна из цепей ДНК,
2)растущая цепь – РНК,
3)субстрат для синтеза – рибонуклеотиды (УТФ, ГТФ, ЦТФ, АТФ),
4)источник энергии – УТФ, ГТФ, ЦТФ, АТФ.
5)ферменты РНК-полимеразы и белковые факторы транскрипции.
Биосинтез РНК происходит в участке ДНК, который называется транскриптон, с одного края он ограничен промотором (начало), с другого – терминатором (конец).РНК-полимеразы эукариот имеют по две больших субъединицы и несколько малых субъединиц. Стадии транскрипции. Выделяют три стадии транскрипции: инициация, элонгация и терминация.
И нициация.Промотор
содержит стартовый сигнал транскрипции
– ТАТА-бокс. Так называется определенная
последовательность нуклеотидов ДНК,
связывающая первый фактор инициации
ТАТА-фактор. Этот ТАТА-фактор обеспечивает
присоединение РНК-полимеразы к той нити
ДНК, которая будет использоваться в
качестве шаблона для транскрипции
(матричная нить ДНК). Так как промотор
ассиметричен ("ТАТА"), то он связывает
РНК-полимеразу только в одной ориентации,
что определяет направление транскрипции
от 5'-конца к 3'-концу (5'→3'). Для связывания
РНК-полимеразы с промотором необходим
еще один фактор инициации – σ-фактор,
но сразу после синтеза затравочного
фрагмента РНК (длиной 8-10 рибонуклеотидов)
σ-фактор отрывается от фермента.
Другие
факторы инициации раскручивают спираль
ДНК перед РНК-полимеразой.
нициация.Промотор
содержит стартовый сигнал транскрипции
– ТАТА-бокс. Так называется определенная
последовательность нуклеотидов ДНК,
связывающая первый фактор инициации
ТАТА-фактор. Этот ТАТА-фактор обеспечивает
присоединение РНК-полимеразы к той нити
ДНК, которая будет использоваться в
качестве шаблона для транскрипции
(матричная нить ДНК). Так как промотор
ассиметричен ("ТАТА"), то он связывает
РНК-полимеразу только в одной ориентации,
что определяет направление транскрипции
от 5'-конца к 3'-концу (5'→3'). Для связывания
РНК-полимеразы с промотором необходим
еще один фактор инициации – σ-фактор,
но сразу после синтеза затравочного
фрагмента РНК (длиной 8-10 рибонуклеотидов)
σ-фактор отрывается от фермента.
Другие
факторы инициации раскручивают спираль
ДНК перед РНК-полимеразой.
Элонгация. Белковые факторы элонгации обеспечивают продвижение РНК-полимеразы вдоль ДНК и расплетают молекулу ДНК на протяжении примерно 17 нуклеотидных пар. РНК-полимераза продвигается со скоростью 40-50 нуклеотидов в секунду в направлении 5'→3'. Фермент использует АТФ, ГТФ, ЦТФ, УТФ одновременно в качестве субстрата и в качестве источника энергии.
Терминация. РНК-полимераза остановится, когда достигнет терминирующих кодонов. С помощью белкового фактора терминации, так называемого ρ-фактора (греч. ρ – "ро"), от матрицы ДНК отделяются фермент и синтезированная молекула РНК, которая является первичным транскриптом, предшественником мРНК или тРНК или рРНК.
С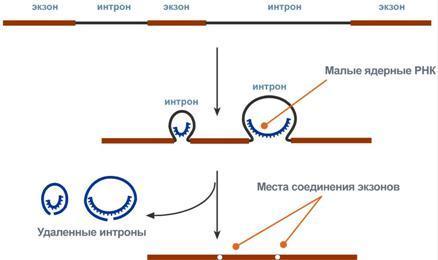 разу
после синтеза первичные транскрипты
РНК по разным причинам еще не имеют
активности, являются "незрелыми"
и в дальнейшем претерпевают ряд изменений,
которые называются процессинг. У эукариот
процессингу подвергаются все виды
пре-РНК, у прокариот – только предшественники
рРНК и тРНК. Процессинг предшественника
матричной РНК. При транскрипции участков
ДНК, несущих информацию о белках,
образуются гетерогенные ядерные РНК,
по размеру намного превосходящие мРНК.
Дело в том, что из-за мозаичной структуры
генов эти гетерогенные РНК включают в
себя информативные (экзоны) и неинформативные
(интроны) участки.
разу
после синтеза первичные транскрипты
РНК по разным причинам еще не имеют
активности, являются "незрелыми"
и в дальнейшем претерпевают ряд изменений,
которые называются процессинг. У эукариот
процессингу подвергаются все виды
пре-РНК, у прокариот – только предшественники
рРНК и тРНК. Процессинг предшественника
матричной РНК. При транскрипции участков
ДНК, несущих информацию о белках,
образуются гетерогенные ядерные РНК,
по размеру намного превосходящие мРНК.
Дело в том, что из-за мозаичной структуры
генов эти гетерогенные РНК включают в
себя информативные (экзоны) и неинформативные
(интроны) участки.
1. Сплайсинг – особый процесс, в котором при участии малых ядерных РНК происходит удаление интронов и сохранение экзонов.
2. Кэпирование – происходит еще во время транскрипции. Процесс состоит в присоединении к 5'-трифосфату концевого нуклеотида пре-мРНК 5'-углерода N7-метил-гуанозина.
"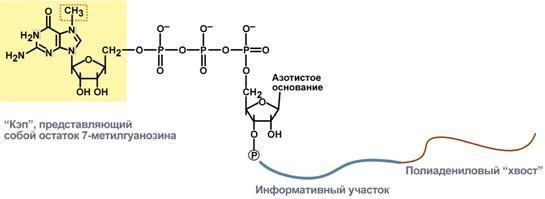 Кэп"
необходим для защиты молекулы РНК от
экзонуклеаз, работающих с 5'-конца, а
также для связывания мРНК с рибосомой
и для начала трансляции.
Кэп"
необходим для защиты молекулы РНК от
экзонуклеаз, работающих с 5'-конца, а
также для связывания мРНК с рибосомой
и для начала трансляции.
3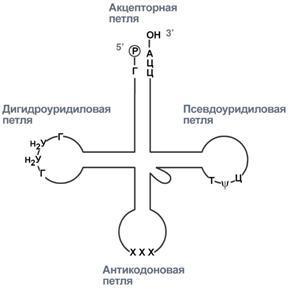 .
Полиаденилирование
– при помощи полиаденилат-полимеразы
с использованием молекул АТФ происходит
присоединение к 3'-концу РНК от 100 до 200
адениловых нуклеотидов, формирующих
полиадениловый фрагмент – поли(А)-хвост.
Поли(А)-хвост необходим для защиты
молекулы РНК от экзонуклеаз, работающих
с 3'-конца.
.
Полиаденилирование
– при помощи полиаденилат-полимеразы
с использованием молекул АТФ происходит
присоединение к 3'-концу РНК от 100 до 200
адениловых нуклеотидов, формирующих
полиадениловый фрагмент – поли(А)-хвост.
Поли(А)-хвост необходим для защиты
молекулы РНК от экзонуклеаз, работающих
с 3'-конца.
Предшественники рРНК являются более крупными молекулами по сравнению со зрелыми рРНК. Их созревание сводится к разрезанию прерибосомной РНК на более мелкие формы, которые уже непосредственно участвуют в формировании рибосомы. У прокариот молекулы рибосомальной РНК совсем иные по своим свойствам (5S-, 16S-, 23S-рРНК), что является основой изобретения и использования ряда антибиотиков в медицине.
Процессинг предшественника транспортной РНК. 1. Модификация нуклеотидов в молекуле путем дезаминирования, метилирования, восстановления.
Например, образование псевдоуридина и дигидроуридина.
2. Формирование антикодоновой петли происходит путем сплайсинга и удаления интрона в средней части пре-тРНК.
3. Формирование на 3'-конце последовательности ЦЦА. Для этого у одних пре-тРНК с 3'-конца удаляются лишние нуклеотиды до "обнажения" триплета ЦЦА, у других идет присоединение этой последовательности.
Рибосома-органелла клетки, участвующая в биосинтезе белка, состоит из молекул РНК (т. наз. рибосомные рибонуклеиновые кислоты, или рРНК) и белков. Осн. масса Р. локализована в цитоплазме. В бактериальной клетке Р. составляют до 30% ее сухой массы: на одну бактериальную клетку приходится примерно 104 Р. Состоят из двух разделяемых субчастиц, или рибосомных субъединиц. При определенных условиях (напр., при понижении концентрации Mg2 + в среде) Р. обратимо диссоциирует на две субчастицы с соотношением их мол. масс ок. 2:1. Прокарйотическая 70S Р. диссоциирует на субъединицы с коэф. седиментации 50S (мол. м. 1,5•106) и 30S (мол. м. 0,85•106). Эукариотическая Р. разделяется на субчастицы 60S и 40S. Две рибосомные субчастицы объединены в полную Р. строго определенным образом, предполагающим специфич. контакты их поверхностей. Полисома - Временный комплекс (4-5 и более) рибосом, транслирующих одновременно одну молекулу мРНК. Наличие в цитоплазме клеток значительного количества полисом свидетельствует о высокой интенсивности синтеза белка в конкретный момент времени. Много рибосом одновременно участв в синтезе белка на одной и той же мРНК, образ комплекс-полисому. Полирибосомы могут сущ в виде частиц, плавающих в цитоплазме клеток. Полирибосомы. По причине того, что продолжительность жизни матричной РНК невелика, перед клеткой стоит задача использовать ее максимально эффективно, т.е. получить максимальное количество "белковых копий". Для достижения этой цели на каждой мРНК может располагаться не одна, а несколько рибосом, встающих последовательно друг за другом и синтезирующих пептидные цепи. Такие образования называются полирибосомы.
А![]() МИНОАЦИЛ-тРНК-СИНТЕТАЗЫ
[аминокислота: тРНК-лигазы (образующие
АМФ)], ферменты класса ли-газ, катализирующие
аминоацилирование транспортной РНК
(тРНК) по схеме:
МИНОАЦИЛ-тРНК-СИНТЕТАЗЫ
[аминокислота: тРНК-лигазы (образующие
АМФ)], ферменты класса ли-газ, катализирующие
аминоацилирование транспортной РНК
(тРНК) по схеме:
где аминоацил-тРНК-синтетаза - фермент, АК - активируемая аминокислота, АТФ - аденозинтрифосфат, ПФ - пирофосфат, АМФ - аденозинмонофосфат. Карбоксильная группа аминокислоты в АК-АМФ связана ангидридной связью с остатком фосфорной к-ты (см. ф-лу; R'-ацил аминокислоты, R = Н), а в АК - тРНК - сложноэфирной связью с гидроксильной группой в положении 2' или 3' рибозы концевого остатка аденозина тРНК .
Каждая аминоацил-тРНК-синтетаза специфична только по отношению к одной из 20 аминокислот, входящих в белки, и к одной или нескольким тРНК. Для тех аминокислот, для которых открыты две и более тРНК, соответствующая аминоацил-тРНК-синтетаза катализирует аминоацилирование всех этих тРНК. Это обстоятельство чрезвычайно важно, поскольку в дальнейшем в белковом синтезе «узнавание» аминоацил-тРНК основано не на природе аминокислоты, а на химической природе антикодона тРНК. Считается, что в молекуле каждой аминоацил-тРНК-синтетазы имеется по крайней мере 3 центра связывания: для аминокислоты, тРНК и АТФ. Аминоацил-тРНК-синтетазы в активном центре содержат гистидин, имидазольное кольцо которого участвует в связывании АТФ посредством ионов Mg2+. Специфичность р-ций, катализируемых аминоацил-тРНК-синтетазами, очень высока, что определяет точность белкового синтеза в живой клетке. Если аминоацил-тРНК-синтетаза осуществит ошибочное аминоацилирование тРНК близкой по структуре аминокислотой, произойдет коррекция путем катализируемого той же аминоацил-тРНК-синтетазой гидролиза ошибочных АК-тРНК до АК и тРНК. В цитоплазме содержится полный набор аминоацил-тРНК-синтетаз, кодируемых ядерным геномом; в хлоропластах и митохондриях есть свои аминоацил-тРНК-синтетазы.
40. Биологический код. Основные компоненты белоксинтезирующей системы. Биосинтез белка. Механизм. Адапторная функция тРНК и роль мРНК в этом процессе.
Генетический (биологический) код – это способ кодирования информации о строении белков в виде нуклеотидной последовательности. Он предназначен для перевода четырехзначного языка нуклеотидов (А, Г, У, Ц) в двадцатизначный язык аминокислот. Он обладает характерными особенностями:
Триплетность – три нуклеотида формируют кодон, кодирующий аминокислоту. Всего насчитывают 61 смысловой кодон.
Специфичность (или однозначность) – каждому кодону соответствует только одна аминокислота.
Вырожденность – одной аминокислоте может соответствовать несколько кодонов.
Универсальность – биологический код одинаков для всех видов организмов на Земле (однако в митохондриях млекопитающих есть исключения).
Колинеарность – последовательность кодонов соответствует последовательности аминокислот в кодируемом белке.
Неперекрываемость – триплеты не накладываются друг на друга, располагаясь рядом.
Отсутствие знаков препинания – между триплетами нет дополнительных нуклеотидов или каких-либо иных сигналов.
Однонаправленность – при синтезе белка считывание кодонов идет последовательно, без пропусков или возвратов назад.
Однако ясно, что биологический код не может проявить себя без дополнительных молекул, которые выполняют переходную функцию или функцию адаптора.
А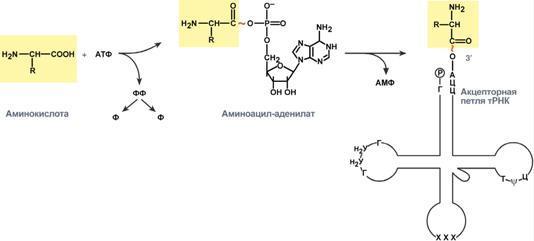 дапторная
роль транспортных РНК.Транспортные
РНК являются единственным посредником
между 4-х буквенной последовательностью
нуклеиновых кислот и 20-ти буквенной
последовательностью белков. Каждая
транспортная РНК имеет определенную
триплетную последовательность в
антикодоновой петле (антикодон) и может
присоединить только такую аминокислоту,
которая соответствует этому антикодону.
Именно от наличия того или иного
антикодона в тРНК зависит, какая
аминокислота включится в белковую
молекулу, т.к. ни рибосома, ни мРНК не
узнают аминокислоту. Таким образом,
адапторная роль тРНК заключается:
дапторная
роль транспортных РНК.Транспортные
РНК являются единственным посредником
между 4-х буквенной последовательностью
нуклеиновых кислот и 20-ти буквенной
последовательностью белков. Каждая
транспортная РНК имеет определенную
триплетную последовательность в
антикодоновой петле (антикодон) и может
присоединить только такую аминокислоту,
которая соответствует этому антикодону.
Именно от наличия того или иного
антикодона в тРНК зависит, какая
аминокислота включится в белковую
молекулу, т.к. ни рибосома, ни мРНК не
узнают аминокислоту. Таким образом,
адапторная роль тРНК заключается:
1.в специфичном связывании с аминокислотами,
2.в специфичном, согласно кодон-антикодоновому взаимодействию, связывании с мРНК,
3.и, как результат, во включении аминокислот в белковую цепь в соответствии с информацией мРНК.
Присоединение аминокислоты к тРНК осуществляется ферментом аминоацил-тРНК-синтетазой, имеющей специфичность одновременно к двум соединениям: какой-либо аминокислоте и соответствующей ей тРНК. Для реакции требуется две макроэргические связи АТФ. Аминокислота присоединяется к 3'-концу акцепторной петли тРНК через свою α-карбоксильную группу, и связь между аминокислотой и тРНК становится макроэргической. α-Аминогруппа остается свободной. Так как существует около 60 различных тРНК, то некоторым аминокислотам соответствует по две или более тРНК. Различные тРНК, присоединяющие одну аминокислоту, называют изоакцепторными.
Т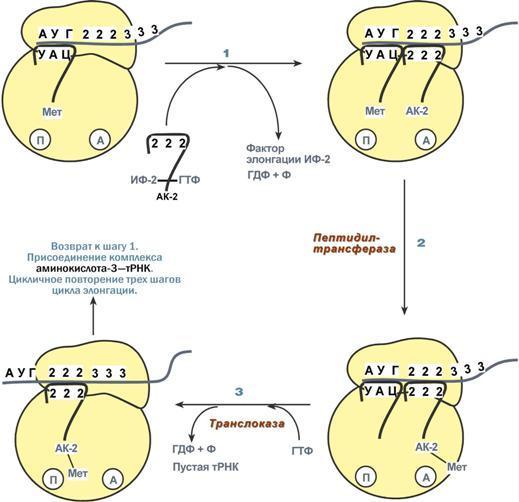 рансляция
– это биосинтез
белка
на матрице мРНК.
рансляция
– это биосинтез
белка
на матрице мРНК.
После переноса информации с ДНК на матричную РНК начинается синтез белков. Каждая зрелая мРНК несет информацию только об одной полипептидной цепи. Если клетке необходимы другие белки, то необходимо транскрибировать мРНК с иных участков ДНК.
Биосинтез белков или трансляция происходит на рибосомах, внутриклеточных белоксинтезирующих органеллах, и включает 5 ключевых элементов:
1)матрица – матричная РНК,
2)растущая цепь – полипептид,
3)субстрат для синтеза – 20 протеиногенных аминокислот,
4)источник энергии – ГТФ,
5)рибосомальные белки, рРНК и белковые факторы.
Выделяют три основных стадии трансляции: инициация, элонгация, терминация.
И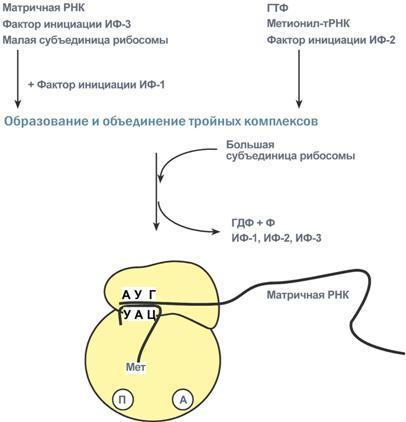 нициация.
Для инициации необходимы мРНК, ГТФ,
малая и большая субъединицы рибосомы,
три белковых фактора инициации (ИФ-1,
ИФ-2, ИФ-3), метионин и тРНК для метионина.
нициация.
Для инициации необходимы мРНК, ГТФ,
малая и большая субъединицы рибосомы,
три белковых фактора инициации (ИФ-1,
ИФ-2, ИФ-3), метионин и тРНК для метионина.
В начале этой стадии формируются два тройных комплекса: первый комплекс – мРНК + малая субъединица + ИФ-3,
второй комплекс – метионил-тРНК + ИФ-2 + ГТФ.
После формирования тройные комплексы объединяются с большой субъединицей рибосомы. В этом процессе активно участвуют белковые факторы инициации, источником энергии служит ГТФ. После сборки комплекса инициирующая метионил-тРНК связывается с первым кодоном АУГ матричной РНК и располагается в П-центре (пептидильный центр) большой субъединицы. А-центр (аминоацильный центр) остается свободным, он будет задействован на стадии элонгации для связывания аминоацил-тРНК. После присоединения большой субъединицы начинается стадия элонгации.
Элонгация. Для этой стадии необходимы все 20 аминокислот, тРНК для всех аминокислот, белковые факторы элонгации, ГТФ. Удлинение цепи происходит со скоростью примерно 20 аминокислот в секунду. Элонгация представляет собой циклический процесс. Первый цикл (и следующие циклы) элонгации включает три шага: 1.Присоединение аминоацил-тРНК (еще второй) к кодону мРНК (еще второму), аминокислота при этом встраивается в А-центр рибосомы. Источником энергии служит ГТФ.
2.Фермент пептидилтрансфераза осуществляет перенос метионина с метионил-тРНК (в П-центре) на вторую аминоацил-тРНК (в А-центре) с образованием пептидной связи между метионином и второй аминокислотой. При этом уже активированная СООН-группа метионина связывается со свободной NH2-группой второй аминокислоты. Здесь источником энергии служит макроэргическая связь между аминокислотой и тРНК. 3.Фермент транслоказа перемещает мРНК относительно рибосомы таким образом, что первый кодон АУГ оказывается вне рибосомы, второй кодон (на рисунке ) становится напротив П-центра, напротив А-центра оказывается третий кодон (на рисунке ). Для этих процессов необходима затрата энергии ГТФ. Так как вместе с мРНК перемещаются закрепленные на ней тРНК, то инициирующая первая тРНК выходит из рибосомы, вторая тРНК с дипептидом помещается в П-центр. Второе повторение цикла – начинается с присоединения третьей аминоацил-тРНК к третьему кодону мРНК, аминокислота-3 становится в А-центр. Далее трансферазная реакции повторяется и образуется трипептид, занимающий А?центр, после чего он смещается в П-центр в транслоказной реакции. В пустой А-центр входит четвертая аминоацил-тРНК и начинается третий цикл элонгации:
Ц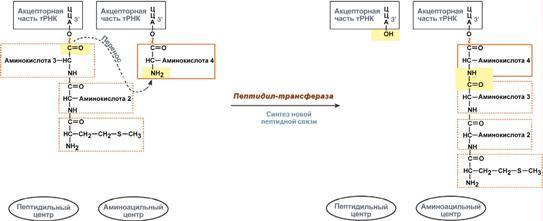 икл
элонгации (реакции 1,2,3) повторяется
столько раз, сколько аминокислот
необходимо включить в полипептидную
цепь.
икл
элонгации (реакции 1,2,3) повторяется
столько раз, сколько аминокислот
необходимо включить в полипептидную
цепь.
Т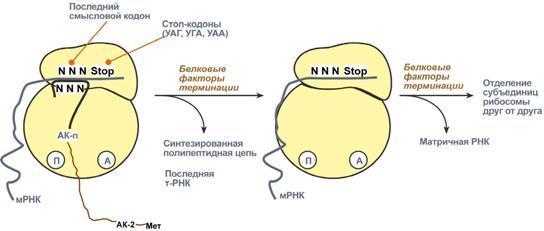 ерминация.
Синтез белка продолжается до тех пор,
пока рибосома не достигнет на мРНК
особых терминирующих кодонов –
стоп-кодонов УАА, УАГ, УГА. Данные триплеты
не кодируют ни одной из аминокислот, их
также называют нонсенс-кодоны. При
вхождении этих кодонов внутрь рибосомы
происходит активация белковых факторов
терминации, которые последовательно
катализируют:
ерминация.
Синтез белка продолжается до тех пор,
пока рибосома не достигнет на мРНК
особых терминирующих кодонов –
стоп-кодонов УАА, УАГ, УГА. Данные триплеты
не кодируют ни одной из аминокислот, их
также называют нонсенс-кодоны. При
вхождении этих кодонов внутрь рибосомы
происходит активация белковых факторов
терминации, которые последовательно
катализируют:
1)Гидролитическое отщепление полипептида от конечной тРНК.
2)Отделение от П-центра последней, уже пустой, тРНК.
3)Диссоциацию рибосомы.
Источником энергии для завершения трансляции является ГТФ.
По причине того, что продолжительность жизни матричной РНК невелика, перед клеткой стоит задача использовать ее максимально эффективно, т.е. получить максимальное количество "белковых копий". Для достижения этой цели на каждой мРНК может располагаться не одна, а несколько рибосом, встающих последовательно друг за другом и синтезирующих пептидные цепи. Такие образования называются полирибосомы.
После того как пептидная цепь отходит от рибосомы она должна принять свою биологически активную форму, т.е. свернуться определенным образом, связать какие-либо группы и т.п. Реакции превращения полипептида в активный белок называются процессинг или посттрансляционная модификация белков.
Посттрансляционная модификация белков. К основным реакциям процессинга относятся:
1. Удаление с N-конца метионина или даже нескольких аминокислот специфичными аминопептидазами.
2. Образование дисульфидных мостиков между остатками цистеина.
3. Частичный протеолиз – удаление части пептидной цепи, как в случае с инсулином или протеолитическими ферментами ЖКТ.
4. Присоединение химической группы к аминокислотным остаткам белковой цепи:
фосфорной кислоты – например, фосфорилирование по аминокислотам Серину, Треонину, Тирозину используется при регуляции активности ферментов или для связывания ионов кальция,
карбоксильной группы – например, при участии витамина К происходит γ-карбоксилирование глутамата в составе протромбина, проконвертина, фактора Стюарта, Кристмаса, что позволяет связывать ионы кальция при инициации свертывания крови,
метильной группы – например, метилирование аргинина и лизина в составе гистонов используется для регуляции активности генома,
гидроксильной группы – например, образование гидроксипролина и гидроксилизина необходимо для созревания молекул коллагена при участии витамина С,
йода – например, в тиреоглобулине присоединение йода необходимо для образования предшественников тиреоидных гормонов йодтиронинов,
5. Включение простетической группы:
углеводных остатков – например, гликирование требуется при синтезе гликопротеинов.
гема – например, при синтезе гемоглобина, миоглобина, цитохромов, каталазы,
витаминных коферментов – биотина, ФАД, пиридоксальфосфата и т.п.
6. Объединение протомеров в единый олигомерный белок, например, гемоглобин, коллаген, лактатдегидрогеназа, креатинкиназа.
Фолдинг белков – это процесс укладки вытянутой полипептидной цепи в правильную трехмерную пространственную структуру. Для обеспечения фолдинга используется группа вспомогательных белков под названием шапероны (chaperon, франц. – спутник, нянька). Они предотвращают взаимодействие новосинтезированных белков друг с другом, изолируют гидрофобные участки белков от цитоплазмы и "убирают" их внутрь молекулы, правильно располагают белковые домены.
В целом шапероны способствуют переходу структуры белков от первичного уровня до третичного и четвертичного. При нарушении функции шаперонов и отсутствии фолдинга в клетке формируются белковые отложения – развивается амилоидоз. Насчитывают около 15 вариантов амилоидоза.
41. Регуляция биосинтеза белка. Индукция и репрессия синтеза белка на примере функционирования лактозного оперона кишечной палочки. Ингибиторы матричных биосинтезов: лекарственные препараты, вирусные и бактериальные токсины.
Так как транскрипция связывает ядро – "мозг" клетки, ее "банк знаний" и белки, "рабочих лошадок" клетки, то от качества и активности транскрипции зависит объем синтеза тех или иных белков, жизнедеятельность клетки, ее способность адаптироваться к окружающей обстановке.У прокариот и эукариот регуляция транскрипции происходит, естественно, по-разному, хотя некоторые моменты похожи.
Регуляция биосинтеза белка у прокариот осуществляется на уровне изменения скорости синтеза мРНК. В настоящее время принята теория оперона, сформулированная Франсуа Жакобом и Жаком Моно. В основе теории лежат следующие понятия:
1 .оперон
– группа тесно связанных между собой
генов, которые программируют образование
структурных белков и ферментов в клетке,
.оперон
– группа тесно связанных между собой
генов, которые программируют образование
структурных белков и ферментов в клетке,
2.конституитивные ферменты – те, которые присутствуют в клетках всегда, независимо от ее активности и условий,
3.индуцибельные ферменты – те, которые программируются опероном и синтезируются при необходимости,
4.ген-регулятор – ген, регулирующий работу оперона, но не входящий в его состав. Он синтезирует белок-регулятор (чаще называемый белок-репрессор), который может быть в активной или неактивной форме,
5.ген-операто –участок ДНК, способный св-ся с белком-регулятором, и "решающий" нужно работать РНК-полимеразе или нет.
П редложены
две схемы регуляции скорости транскрипции:
по механизму индукции (лактозный оперон)
и по механизму репресии (триптофановый
оперон).Лактозный
оперон
в целом отвечает за катаболизм лактозы.
При изучении E.coli было замечено, что в
клетке может быть две взаимоисключающие
ситуации:
редложены
две схемы регуляции скорости транскрипции:
по механизму индукции (лактозный оперон)
и по механизму репресии (триптофановый
оперон).Лактозный
оперон
в целом отвечает за катаболизм лактозы.
При изучении E.coli было замечено, что в
клетке может быть две взаимоисключающие
ситуации:
-активность одного из ферментов катаболизма лактозы низка, если в среде имеется глюкоза.
-активность этого фермента резко повышается в обратной ситуации, т.е. при отсутствии глюкозы и при наличии лактозы.На основании наблюдений была предложена схема регуляции оперона по механизму индукции:
1. В отсутствие лактозы активный белок-репрессор связывается с оператором и блокирует синтез мРНК, кодирующей ферменты катаболизма лактозы. В результате эти ферменты не образуются.
2. Если глюкозы нет, а лактоза есть, то последняя связывается с белком-репрессором и ингибирует его, не давая связаться с геном-оператором. Это позволяет РНК-полимеразе считывать информацию, отвечающую за синтез ферментов катаболизма лактозы, и синтезировать мРНК. Т.о., лактоза является индуктором транскрипции.
Триптофановый оперон в целом отвечает за синтез триптофана.Функционирование триптофанового оперона в некотором смысле противоположно лактозному. Регуляция осуществляется по механизму репрессии.
1. В отличие от лактозного оперона, белок-репрессор синтезируется в неактивном состоянии и не может заблокировать транскрипцию генов, кодирующих ферменты синтеза триптофана. Синтез этой аминокислоты будет в клетке продолжаться до тех пор, пока в питательной среде не появится триптофан.
2. Триптофан соединяется с белком-репрессором и активирует его. Далее такой активный комплекс присоединяется к гену-оператору и блокирует транскрипцию. Таким образом, при наличии триптофана в среде прекращается его внутриклеточный синтез, экономятся ресурсы и энергия бактериальной клетки.
В этом случае триптофан является репрессором транскрипции.
Регуляция у эукариот .Существенное усложнение эукариотических организмов повлекло за собой появление новых способов регуляции активности транскрипции:
1. Амплификация – это увеличение количества генов, точнее многократное копирование одного гена. Естественно, все полученные копии равнозначны и одинаково активно обеспечивают транскрипцию.
2. Энхансеры – это участки ДНК в 10-20 пар оснований, способные значительно усиливать экспрессию генов той же ДНК. В отличие от промоторов они значительно удалены от транскрипционного участка и могут располагаться от него в любом направлении (к 5'-концу или к 3'-концу). Сами энхансеры не кодируют какие-либо белки, но способны связываться с регуляторными белками (подавляющими транскрипцию).
3. Сайленсеры – участки ДНК, в принципе схожие с энхансерами, но они способны замедлять транскрипцию генов, связываясь с регуляторными белками (которые ее активируют).
4. Перестройка генов. К подобным процессам относится кроссинговер – обмен участками гомологичных хромосом, и более сложный процесс – сайт-специфичная рекомбинация, которая изменяет положение и порядок нуклеотидных последовательностей в геноме.
5. Процессинг мРНК – некоторые пре-мРНК подвергаются разным вариантам сплайсинга (альтернативный сплайсинг) в результате чего образуются разные мРНК, и соответственно, белки с разной функцией.
6. Изменение стабильности мРНК – чем выше продолжительность жизни мРНК в цитозоле клетки, тем больше синтезируется соответствующего белка.
Лекарственная регуляция транскрипции
Ингибирование. 1. Гетероциклические соединения доксорубицин, дауномицин и актиномицин D обладают способностью интеркалировать (встраиваться между нитей молекулы ДНК) между двумя соседними парами оснований Г-Ц. В результате возникает препятствие для движения РНК-полимеразы ("заедание молнии") и остановка транскрипции.
2. Рифампицин связывается с β-субъединицей РНК-полимеразы прокариот и ингибирует ее. Благодаря такой избирательности действия рифампицин действует только на бактерии и является препаратом для лечения туберкулеза.
3. α-Аманитин, октапептид бледной поганки (Amanita phalloides) блокирует РНК-полимеразу II эукариот и предотвращает продукцию мРНК.
Активация. Активация транскрипции используется в клинике намного реже и заключается в применении аналогов стероидных гормонов для достижения анаболического эффекта в органе-мишени.
Многие вещества обладают способностью связываться с элементами рибосом или другими факторами трансляции. Некоторые из этих веществ используются в качестве лекарственных средств, которые в состоянии действовать на разных уровнях трансляции, например:
1. Инактивация факторов инициации
интерферон активирует внутриклеточные протеинкиназы, которые, в свою очередь, фосфорилируют белковый фактор инициации ИФ-2 и подавляют его активность.
2. Нарушение кодон-антикодонового взаимодействия
стрептомицин присоединяется к малой субъединице и вызывает ошибку считывания первого основания кодона.
3. Блокада стадии элонгации
тетрациклины блокируют А-центр рибосомы и лишают ее способности связываться с аминоацил-тРНК,
левомицетин связывается с 50S-частицей рибосомы и ингибирует пептидил-трансферазу,
эритромицин связывается с 50S-частицей рибосомы и ингибирует транслоказу,
пуромицин по структуре схож с тирозил-тРНК, входит в А-центр рибосомы и участвует в пептидил-трансферазной реакции, образуя связь с имеющимся пептидом. После этого комплекс пуромицин‑-пептид отделяется от рибосомы, что останавливает синтез белка.
42. Гемоглобин. Строение. Синтез и распад гемоглобина. Формы билирубина. Пути выведения билирубина и других желчных пигментов. Желтухи.
Гемоглобин входит в состав группы белков гемопротеины, которые сами являются подвидом хромопротеинов и подразделяются на неферментативные белки (гемоглобин, миоглобин) и ферменты (цитохромы, каталаза, пероксидаза). Небелковой частью их является гем – структура, включающая в себя порфириновое кольцо (состоящее из 4 пиррольных колец) и иона Fe2+. Железо связывается с порфириновым кольцом двумя координационными и двумя ковалентными связями.
Строение гемоглобина. Гемоглобин представляет собой белок, включающий 4 гемсодержащие белковые субъединицы. Между собой протомеры соединяются гидрофобными, ионными, водородными связями по принципу комплементарности. При этом они взаимодействуют не произвольно, а определенным участком - контактной поверхностью. Этот процесс высокоспецифичен, контакт происходит одновременно в десятках точек по принципу комплементарности. Взаимодействие осуществляют разноименно заряженные группы, гидрофобные участки, неровности на поверхности белка. Белковые субъединицы в нормальном гемоглобине могут быть представлены различными типами полипептидных цепей: α, β, γ, δ, ε, ξ (соответственно, греч. - альфа, бета, гамма, дельта, эпсилон, кси). В состав молекулы гемоглобина входят по две цепи двух разных типов. Гем состоит из иона двухвалентного железа и порфирина. В основе структуры порфиринов находится порфин. Порфин представляет собой четыре пиррольных кольца, связанных между собой метеновыми мостикамиГем соединяется с белковой субъединицей, во-первых, через остаток гистидина координационной связью железа, во-вторых, через гидрофобные связи пиррольных колец и гидрофобных аминокислот. Гем располагается как бы "в кармане" своей цепи и формируется гемсодержащий протомер.
Существует несколько нормальных вариантов гемоглобина:
HbР – примитивный гемоглобин, содержит 2ξ- и 2ε-цепи, встречается в эмбрионе между 7-12 неделями жизни,
HbF – фетальный гемоглобин, содержит 2α- и 2γ-цепи, появляется через 12 недель внутриутробного развития и является основным после 3 месяцев,
HbA – гемоглобин взрослых, доля составляет 98%, содержит 2α- и 2β-цепи, у плода появляется через 3 месяца жизни и к рождению составляет 80% всего гемоглобина,
HbA2 – гемоглобин взрослых, доля составляет 2%, содержит 2α- и 2δ-цепи,
HbO2 – оксигемоглобин, образуется при связывании кислорода в легких, в легочных венах его 94-98% от всего количества гемоглобина,
HbCO2 – карбогемоглобин, образуется при связывании углекислого газа в тканях, в венозной крови составляет 15-20% от всего количества гемоглобина.
Патологические формы гемоглобина
HbS – гемоглобин серповидно-клеточной анемии.
MetHb – метгемоглобин, форма гемоглобина, включающая трехвалентный ион железа вместо двухвалентного. Такая форма обычно образуется спонтанно, в этом случае ферментативных мощностей клетки хватает на его восстановление. При использовании сульфаниламидов, употреблении нитрита натрия и нитратов пищевых продуктов, при недостаточности аскорбиновой кислоты ускоряется переход Fe2+ в Fe3+. Образующийся metHb не способен связывать кислород и возникает гипоксия тканей. Для восстановления ионов железа в клинике используют аскорбиновую кислоту и метиленовую синь.
Hb-CO – карбоксигемоглобин, образуется при наличии СО (угарный газ) во вдыхаемом воздухе. Он постоянно присутствует в крови в малых концентрациях, но его доля может колебаться от условий и образа жизни. Угарный газ является активным ингибитором гем-содержащих ферментов, в частности, цитохромоксидазы 4-го комплекса дыхательной цепи.
HbA1С – гликозилированный гемоглобин. Концентрация его нарастает при хронической гипергликемии и является хорошим скрининговым показателем уровня глюкозы крови за длительный период времени.
Б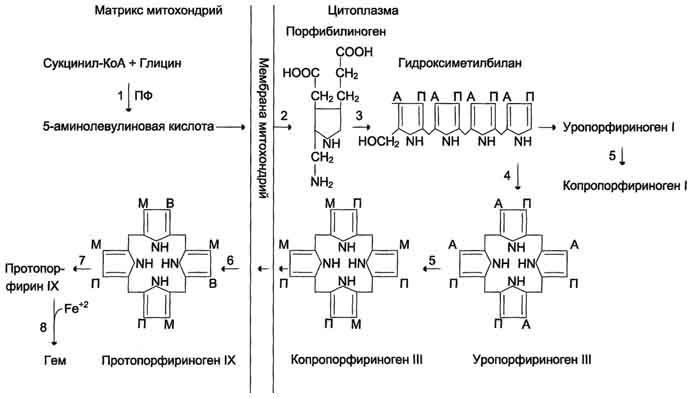 иосинтез
гема.
Гем является небелковой частью многих
гемопротеинов:
иосинтез
гема.
Гем является небелковой частью многих
гемопротеинов:
гемоглобин (до 85% общего количества гема организма), локализованный в эритроцитах и клетках костного мозга,
миоглобин скелетных мышц и миокарда (17%),
ц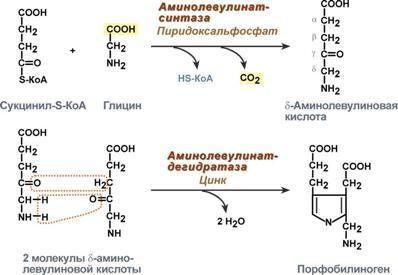 итохромы
дыхательной цепи и P450, цитохромоксидаза,
гомогентизатоксидаза, пероксидаза,
миелопероксидаза, каталаза, тиреопероксидаза
и т.д. – менее 1%. Синтез гема в основном
идет в предшественниках эритроцитов,
клетках печени, почек, слизистой
кишечника, и в остальных тканях. Первая
реакция синтеза с участием
δ-аминолевулинат-синтазы происходит в
митохондриях. Следующая реакция при
участии аминолевулинатдегидратазы
(порфобилиноген-синтазы) протекает в
цитозоле.Гем синтезируется во всех
тканях, но с наибольшей скоростью в
костном мозге и печени. В костном мозге
гем необходим для синтеза гемоглобина
в ретикулоцитах, в гепатоцитах - для
образования цитохрома Р450.
итохромы
дыхательной цепи и P450, цитохромоксидаза,
гомогентизатоксидаза, пероксидаза,
миелопероксидаза, каталаза, тиреопероксидаза
и т.д. – менее 1%. Синтез гема в основном
идет в предшественниках эритроцитов,
клетках печени, почек, слизистой
кишечника, и в остальных тканях. Первая
реакция синтеза с участием
δ-аминолевулинат-синтазы происходит в
митохондриях. Следующая реакция при
участии аминолевулинатдегидратазы
(порфобилиноген-синтазы) протекает в
цитозоле.Гем синтезируется во всех
тканях, но с наибольшей скоростью в
костном мозге и печени. В костном мозге
гем необходим для синтеза гемоглобина
в ретикулоцитах, в гепатоцитах - для
образования цитохрома Р450.
Первая реакция синтеза гема - образование 5-аминолевулиновой кислоты из глицина и сук-цинил-КоА идёт в матриксе митохондрий, где в ЦТК образуется один из субстратов этой реакции - сукцинил-КоА. Эту реакцию катализирует пиридоксальзависимый фермент аминолевулинатсинтаза. Из митохондрий 5-аминолевулиновая кислота поступает в цитоплазму. В цитоплазме проходят промежуточные этапы синтеза гема: соединение 2 молекул 5-аминолевулиновой кислоты молекулу порфобилиногена, дезаминирование порфобилиногена с образованием гидроксиметилбилана, ферментативное превращение гидроксиметилбилана в молекулу уропор-фобилиногена III, декарбоксилирование последнего с образованием копропорфириногена III. Гидроксиметилбилан может также нефермента-тивно превращаться в уропорфириноген I, который декарбоксилируется в копропорфирино-ген I. Из цитоплазмы копропорфириноген III опять поступает в митохондрии, где проходят заключительные реакции синтеза гема. В результате двух последовательных окислительных реакций копропорфириноген III превращается в протопорфириноген IX, а протопорфириноген IX - в Протопорфирин IX. Фермент феррохела-таза, присоединяя к протопорфирину IX двухвалентное лентное железо, превращает его в гем. Источником железа для синтеза гема служит депонирующий железо белок ферритин. Синтезированный гем, соединяясь с α и β-полипепептидными цепями глобина, образует гемоглобин. Гем регулирует синтез глобина: при снижении скорости синтеза гема синтез глобина в ретикулоцитах тормозится.
Регуляция синтеза гема
1. Скорость синтеза глобиновых цепей зависит от наличия гема, он ускоряет биосинтез "своих" белков.
2. Основным регуляторным ферментом синтеза гема является аминолевулинатсинтаза.
гем после взаимодействия с молекулой белка-репрессора формирует активный репрессорный комплекс, связывается с ДНК и подавляет транскрипцию, мРНК для фермента не образуется и синтез фермента прекращается. Также имеется отрицательный аллостерический эффект гема на фермент.
с другой стороны, достаточное количество ионов железа оказывает положительный эффект при синтезе молекулы аминолевулинатсинтазы. В клетке имеется особый железосвязывающий белок, который в отсутствии ионов железа обладает сродством к мРНК фермента и блокирует ее трансляцию в рибосоме, т.е. синтез белковой цепи. Ионы железа связываются с этим железосвязывающим белком, образуя с ним неактивный комплекс, что инициирует синтез фермента.
3. Положительным модулятором аминолевулинатсинтазы служит гипоксия тканей, которая в эритропоэтических тканях индуцирует синтез фермента.
4. В печени повышение активности аминолевулинатсинтазы вызывают соединения, усиливающие работу микросомальной системы окисления (жирорастворимые токсины, стероиды) – при этом возрастает потребление гема для образования цитохрома Р450, что снижает внутриклеточную концентрацию свободного гема. В результате происходит дерепрессия синтеза фермента.
Распад. За сутки у человека распадается около 9 г гемопротеинов, в основном это гемоглобин эритроцитов. Эритроциты живут 90-120 дней, после чего лизируются в кровеносном русле или в селезенке. При разрушении эритроцитов в кровяном русле высвобождаемый гемоглобин образует комплекс с белком-переносчиком гаптоглобином (фракция α2-глобулинов крови) и переносится в клетки ретикуло-эндотелиальной системы (РЭС) селезенки (гл образом), печени и костного мозга.
Первая реакция катаболизма гема происходит при участии NADPH-зависимого ферментативного комплекса гемоксигеназы. Ферментная сисгема локализована в мембране ЭР, в области электронтранспортных цепей микросомального окисления. Фермент катализирует расщепление связи между двумя пиррольными кольцами, содержащих винильные остатки, - таким образом, раскрывается структура кольца. В ходе реакции образуются линейный тетрапир-рол - биливердин (пигмент жёлтого цвета) и монооксид углерода (СО), который получается из углерода метениловой группы. Гем индуцирует транскрипцию гена гемоксигеназы, абсолютно специфичной по отношению к тему.
Ионы железа, освободившиеся при распаде гема, могут быть использованы для синтеза новых молекул гемоглобина или для синтеза других железосодержащих белков. Биливердин восстанавливается до билирубина NADPH-зависимым ферментом биливердинредуктазой. Билирубин образуется не только при распаде гемоглобина, не также при катаболизме других гемсодержащю белков, таких как цитохромы и миоглобин. При распаде 1 г гемоглобина образуется 35 мг билирубина, а в сутки у взрослого человека - примерно 250-350 мг билирубина. Дальнейший метаболизм билирубина происходит в печени.
В
![]()
 клетках РЭС гем в составе гемоглобина
окисляется молекулярным кислородом. В
реакциях последовательно происходит
разрыв метинового мостика между 1-м и
2-м пиррольными кольцами гема с их
восстановлением, отщеплением железа и
белковой части и образованием оранжевого
пигмента билирубина.Билирубин
– токсичное, жирорастворимое вещество,
способное нарушать окислительное
фосфорилирование в клетках. Особенно
чувствительны к нему клетки нервной
ткани. Из клеток ретикуло-эндотелиальной
системы билирубин попадает в кровь.
Здесь он находится в комплексе с
альбумином плазмы, в гораздо меньшем
количестве – в комплексах с металлами,
аминокислотами, пептидами и другими
малыми молекулами. Образование таких
комплексов не позволяет выделяться
билирубину с мочой. Билирубин в комплексе
с альбумином называется свободный
(неконъюгированный) или непрямой
билирубин. Из сосудистого русла в
гепатоциты билирубин попадает с помощью
белка-переносчика (лигандина). В клетке
протекает реакция связывания билирубина
с УДФ-глюкуроновой кислотой, при этом
образуются моно- и диглюкурониды. Кроме
глюкуроновой кислоты, в реакцию могут
вступать сульфаты, фосфаты, глюкозиды.
Билирубин-глюкуронид получил название
связанный (конъюгированный) или прямой
билирубин. После образования
билирубин-глюкурониды АТФ-зависимым
переносчиком секретируются в желчные
протоки и далее в кишечник, где при
участии бактериальной β-глюкуронидазы
превращаются в свободный билирубин.
Одновременно некоторое количество
билирубин-глюкуронидов может попадать
(особенно у взрослых) из желчи в кровь
по межклеточным щелям. Таким образом,
в крови в норме одновременно существуют
две формы билирубина: свободный,
попадающий сюда из клеток РЭС (около
80% всего количества), и связанный,
попадающий из желчных протоков (до 20%).
Превращение
в кишечнике.
В кишечнике билирубин подвергается
восстановлению под действием микрофлоры
до мезобилирубина и мезобилиногена
(уробилиногена). Часть последних
всасывается и с током крови вновь
попадает в печень, где окисляется до
ди- и трипирролов. При этом в здоровом
организме в общий круг кровообращения
и в мочу мезобилирубин и уробилиноген
не попадают, а полностью задерживаются
гепатоцитами. Оставшаяся в кишечнике
часть пигментов ферментами бактериальной
флоры толстого кишечника восстанавливается
до стеркобилиногена и выделяется из
организма, окрашивая кал. Незначительное
количество стеркобилиногена через
геморроидальные вены попадает в большой
круг кровообращения, отсюда в почки и
выделяется с мочой. На воздухе
стеркобилиноген и уробилиноген
превращаются, соответственно, в
стеркобилин и уробилин.
Ситуации,
при которых в крови накапливается
билирубин, в зависимости от причины
делятся на три вида:
клетках РЭС гем в составе гемоглобина
окисляется молекулярным кислородом. В
реакциях последовательно происходит
разрыв метинового мостика между 1-м и
2-м пиррольными кольцами гема с их
восстановлением, отщеплением железа и
белковой части и образованием оранжевого
пигмента билирубина.Билирубин
– токсичное, жирорастворимое вещество,
способное нарушать окислительное
фосфорилирование в клетках. Особенно
чувствительны к нему клетки нервной
ткани. Из клеток ретикуло-эндотелиальной
системы билирубин попадает в кровь.
Здесь он находится в комплексе с
альбумином плазмы, в гораздо меньшем
количестве – в комплексах с металлами,
аминокислотами, пептидами и другими
малыми молекулами. Образование таких
комплексов не позволяет выделяться
билирубину с мочой. Билирубин в комплексе
с альбумином называется свободный
(неконъюгированный) или непрямой
билирубин. Из сосудистого русла в
гепатоциты билирубин попадает с помощью
белка-переносчика (лигандина). В клетке
протекает реакция связывания билирубина
с УДФ-глюкуроновой кислотой, при этом
образуются моно- и диглюкурониды. Кроме
глюкуроновой кислоты, в реакцию могут
вступать сульфаты, фосфаты, глюкозиды.
Билирубин-глюкуронид получил название
связанный (конъюгированный) или прямой
билирубин. После образования
билирубин-глюкурониды АТФ-зависимым
переносчиком секретируются в желчные
протоки и далее в кишечник, где при
участии бактериальной β-глюкуронидазы
превращаются в свободный билирубин.
Одновременно некоторое количество
билирубин-глюкуронидов может попадать
(особенно у взрослых) из желчи в кровь
по межклеточным щелям. Таким образом,
в крови в норме одновременно существуют
две формы билирубина: свободный,
попадающий сюда из клеток РЭС (около
80% всего количества), и связанный,
попадающий из желчных протоков (до 20%).
Превращение
в кишечнике.
В кишечнике билирубин подвергается
восстановлению под действием микрофлоры
до мезобилирубина и мезобилиногена
(уробилиногена). Часть последних
всасывается и с током крови вновь
попадает в печень, где окисляется до
ди- и трипирролов. При этом в здоровом
организме в общий круг кровообращения
и в мочу мезобилирубин и уробилиноген
не попадают, а полностью задерживаются
гепатоцитами. Оставшаяся в кишечнике
часть пигментов ферментами бактериальной
флоры толстого кишечника восстанавливается
до стеркобилиногена и выделяется из
организма, окрашивая кал. Незначительное
количество стеркобилиногена через
геморроидальные вены попадает в большой
круг кровообращения, отсюда в почки и
выделяется с мочой. На воздухе
стеркобилиноген и уробилиноген
превращаются, соответственно, в
стеркобилин и уробилин.
Ситуации,
при которых в крови накапливается
билирубин, в зависимости от причины
делятся на три вида:
1.Гемолитические – в результате гемолиза при избыточном превращении гемоглобина в билирубин,
2.Печеночно-клеточные – когда печень не в состоянии обезвредить билирубин,
3.Механические – если билирубин не может попасть из печени в кишечник из-за механического перекрытия желчевыводящих путей.
Накопление билирубина в крови свыше 43 мкмоль/л ведет к связыванию его эластическими волокнами кожи и конъюнктивы, что проявляется в виде желтухи. Так как свободный билирубин липофилен, то он легко накапливается в подкожном жире и нервной ткани. Последнее особенно опасно для детей, особенно для новорожденнных.
Гемолитическая или надпеченочная желтуха – ускоренное образование билирубина в результате усиления внутрисосудистого гемолиза. К данному типу желтух относятся гемолитические анемии различного происхождения: врожденный сфероцитоз, серповидно-клеточная анемия, дефицит глюкозо-6-фосфатдегидрогеназы, отравление сульфаниламидами, талассемии, сепсис, лучевая болезнь, несовместимость крови. В данном случае гипербилирубинемия развивается за счет фракции непрямого билирубина. Гепатоциты усиленно переводят непрямой билирубин в связанную форму, секретируют его в желчь, в результате в кале увеличивается содержание стеркобилина, интенсивно его окрашивая. В моче возрастает содержание уробилина, билирубин отсутствует.У новорожденных гемолитическая желтуха может развиться как симптом гемолитической болезни новорожденного.
Механическая или подпеченочная желтуха развивается вследствие снижения оттока желчи при непроходимости желчного протока – желчные камни, новообразования поджелудочной железы, гельминтозы. В результате застоя желчи происходит растяжение желчных капилляров, увеличивается проницаемость их стенок. Не имеющий оттока в кишечник прямой билирубин поступает в кровь, в результате развивается гипербилирубинемия. В тяжелых случаях, вследствие переполнения гепатоцитов прямым билирубином, реакция конъюгации с глюкуроновой кислотой может нарушаться, присоединяется печеночно-клеточная желтуха (см ниже). В результате в крови увеличивается концентрация непрямого билирубина. В моче резко увеличен уровень билирубина (цвет темного пива) и снижено количество уробилина, практически отсутствует стеркобилин кала (серовато-белое окрашивание).
Паренхиматозная (печеночно-клеточная) желтуха – причиной может быть нарушение на всех трех стадиях превращения билирубина в печени: извлечение билирубина из крови печеночными клетками, его конъюгирование и секреция в желчь. Наблюдается при вирусных и других формах гепатитов, циррозе и опухолях печени, жировой дистрофии печени, при отравлении токсическими гепатотропными веществами, при врожденных патологиях. Так как нарушаются все процессы превращения билирубина в печени, гипербилирубинемия развивается за счет обеих фракций, преимущественно прямого билирубина. Концентрация его возрастает из-за нарушения секреции в желчь и увеличения проницаемости мембран клеток печени. Количество непрямого билирубина возрастает за счет функциональной недостаточности гепатоцитов и/или снижения их количества. В моче определяется билирубин (цвет крепкого черного чая), умеренно увеличена концентрация уробилина, уровень стеркобилина кала в норме или снижен.
Гемолитическая болезнь новорожденного.Причины: Несовместимость крови матери и плода по группе или по резус-фактору. Накопление гидрофобной формы билирубина в подкожном жире обуславливает желтушность кожи. Однако реальную опасность представляет накопление билирубина в сером веществе нервной ткани и ядрах ствола с развитием "ядерной желтухи" (билирубиновая энцефалопатия).
Клиническая диагностика: Проявляется сонливостью, плохим сосанием, умственной отсталостью, ригидностью затылочных мышц, тоническими судорогами, тремором конечностей, изменением рефлексов с возможным развитием глухоты и параличей.
Физиологическая (транзиторная) желтуха новорожденных. Причины: относительное снижение активности УДФ-глюкуронилтрансферазы в первые дни жизни, связанное с повышенным распадом фетального гемоглобина, абсолютное снижение активности УДФ-глюкуронилтрансферазы в первые дни жизни, дефицит лигандина, слабая активность желчевыводящих путей. Клиническая диагностика: окрашивание кожи на 3-4 день после рождения, гемолиза и анемии нет. Симптомы исчезают спустя 1-2 недели после рождения.
Желтуха недоношенных.Причины: относительное снижение активности УДФ-глюкуронилтрансферазы в первые дни жизни, связанное с повышенным распадом фетального гемоглобина, абсолютное снижение активности УДФ-глюкуронилтрансферазы в первые дни жизни, дефицит лигандина, слабая активность желчевыводящих путей.Клиническая диагностика:окрашивание кожи, гемолиза и анемии нет. Исчезает спустя 3-4 недели после рождения.
43. Белковые фракции плазмы крови. Функции белков плазмы крови. Гипо- и гиперпротеинемия, причины этих состояний. Индивидуальные белки плазмы крови: транспортные белки, белки острой фазы.
В плазме крови человека содержится около 100 различных белков. По подвижности при электрофорезе их можно грубо разделить на пять фракций: альбумин, α1-, α2-, β- и γ-глобулины. Разделение на альбумин и глобулин первоначально основывалось на различии в растворимости: альбумины растворимы в чистой воде, а глобулины -только в присутствии солей.
Альбумины. На долю альбуминов приходится более половины (55–60%) белков плазмы крови человека. Мол. масса альбумина около 70000. Сывороточные альбумины сравнительно быстро обновляются. Благодаря высокой гидрофильности, особенно в связи с относительно небольшим размером молекул и значительной концентрацией в сыворотке, альбумины играют важную роль в поддержании онк-го Р крови. Известно, что конц-ия альбуминов в сыворотке ниже 30 г/л вызывает значит изменения онкотического давления крови, что приводит к возникновению отеков. Альбумины выполняют важную фун-ю транспорта многих биологически активных в-в (в частности, гормонов). Они способны связываться с холестерином, желчными пигментами. Значительная часть кальция в сыворотке крови также связана с альбуминами. Норма: 42 г/л
Глобулины. группа глобулярных белков, растворимы в слабых растворах нейтральных солей, разбавленных кислотах и щелочах, нерастворимых в воде. Делится на фракции:
Фракция α-1-глобулинов включает в себя альфа-1-антитрипсин (основной компонент этой фракции) – ингибитор протеолитических ферментов, альфа-1-кислый гликопротеин (орозомукоид) – обладает широким спектром ф-ий, в зоне воспаления способствует фибриллогенезу, альфа-1-липопротеины(ф – участие в транспорте липидов), протромбин и транспортные белки: тироксинсвязывающий глобулин, транкортин (ф – связывание и тр-т кортизола и тироксина). Норма: 3г/л
Фракция α-2-глобулинов преимущественно включает белки острой фазы – альфа-2 макроглобулин, гаптоглобин, церулоплазмин, а также аполипопротеин В. Альфа-2-макроглобулин, являющийся основным компонентом фракции, участвует в развитии инфекционных и воспалительных реакций. Гаптоглобин – это гликопротеин, который образует комплекс с гемоглобином, высвобождающемся из эритроцитов при внутрисосудистом гемолизе. Церулоплазмин специфически связывает ионы меди, а также является оксидазой аскорбиновой кислоты, адреналина, диоксифенилаланина (ДОФА), способен инактивировать свободные радикалы. Альфа-липопротеины участвуют в транспорте липидов. Норма:6г/л
Фракция β-глобулинов содержит трансферрин (главный плазменный белок – переносчик железа), гемопексин (связывает гемм/метгем, вследствие чего предотвращает выведение его почками и потерю железа), компоненты комплемента (которые учавствуют в реакциях иммунитета), бета-липопротеины (транспорт холестерина и фосфолипидов) и часть Ig. Норма: 9г/л
Фракция γ-глобулинов состоит из иммуноглобулинов. Норма: 15 г/л. Иммуноглобулины, или антитела , обеспечивающие гуморальный иммунитет, синтезируются В-лимфоцитами или образующимися из них плазматическими клетками. Известно 5 классов иммуноглобулинов: IgG, IgA, IgM, IgD и IgE, при этом IgG, IgA и IgM – основные классы; IgD и IgE – минорные классы иммуноглобулинов плазмы человека. Молекула иммуноглобулина состоит из двух идентичных пар полипептидных цепей. Каждая пара в свою очередь состоит из двух разных цепей: легкой (L) и тяжелой (Н). Иммуноглобулины G – основные иммуноглобулины сыворотки, осуществляют гуморальную защиту организма от бактерий и вирусов и их растворимых токсинов (антигенов). Активно транспортируются через плаценту. У детей должная концентрация достигается только к 1,5-2 годам. Иммуноглобулины А осуществляют местный иммунитет на слизистых поверхностях дыхательных путей (носовой и бронхиальный секрет) и кишечного тракта. Они присутствуют в женском молозиве, слезе, слюне. После рождения количество секреторного IgA (на слизистых) достигает уровня взрослых уже на 2-3 неделе жизни, сывороточного IgA – только к 14-15 годам. Иммуноглобулины М появляются в процессе формирования иммунного ответа, являясь первичными антителами. Вскоре после рождения их уровень нарастает, достигает максимума к 9 месяцу жизни, после чего снижается и восстанавливается только к 20-30 годам. Иммуноглобулины Е вырабатываются плазматическими клетками и участвуют в аллергических реакциях организма. Иммуноглобулины D не имеют четкой сформированной функции. Предполагается, что они регулируют активность других иммуноглобулинов.
Белки плазмы крови выполняют несколько важных функций:
1. Поддерживают постоянство коллоидно-осмотического давления крови и постоянство V крови;
2. Определяют вязкость крови и сохраняют устойчивость эритроцитов и лейкоцитов в кровотоке, обеспечивают нормальный кровоток в капиллярах (реологические свойства крови);
3. Белковая буферная система участвует в регуляции кислотно-щелочного состояния;
4. Специализированные белки связывают и транспортируют углеводы, липиды, гормоны, лекарства, витамины, токсичные вещества;
5. Удерживают в связанном состоянии и транспортируют катионы кальция, магния, железа, меди и другие ионы, препятствуя их потере с мочой;
6. Специализированные белки участвуют в свертывании крови (фибриноген, протромбин, антигемофильный глобулин и др.);
7. Иммуноглобулины, факторы системы комплемента, трансферрин и пропердин (предупреждая инфекционный процесс и сохраняя резистентность организма) выполняют защитную функцию;
8. Являются резервом аминокислот.
9. Обеспечивают неспецифическую защиту организма при повреждении тканей – белки острой фазы.
И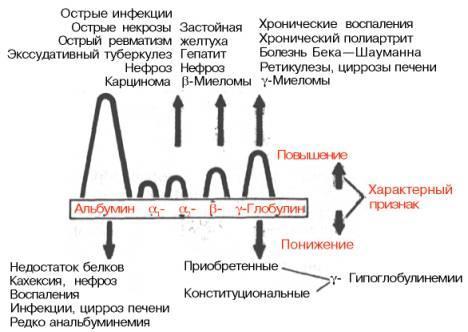 зменение
соотношения белковых фракций плазмы
крови наблюдается при многих заболеваниях
при нормальном содержании общего белка
(диспротеинемии).
Диспротеинемии отмечаются чаще, чем
изменение общего количества белка. При
наблюдении в динамике могут характеризовать
стадию заболевания, его длительность,
эффективность проводимых лечебных
мероприятий. Гиперпротеинемия
– увеличение общего содержания белков
плазмы. Диарея у детей, рвота при
непроходимости верхнего отдела тонкой
кишки, обширные ожоги могут способствовать
повышению концентрации белков в плазме
крови. Иными словами, потеря воды
организмом, а следовательно, и плазмой
приводит к повышению концентрации белка
в крови (относительная
гиперпротеинемия).
При ряде патологических состояний может
наблюдаться абсолютная
гиперпротеинемия,
обусловленная увеличением уровня
γ-глобулинов: например, гиперпротеинемия
в результате инфекционного или
токсического раздражения системы
макрофагов; гиперпротеинемия при
миеломной болезни. В сыворотке крови
больных миеломной болезнью обнаруживаются
специфические «миеломные» белки.
Появление в плазме крови белков, не
существующих в норм условиях, принято
называть парапротеинемией. Содержание
белков в плазме достигает 100–160 г/л.
зменение
соотношения белковых фракций плазмы
крови наблюдается при многих заболеваниях
при нормальном содержании общего белка
(диспротеинемии).
Диспротеинемии отмечаются чаще, чем
изменение общего количества белка. При
наблюдении в динамике могут характеризовать
стадию заболевания, его длительность,
эффективность проводимых лечебных
мероприятий. Гиперпротеинемия
– увеличение общего содержания белков
плазмы. Диарея у детей, рвота при
непроходимости верхнего отдела тонкой
кишки, обширные ожоги могут способствовать
повышению концентрации белков в плазме
крови. Иными словами, потеря воды
организмом, а следовательно, и плазмой
приводит к повышению концентрации белка
в крови (относительная
гиперпротеинемия).
При ряде патологических состояний может
наблюдаться абсолютная
гиперпротеинемия,
обусловленная увеличением уровня
γ-глобулинов: например, гиперпротеинемия
в результате инфекционного или
токсического раздражения системы
макрофагов; гиперпротеинемия при
миеломной болезни. В сыворотке крови
больных миеломной болезнью обнаруживаются
специфические «миеломные» белки.
Появление в плазме крови белков, не
существующих в норм условиях, принято
называть парапротеинемией. Содержание
белков в плазме достигает 100–160 г/л.
Гипопротеинемия, или уменьшение общего кол-ва белка в плазме крови, наблюдается гл образом при снижении уровня альбуминов. Выраженная гипопротеинемия – постоянный и патогенетически важный симптом нефротического синдрома. Содержание общего белка снижается до 30–40 г/л. Гипопротеинемия наблюдается также при поражении печеночных кл (острая атрофия печени, токсический гепатит и др.). Кроме того, гипопротеинемия может возникнуть при резко увеличенной проницаемости стенок капилляров, при белковой недостаточности (поражение пищеварительного тракта, карцинома и др.). Можно считать, что гиперпротеинемия, связана с гиперглобулинемией, а гипопротеинемия – с гипоальбуминемией.
БЕЛКИ-ПЕРЕНОСЧИКИ (транспортные белки), участвуют в переносе метаболитов, ионов и др. в-в по руслу крови, во внеклеточных тканевых жидкостях, а также внутрь клеток через биол. мембраны. Белки-переносчики, локализованные в биол. жидкостях, участвуют в переносе в-в, плохо р-римых в воде - жирных к-т, билирубина, нек-рых стероидов, ионов Fe и Сu, а также О2 и СО2. Липопротеины плазмы переносят липиды в виде белок-липидных комплексов. Самые легкие липопротеины - хиломикроны, 98% к-рых составляют нейтральные и кислые липиды и холестерин. Содержание белков-переносчиков в плазме крови и др. биол. жидкостях колеблется от 1 -2 мг (транскортин) до 3500-4500 мг (альбумин) на 100 мл. К мембранным белкам-переносчикам относятся белки систем трансмембранного переноса сахаров, АК и др. метаболитов. Эти белки интегрированы в составе биол. мембран. Во мн. случаях мембранные белки-переносчики образуют системы транспорта, в к-рых отдельные ф-ции разделены между разными белками. Захват глюкозы клетками обычно является опосредованным процессом. Сначала глюкоза связывается с переносчиком глюкозы (ГЛУТ), локализованным в клеточной мембране. Перенос глюкозы через мембрану обеспечивается за счет изменения конформации молекулы переносчика. АТФ-азные системы, транспортирующие ионы К+ и Na+ относятся к группе транспортных белков. Они осуществляют АТФ-зависимый активный транспорт через мембраны против концентрационного градиента. Несколько особняком стоят липидпереносящие белки, к-рые обнаружены как в мембранных структурах, так и в плазме крови. Они переносят лишь определенный тип фосфолипидов и участвуют в построении биол. мембран. К белкам-переносчикам можно отнести также нек-рые ферменты и ферментные системы. Гамма-глутамилтрансфераза)участвует в транспорте аминокислот в клетках животных. Большинство белков-переносчиков плазмы крови и нек-рые мембранные- гликопротеины. трансферин (бета глобулин) переносит Fe в тканитем самым предотвращает избыт накопление Fe и потерю его с мочой, трансферин накапл-ся у беременных женьщин. Гаптоглобин (альфа 2 глобулин): связывает гемоглобин, транспортирует В12, защит ф-ию, естеств. ингибитор катепсина В. Церуплазмин (альфа2 глобулин): переносчик и регулятор конц-ии ионов Cu особенно в печени., антиоксидант, фероксидазная и полиаминооксидазная активность.
Белки острой фазы – большая группа белков сыворотки крови (в основном α-глобулинов) с молекулярной массой от 12 кДа до 340 кДа и различными функциями, объединенных по общему признаку – быстрое и значительное увеличение концентрации при бактериальной, вирусной, паразитарной инфекции, физической или химической травме, токсической или аутоиммунной реакции, злокачественных новообразованиях. Смысл данного увеличения заключается в повышении резистентности кл к ок-ю, в ограничении повреждения тканей, в подавлении скорости размножения бактерий. Синтез белков острой фазы осущ-ся печенью, моноцитами, лимфоцитами, нейтрофилами. Их конц-ия зависят от стадии заболевания и/или от масштабов повреждений. Синтез белков включается и регулируется рядом медиаторов, среди которых цитокины, анафилотоксины и ГКС. Гаптоглобин (увел в 2-3 раза, особенно при раке, ожогах, хир-их вмешательствах, воспалении); церулоплазмин (антиоксидант); Трансферрин (содержание снижается, поэтому его называют негативным белком острой фазы.); С-реактивный белок. Отсутствует в сыворотке здорового человека, но обнаруживается при патологических состояниях, сопровождающихся некрозом (острая фаза ревматизма, инфаркт миокарда и др.). Предп-ся, что он способствует фагоцитозу. Интерферон — специфич белок, появляющийся в кл в рез-те проникновения вирусов. Он угнетает размн-е вирусов в кл. Обладает видовой специфичностью, но не абсолютной. Фибриноген, основная ф-я которого участие в свертывании крови. Синтез фибриногена начинается ч/з несколько часов после травмы с максимумом на конец 1 -2 суток. Увел-е конц-ии белков острой фазы в крови является хорошим индикатором не только явного, но и скрытого воспаления (атеросклероз).
44. Остаточный азот крови. Гиперазотемия, ее причины. Уремия.
Низкомолекулярные азотистые вещества представлены, главным образом, продуктами обмена белков и нуклеиновых кислот. Эти вещества остаются в надосадочной жидкости или фильтрате после осаждения крупномолекулярных белков и составляют остаточный азот крови (сумма всех азотсодержащих веществ крови после удаления из неё белков = Небелковый азот крови). Нормальное содержание 14,3 – 28,6 ммоль/л
Основными фракциями остаточного азота являются: 1) мочевина (примерно 50%; синтезируется в гепатоцитах из аммиака и карбамоилфосфата в орнитиновом цикле, с кровью разносится по всему организму, легко проникает через мембраны клеток и равномерно распределяется во внеклеточном и внутриклеточном пространствах. В почках мочевина полностью фильтруется, 40‑50% ее реабсорбируется в почечных канальцах и активно секретируется тубулярными клетками. Азот мочевины составляет около 90% всего выводимого азота.), 2) АКты (около 25%), 3) креатин и креатинин (7,5%; Креатин синтезируется из глицина, аргинина и метионина в ходе последовательных реакций в почках и печени. Отсюда креатин с током крови доставляется в мышцы, фосфорилируется с образованием креатинфосфата. Далее в ходе спонтанного гидролиза (1‑2%) либо после перенесения фосфорной группы от креатинфосфата на адениловую кислоту из креатина образуется креатинин, который выводится с мочой. В норме количество креатинина в моче соответствует мышечной массе тела и не зависит от суточного количества мочи), 4) полипептиды, нуклеотиды и азотистые основания (5%; поступают в кровь частично из кишечника (при переваривании белков), частично из тканей в результате распада тканевых белков), 5)мочевая кислота (4%; образуется главным образом в печени при распаде пуриновых нуклеотидов (аденина и гуанина), поступающих с пищей, эндогенных и синтезированных de novo. Около 80‑85% ее выделяется почками, остальное количество — через кишечник. Почечная экскреция мочевой кислоты зависит от профильтрованного количества, которое почти полностью реабсорбируется в проксимальном канальце, а также секреции и реабсорбции в дистальном канальце, в итоге выводится около 10% профильтрованной мочевой кислоты. В плазме крови мочевая кислота находится в виде урата натрия в концентрации, близкой к насыщению. Поэтому при превышении в крови нормальных значений существует возможность кристаллизации уратов), 6) аммиак и индикан (0,5%; Индикан представляет собой калиевую или натриевую соль индоксилсерной кислоты, образующейся в печени при обезвреживании индола. Индол появляется в кишечнике при гниении белков из аминокислоты триптофана. Кроме индоксилсерной кислоты в печени образуется и индоксилглюкуроновая кислота. Оба производных индола водорастворимы и удаляются с мочой).
У здорового человека колебания в содержании небелкового (остаточного) азота крови незначительны и в основном зависят от количества поступающих с пищей белков. При ряде патологических состояний уровень небелкового азота в крови повышается. Это состояние носит название азотемии. Увеличение фракций остаточного азота (азотемия) по своему характеру может быть абсолютным, связанным с действительным накоплением азотистых компонентов в крови, и относительным, связанным с дегидратацией. В свою очередь, абсолютная азотемия может быть ретенционная и продукционная.
Ретенционная азотемия развивается в результате недостаточного выделения с мочой азотсодержащих продуктов при нормальном поступлении их в кровяное русло. Она в свою очередь может быть почечной и внепочечной. При почечной ретенционной азотемии концентрация остаточного азота в крови увеличивается вследствие ослабления очистительной (экскреторной) функции почек (заболевания клубочков — нефриты, туберкулез почек, нефросклероз и т.д.). Резкое повышение содержания остаточного азота происходит в основном за счет мочевины. В этих случаях на долю азота мочевины приходится 90% небелкового азота крови вместо 50% в норме. Внепочечные в свою очередь подразделяются на надпочечные (результат нарушений гемодинамики и падения фильтрационного давления при сердечно-сосудистой недостаточности, снижении артериального давления) и подпочечные (при гипертрофии или аденоме простаты, почечнокаменной болезни - наличие препятствия оттоку мочи после ее образования в почке).
Продукционная азотемия развивается при избыточном поступлении азотсодержащих продуктов в кровь, как следствие усиленного распада тканевых белков при обширных воспалениях, ранениях, ожогах, кахексии и др. Нередко наблюдаются азотемии смешанного типа.
Уреми́я (от греч. uron—моча и haima— кровь), — острое или хроническое самоотравление организма, обусловленное почечной недостаточностью; накопление в крови главным образом токсических продуктов азотистого обмена (азотемия), нарушения кислотно-щелочного и осмотического равновесия.
Проявления: вялость, головная боль, рвота, диарея, кожный зуд, судороги, кома и др.
45. Основные биохимические функции и особенности печени.
Печень – самый крупный орган в организме человека, состоит примерно из 300 млрд клеток, 80% из которых составляют гепатоциты. Масса печени достигает 1,5 кг, что составляет 2-3% от массы тела взрослого человека. На печень приходится от 20 до 30% потребляемого организмом кислорода. Клетки печени занимают центральное место в реакциях промежуточного метаболизма и поддержании гомеостаза крови. Поэтому в биохимическом отношении гепатоциты являются как бы прототипом всех остальных клеток. Такие разнообразные функции обусловлены особенностями строения печени и ее отдельных клеток. Гепатоцит имеет хорошо развитую систему эндоплазматического ретикулума (ЭР), причем как гладкую, так и шероховатую. Одна из главных функций ЭР - синтез белков, которые используются другими органами и тканями (альбумины), или ферментов работающих в печени. Кроме того, в ЭР синтезируются фосфолипиды, триглицериды и холестерол. Гладкий ЭР содержит ферменты детоксикации ксенобиотиков.
Функции печени: 1. Пищеварительная – печень является крупнейшей пищеварительной железой. Она образует желчь, включающую воду (82%), желчные кислоты (12%), фосфатидилхолин (4%), холестерол (0,7%), прямой билирубин, белки, продукты распада стероидных гормонов, электролиты и другие соединения крови, лекарственные средства и их метаболиты. Желчь обеспечивает эмульгирование и переваривание жиров пищи, стимулирует перистальтику кишечника. Из крови воротной вены желчные кислоты поглощаются симпортом с ионами Na+. В желчный капилляр синтезированные de novo и используемые вторично желчные кислоты секретируются АТФ-зависимым транспортом.
2. Экскреторная функция, близка к пищеварительной – с помощью желчи выводятся билирубин, немного креатинина и мочевины, ксенобиотики и продукты их обезвреживания, холестерол. Последний выводится из орг-ма только в составе желчи.
3. Секреторная – печень осуществляет биосинтез и секрецию в кровь альбумина и некоторых белков других фракций, белков свертывающей системы, липопротеинов, глюкозы, кетоновых тел, 25-оксикальциферола, креатина.
4. Депонирующая – здесь находится место депонирования энергетических резервов гликогена, накапливаются минеральные вещества, особенно железо, витамины A, D, K, B12 и фолиевая кислота.
5 .Метаболическая
функция
- Печень, являясь центральным органом
метаболизма, участвует в поддержании
метаболического гомеостаза и способна
осуществлять взаимодействие реакций
обмена белков, жиров и углеводов.
.Метаболическая
функция
- Печень, являясь центральным органом
метаболизма, участвует в поддержании
метаболического гомеостаза и способна
осуществлять взаимодействие реакций
обмена белков, жиров и углеводов.
* Углеводный обмен. В гепатоцитах активно протекают процессы углеводного обмена. Благодаря синтезу и распаду гликогена печень поддерживает конц-ию глюкозы в крови. Активный синтез гликогена происходит после приема пищи. Запасы гликогена в печени составляют от 30 до 100 г. При кратковременном голодании происходит гликогенолиз, в случае длительного голодания основным источником глюкозы крови является глюконеогенез из АК и глицерина. Печень осуществляет превращение гексоз (фруктозы, галактозы) в глюкозу. Активные р-ии ПФ пути обеспечивают наработку НАДФН, необх-го для микросомального ок-ия и синтеза ж к-т и холестерола из глюкозы.
* Липидный обмен. Если во время приема пищи в печень поступает избыток глюкозы, который не используется для синтеза гликогена и других синтезов, то она превращается в липиды – холестерол и триацилглицеролы. Поскольку запасать ТАГ печень не может, то их удаление происходит при помощи ЛПОНП. Холестерол используется, в первую очередь, для синтеза желчных к-т, также он вк-ся в состав ЛПНП и ЛПОНП. При опред-х условиях–голодание, длительная мышечная нагрузка,сахарный диабет I типа, богатая жирами диета–в печени акт-ся синтез кетоновых тел, исп-ых большинством тканей как альтернативный источник Е.
* Белковый обмен. Больше половины синтезируемого за сутки в организме белка приходится на печень. Скорость обновления всех белков печени составляет 7 суток, тогда как в других органах эта величина соответствует 17 суткам и более. К ним относятся не только белки собственно гепатоцитов, но и идущие на "экспорт" – альбумины, многие глобулины, ферменты крови, а также фибриноген и факторы свертывания крови. АК подвергаются катаболическим реакциям с трансаминированием и дезаминированием, декарбоксилированию с образованием биогенных аминов. Происходят реакции синтеза холина и креатина благодаря переносу метильной группы от аденозилметионина. В печени идет утилизация избыточного N и включение его в состав мочевины. Реакции синтеза мочевины теснейшим образом связаны с циклом трикарбоновых к-т.
* Пигментный обмен. Участие печени в пигментном обмене заключается в превращении гидрофобного билирубина в гидрофильную форму и секреция его в желчь. Пигментный обмен, в свою очередь, играет важную роль в обмене Fe в орг-ме – в гепатоцитах находится железосодержащий белок ферритин.
6. Обезвреживающая функция - биотрансформации в печени подвергаются следующие в-ва: а) стероидные и тиреоидные гормоны, инсулин, адреналин, б) продукты распада гемопротеинов (билирубин), в) продукты жизнед-ти микрофлоры, всасывающихся из толстого кишечника – кадаверин (производное лизина), путресцин (производное аргинина), крезол и фенол (производное фенилаланина и тирозина) и других токсинов, г)ксенобиотики (токсины, лекарственные вещества и их метаболиты). В целом все р-ии биотрансформации делят на 2 группы или фазы: реакции 1 фазы – р-ии превр-ия исходного в-ва в более полярный метаболит путем введения или раскрытия функ-ой группы (‑ОН, ‑NH2, ‑SH). Эти метаболиты часто неактивны, хотя в некоторых случаях активность не исчезает, а только изм-ся. Если эти метаболиты достаточно полярны, они могут легко экскретироваться, реакции 2 фазы – отличительным признаком этой фазы являются р-ии конъюгации с глюкуроновой, серной, уксусной к-ми, с глутатионом или АКми.
46. Взаимосвязь обмена жиров, углеводов и белков.
Живой организм и его функционирование находятся в постоянной зависимости от окружающей среды. Интенсивность обмена с внешней средой и скорость внутриклеточных процессов обмена веществ поддерживают постоянство внутренней среды и целостность организма. Как было указано, обмен веществ в организме человека протекает не хаотично; он интегрирован и тонко настроен. Все превращения органических веществ, процессы анаболизма и катаболизма тесно связаны друг с другом. В частности, процессы синтеза и распада взаимосвязаны, координированы и регулируются нейрогормональными механизмами, придающими химическим процессам нужное направление. В организме человека, как и в живой природе вообще, не существует самостоятельного обмена белков, жиров, углеводов и нуклеиновых кислот. Все превращения объединены в целостный процесс метаболизма, подчиняющийся диалектическим закономерностям взаимозависимости и взаимообусловленности, допускающий также взаимопревращения между отдельными классами органических веществ. Подобные взаимопревращения диктуются физиологическими потребностями организма, а также целесообразностью замены одних классов органических веществ другими в условиях блокирования какого-либо процесса при патологии. В настоящее время экспериментально обосновано существование четырех главных этапов распада молекул углеводов, белков и жиров, которые интегрируют образование энергии из основных пищевых источников. На I этапе полисахариды расщепляются до моносахаридов (обычно гексоз); жиры распадаются на глицерин и высшие жирные кислоты, а белки – на составляющие их свободные аминокислоты. Следует подчеркнуть, что указанные процессы в основном являются гидролитическими, поэтому освобождающаяся в небольшом количестве энергия почти целиком используется организмами в качестве тепла.
На II этапе мономерные молекулы (гексозы, глицерин, жирные кислоты и аминокислоты) подвергаются дальнейшему распаду, в процессе которого образуются богатые энергией фосфатные соединения и ацетил-КоА. В частности, при гликолизе гексозы расщепляются до пировиноград-ной кислоты и далее до ацетил-КоА. Этот процесс сопровождается образованием ограниченного числа богатых энергией фосфатных связей путем субстратного фосфорилирования. На этом этапе высшие жирные кислоты аналогично распадаются до ацетил-КоА, в то время как глицерин окисляется по гликолитическому пути до пировиноградной кислоты и далее до ацетил-КоА. Для аминокислот ситуация на II этапе несколько отлична. При преимущественном использовании аминокислот в качестве источника энергии (при дефиците углеводов или при сахарном диабете) некоторые из них непосредственно превращаются в метаболиты лимоннокислого цикла (глутамат, аспартат), другие – опосредованно через глутамат (пролин, гистидин, аргинин), третьи – в пируват и далее в ацетил-КоА (аланин, серин, глицин, цистеин). Наконец, ряд аминокислот, в частности лейцин, изо-лейцин, расщепляется до ацетил-КоА, а из фенилаланина и тирозина, помимо ацетил-КоА, образуется оксалоацетат через фумаровую кислоту. Как видно, II этап можно назвать этапом образования ацетил-КоА, являющегося по существу единым (общим) промежуточным продуктом катаболизма основных пищевых веществ в клетках.
На III этапе ацетил-КоА (и некоторые другие метаболиты, например α-кетоглутарат, оксалоацетат) подвергаются окислению («сгоранию») в цикле ди- и трикарбоновых кислот Кребса. Окисление сопровождается образованием восстановленных форм НАДН + Н+ и ФАДН2.
На IV этапе осуществляется перенос электронов от восстановленных нуклеотидов на кислород (через дыхательную цепь). Он сопровождается образованием конечного продукта – молекулы воды. Этот транспорт электронов сопряжен с синтезом АТФ в процессе окислительного фосфорилирования.
Помимо взаимных переходов между разными классами веществ в организме, доказано существование более сложных форм связи. В частности, интенсивность и направление любой химической реакции определяются ферментами, т.е. белками, которые оказывают непосредственное влияние на обмен липидов, углеводов и нуклеиновых кислот. В свою очередь синтез любого белка-фермента требует участия ДНК и всех 3 типов рибонуклеиновых кислот: тРНК, мРНК и рРНК. Если к этому добавить влияние гормонов, а также продуктов распада какого-либо одного класса веществ (например, биогенных аминов) на обмен других классов органических веществ, то становятся понятными удивительная согласованность и координированность огромного разнообразия химических процессов, совершающихся в организме.
П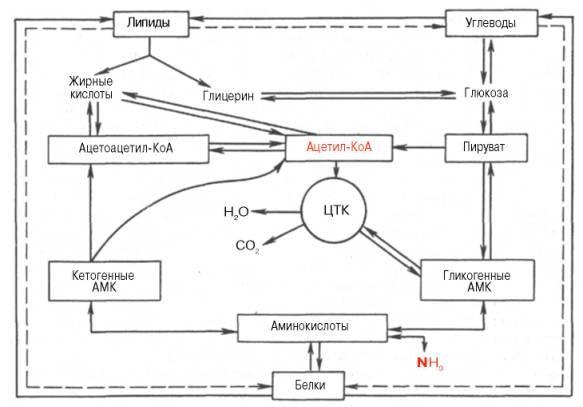 омимо
прямых переходов метаболитов этих
классов веществ друг в друга, существует
тесная энергетическая связь, когда
энергетические потребности могут
обеспечиваться окислением какого-либо
одного класса органических веществ при
недостаточном поступлении с пищей
других. Важность белков (в частности,
ферментов, гормонов и др.) в обмене всех
типов химических соединений слишком
очевидна и не требует доказательств.
Ранее было отмечено большое значение
белков и аминокислот для синтеза ряда
специализированных соединений (пуриновые
и пиримиди-новые нуклеотиды, порфирины,
биогенные амины и др.). Кетогенные
аминокислоты, образующие в процессе
обмена ацетоуксусную кислоту
(ацетоацетил-КоА), могут непосредственно
участвовать в синтезе жирных кислот и
стеринов. Аналогично могут использоваться
гликогенные аминокислоты через
ацетил-КоА, но после предварительного
превращения в пируват. Некоторые
структурные компоненты специализированных
липидов, в частности фосфоглицеринов,
имеют своим источником аминокислоты и
их производные, например серин, этаноламин,
сфингозин и холин. Необходимо подчеркнуть,
что превращение углеродных скелетов
кетогенных или гликогенных аминокислот
в жирные кислоты является необратимым
процессом, хотя нельзя исключить
возможности частичного синтеза глутамата
и опосредованно других аминокислот из
продуктов распада жирных кислот –
ацетил-КоА – через цикл трикарбоновых
кислот, включающий α-кетоглутарат. В то
же время из глицерина нейтральных жиров
через пируват полностью осуществляется
синтез углеродных скелетов некоторых
гликогенных АК.
омимо
прямых переходов метаболитов этих
классов веществ друг в друга, существует
тесная энергетическая связь, когда
энергетические потребности могут
обеспечиваться окислением какого-либо
одного класса органических веществ при
недостаточном поступлении с пищей
других. Важность белков (в частности,
ферментов, гормонов и др.) в обмене всех
типов химических соединений слишком
очевидна и не требует доказательств.
Ранее было отмечено большое значение
белков и аминокислот для синтеза ряда
специализированных соединений (пуриновые
и пиримиди-новые нуклеотиды, порфирины,
биогенные амины и др.). Кетогенные
аминокислоты, образующие в процессе
обмена ацетоуксусную кислоту
(ацетоацетил-КоА), могут непосредственно
участвовать в синтезе жирных кислот и
стеринов. Аналогично могут использоваться
гликогенные аминокислоты через
ацетил-КоА, но после предварительного
превращения в пируват. Некоторые
структурные компоненты специализированных
липидов, в частности фосфоглицеринов,
имеют своим источником аминокислоты и
их производные, например серин, этаноламин,
сфингозин и холин. Необходимо подчеркнуть,
что превращение углеродных скелетов
кетогенных или гликогенных аминокислот
в жирные кислоты является необратимым
процессом, хотя нельзя исключить
возможности частичного синтеза глутамата
и опосредованно других аминокислот из
продуктов распада жирных кислот –
ацетил-КоА – через цикл трикарбоновых
кислот, включающий α-кетоглутарат. В то
же время из глицерина нейтральных жиров
через пируват полностью осуществляется
синтез углеродных скелетов некоторых
гликогенных АК.
Продукты гидролиза пищевых и тканевых триацилглицеролов, в частности высшие жирные кислоты, участвуют непосредственно в образовании сложных белков – липопротеинов плазмы крови. В составе липопротеинов, являющихся, таким образом, транспортной формой жирных кислот, они доставляются в органы-мишени, в которых жирные кислоты служат или источником энергии (сердечная и поперечно-полосатая мускулатура), или предшественниками синтеза тканевых триацилглицеролов с последующим их отложением в клетках ряда органов (депо липидов).
Получены доказательства синтеза глюкозы из большинства аминокислот. Для некоторых аминокислот (аланин, аспарагиновая и глутами-новая кислоты) связь с глюконеогенезом является непосредственной, для других она осуществляется через побочные метаболические пути. Следует особо подчеркнуть, что три α-кетокислоты (пируват, оксалоацетат и кето-глутарат), образующиеся соответственно из аланина, аспартата и глу-тамата, не только служат исходным материалом для синтеза глюкозы, но являются своеобразными кофакторами при распаде ацетильных остатков всех классов пищевых веществ в цикле Кребса для получения энергии.
Синтез незаменимых аминокислот из продуктов обмена углеводов и жиров в организме животных отсутствует. Клетки животных не содержат ферментных систем, катализирующих синтез углеродных скелетов этих аминокислот. В то же время организм может нормально развиваться исключительно при белковом питании, что также свидетельствует о возможности синтеза углеводов из белков. Процесс синтеза углеводов из аминокислот получил название глюконеогенеза. Он доказан прямым путем в опытах на животных с экспериментальным диабетом: более 50% введенного белка превращается в глюкозу. Как известно, при диабете организм теряет способность утилизировать глюкозу, и энергетические потребности покрываются за счет окисления аминокислот и жирных кислот. Доказано также, что исходными субстратами для глюконеогенеза являются те аминокислоты, распад которых сопровождается образованием прямо или опосредованно пировиноградной кислоты (например, аланин, серин, треонин и цистеин). Более того, имеются доказательства существования в организме своеобразного циклического процесса – глюкозоаланинового цикла, участвующего в тонкой регуляции концентрации глюкозы в крови в тех условиях, когда в период между приемами пищи организм испытывает дефицит глюкозы. Источниками пирувата при этом являются указанные аминокислоты, образующиеся в мышцах при распаде белков и поступающие в печень, в которой они подвергаются дезами-нированию. Образовавшийся аммиак в печени обезвреживается, участвуя в синтезе мочевины, которая выделяется из организма. Дефицит мышечных белков затем восполняется за счет поступления аминокислот пищи.
Энергетическая ценность пищи оказывает определенное влияние на белковый обмен, контролируемый азотистым балансом. Так, если потребляемая энергия пищи ниже минимального уровня, то наблюдается увеличение экскреции азота, и, наоборот, при увеличении энергетической ценности пищи экскреция азота с мочой снижается.
М ежду
циклом лимонной кислоты и орнитиновым
циклом мочевино-образования имеются
сложные связи, определяющие в известной
степени скорость реакций, зависимую от
энергетических потребностей клетки и
концентраций конечных продуктов
метаболизма. Фумаровая кислота образуется
в процессе распада аргинино-янтарной
кислоты, синтез которой в свою очередь
требует наличия аминокислоты аспартата.
Образовавшаяся фумаровая кислота (из
предшественника аминокислоты аспартата)
далее вступает в цикл лимонной кислоты
и под действием двух ферментов этого
цикла: фумаратгидратазы и малат-дегидрогеназы
– превращается в оксалоацетат, который
при участии специфической трансаминазы
вновь превращается в аспартат, т.е.
получается своеобразный
аспартат-аргининоянтарный шунт цикла
лимонной кислоты, соединенного с циклом
мочевинообразования. Т.о., при помощи
этого необычного сцепленного механизма
происходит переплетение реакций обоих
циклов (мочевинообразования и ди- и
трикар-боновых кислот). Этот механизм
получил название «велосипед Кребса».
ежду
циклом лимонной кислоты и орнитиновым
циклом мочевино-образования имеются
сложные связи, определяющие в известной
степени скорость реакций, зависимую от
энергетических потребностей клетки и
концентраций конечных продуктов
метаболизма. Фумаровая кислота образуется
в процессе распада аргинино-янтарной
кислоты, синтез которой в свою очередь
требует наличия аминокислоты аспартата.
Образовавшаяся фумаровая кислота (из
предшественника аминокислоты аспартата)
далее вступает в цикл лимонной кислоты
и под действием двух ферментов этого
цикла: фумаратгидратазы и малат-дегидрогеназы
– превращается в оксалоацетат, который
при участии специфической трансаминазы
вновь превращается в аспартат, т.е.
получается своеобразный
аспартат-аргининоянтарный шунт цикла
лимонной кислоты, соединенного с циклом
мочевинообразования. Т.о., при помощи
этого необычного сцепленного механизма
происходит переплетение реакций обоих
циклов (мочевинообразования и ди- и
трикар-боновых кислот). Этот механизм
получил название «велосипед Кребса».
Имеются различные пути взаимопревращений жиров и углеводов. Практика откорма сельскохозяйственных животных давно подтвердила возможность синтеза жиров из углеводов пищи. С энергетической точки зрения, превращение углеводов в жиры следует рассматривать как накопление и депонирование энергии, хотя синтез жира сопровождается затратой энергии, которая вновь освобождается при окислении жиров в организме. Глицерин, входящий в состав триацилглицеролов и фосфоглицеринов, может легко образоваться из промежуточных метаболитов гликолиза, в частности из глицераль-дегид-3-фосфата. Следует, однако, подчеркнуть, что основным путем превращения углеводов в жиры является путь образования высших жирных кислот из ацетил-КоА, который образуется при окислительном декар-боксилировании пирувата. Последняя реакция практически необратима, поэтому образования углеводов из высших жирных кислот почти не происходит. Таким образом, синтез углеводов из жиров в принципе может происходить только из глицерина, хотя в обычных условиях реакция протекает в обратную сторону, т.е. в сторону синтеза жиров из глицерина, образующегося при окислении углеводов. Ацетил-КоА, образующийся в процессе обмена углеводов, жиров и ряда аминокислот, служит пусковым субстратом как для синтеза жирных кислот (а следовательно, и липидов вообще), так и для цикла трикарбоновых кислот. Для окисления ацетил-КоА в этом цикле требуется оксалоацетат, который является вторым ключевым субстратом в цикле Кребса. Оксалоацетат может синтезироваться из пировиноградной кислоты и СО2 благодаря реакции карбокси-лирования или образоваться из аспарагиновой кислоты в процессе транс-аминирования с α-кетоглутаратом. Две молекулы ацетил-КоА, конденсируясь, образуют ацетоуксусную кислоту (ацетоацетат), которая является источником других кетоновых тел в организме, в частности β-оксимасляной кислоты (β-оксибутирата) и ацетона. Следует подчеркнуть, что ацетоуксусная и β-оксимасляная кислоты часто рассматриваются как транспортные формы активной уксусной кислоты, доставляющие ее для окисления в цикле Кребса в периферических тканях. Эти же реакции конденсации двух молекул ацетил-КоА составляют начальные этапы синтеза холестерина, в свою очередь являющегося предшественником гормонов стероидной природы, витамина D3, а также желчных кислот. Последние в виде парных желчных кислот выполняют важную функцию эмульгаторов при переваривании липидов пищи в кишечнике, а также функцию транспортеров, способствуя всасыванию высших жирных кислот. Следует указать также на использование галактозы и частично глюкозы для биосинтеза цереброзидов и гликолипидов, выполняющих важные и специфические функции в деятельности ЦНС. В этом синтезе участвуют не свободные моносахариды, а гексозамины (галактозамин и глюкозамин), биосинтез которых в свою очередь требует доставки амидного азота глутамина, интегрируя тем самым обмен углеводов, липидов и белков.
Движущей силой во взаимопревращениях веществ и интенсивности метаболизма является энергетическое состояние клетки, в частности уровень АТФ (точнее, отношение АМФ/АТФ). Так, при низких концентрациях АМФ и высоких концентрациях АТФ (состояние, которое принято обозначать «энергонасыщенностью») в клетках происходит резкое снижение глико-литического распада глюкозы, обусловленное действием этих нуклеотидов на ключевой фермент гликолиза – фосфофруктокиназу и на фосфатазу фруктозо-6-фосфата. В результате в клетках накапливается не только фруктозо-6-фосфат, но и его предшественник – глюкозо-6-фосфат. Последний, являясь положительным модулятором фермента гликогенсинтазы, стимулирует синтез полисахарида – гликогена. При низких концентрациях АТФ (соответственно при высоком уровне АМФ) в клетках отмечаются стимулирование гликолиза и окисление пирувата в лимоннокислом цикле, что способствует обеспечению клеток энергией. Однако при низких концентрациях АМФ имеет место снижение скорости цикла трикарбоновых кислот, обусловленное торможением активности изоцитратдегидрогеназы, соответственно наблюдается снижение скорости синтеза АТФ и накопление изолимонной кислоты. Последняя, как известно, повышает активность другого фермента – ацетил-КоА-карбоксилазы, которая в свою очередь катализирует I стадию превращения ацетил-КоА в жирную кислоту. Благодаря этим обстоятельствам клетка переводит образовавшуюся при гликолизе молекулу ацетил-КоА с энергетического пути на путь синтеза липидов и их отложения в депо. В то же время при восстановлении скорости утилизации АТФ, что обычно наблюдается при синтезе жирных кислот, соответствующее повышение уровня АМФ способствует снижению концентрации лимонной кислоты и соответственно торможению синтеза липидов.
Т.о., скорость распада одних питательных веществ и биосинтеза других прежде всего определяется физиологическим состоянием и потребностями организма в энергии и метаболитах. Благодаря динамичности и координации метаболической активности обеспечивается макро- и микроскопическое постоянство всех форм живого.
47. Биохимия регуляций. Основные принципы и значение. Иерархия регуляторных систем. Классификация межклеточных регуляторов. Центральная регуляция эндокринной системы: роль либеринов, статинов и тропинов.
Задача регуляторных систем — сохранение гомеостаза. Обязательным для регуляции является наличие прямых и обратных связей между регулятором и регулируемым объектом. С помощью этих связей осуществляется интеграция и координация. Интеграция — это объединение элементов системы в единое целое. Координация (соподчинение) — это подчинение менее важных элементов системы более важным элементам. Интеграция и координация — это две стороны процесса регуляции. Различают:1.Внутриклеточную регуляцию (ауторегуляцию).2.Дистантную регуляцию (межклеточную).
Механизмы клеточной ауторегуляции: 1.Компартментализация (мембранный механизм).Роль мембран состоит в следующем:а)мембраны делят клетки на отсеки и в каждом из них осуществляются свои процессы;б)мембраны обеспечивают активный транспорт и регулируют потоки молекул в клетке и из клетки;в)в мембраны встроены ферменты;г)мембраны защищают клетку от внешних воздействий. Воздействием на функции мембран клетка может регулировать тот или иной процесс.
2.Изменение активности ферментов
3.Изменение количества ферментов.
Классификация межклеточных регуляторов 1.Анатомо-физиологическая:
а)Гормоны — межклеточные регуляторы, доставляемые к клеткам-мишеням током крови. Вырабатываются в эндокринныхжелезах или рассеянных железистых клетках.
б)Нейрогормоны вырабатываются нервными клетками и выделяются в синаптическую щель, то есть в непосредственной близости от клетки-мишени. Нейрогормоны делятся на медиаторы и модуляторы. Медиаторы обладают непосредственным пусковым эффектом. Модуляторы изменяют эффект медиаторов. Примерами медиаторов являются ацетилхолин и норадреналин; модуляторов — у-аминомасляная кислота, дофамин.
в) Локальные гормоны - это межклеточные регуляторы, действующие на близлежащие к месту их синтеза клетки. Пример: гормоны,-производные жирных кислот.
2.Классификация по широте действия:
а) Гормоны универсального действия действуют на все ткани организма (например, катехоламины, глюкокортикостероиды).
б)Гормоны направленного действия действуют на определенные органы-мишени (например, АКТГ действует на кору надпочечников).
3.Классификация по химическому строению:
а)Белково-пептидные гормоны: Олигопептиды (кинины, АДГ), Полипептиды (АКТГ, глюкагон), Белки (СТГ, ТТГ, ПТ}
б )Производные
аминокислот: Катехоламины и йодтиронины
— образуются из тирозина;Ацетилхолин
— образуется из серина; Серотонин,
триптамин, мелатонин — образуются из
триптофана.
)Производные
аминокислот: Катехоламины и йодтиронины
— образуются из тирозина;Ацетилхолин
— образуется из серина; Серотонин,
триптамин, мелатонин — образуются из
триптофана.
в)Липидные гормоны: стероидные гормоны (гормоны коры надпочечников и половые гормоны); производные полиненасыщенных жирных кислот (простагландины, тромбоксаны, лейкотриены).
У
многоклеточных существ всегда стоит
задача обеспечения взаимосвязи разных
органов и баланса их активности. Поэтому
большинство гормональных систем
взаимосвязаны между собой и регулируются
в соответствии с иерархической лестницей.
У высших животных верхнюю часть лестницы
занимает система гормонов гипоталамуса,
контролируемая центральной нервной
системой. Сигналы, получаемые от органов,
принимаются и обрабатываются, после
чего клетки гипоталамуса отвечают при
помощи специфических сигнальных молекул
– рилизинг-факторов. На стимулирующие
или тормозящие стимулы из ЦНС секретируются
стимулирующие или ингибирующие
рилизинг-факторы, которые носят название
либерины или с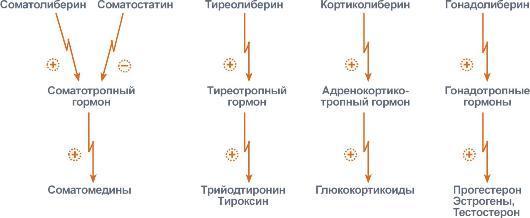 татины
соответственно. Эти нейрогормоны с
кровотоком достигают аденогипофиза,
где стимулируют (либерины) или ингибируют
(статины) биосинтез и секрецию тропных
гормонов.
татины
соответственно. Эти нейрогормоны с
кровотоком достигают аденогипофиза,
где стимулируют (либерины) или ингибируют
(статины) биосинтез и секрецию тропных
гормонов.
Тропные гормоны воздействуют на периферические железы, стимулируя выделение соответствующих периферических гормонов. К подобным системам относятся группы гормонов тиреоидной функции, глюкокортикоидной функции и профиль половых гормонов. Регуляция этих систем осуществляется по принципу обратной отрицательной связи, т.е. накопление гормонов периферических желез тормозит секрецию рилизинг-факторов гипоталамуса и тропных гормонов гипофиза. Наиболее клинически значимо это проявляется в отношении регуляции стероидных гормонов. Подавляющее действие на активность эндокринных желез может оказывать и результат ответа клеток-мишеней.
Существуют эндокринные железы для которых отсутствует регуляция тропными гормонами – паращитовидная железа, мозговое вещество надпочечников, ренин-альдостероновая система и поджелудочная железа. Они контролируются нервными влияниями или концентрацией определенных веществ в крови.
Семейство гипоталамических гормонов – рилизинг-факторов – включает вещества, как правило небольшие пептиды, образующиеся в ядрах гипоталамуса. Их функция – регуляция секреции гормонов аденогипофиза: стимулирование – либерины и подавление – статины.
Доказано существование семи либеринов и трех статинов.
Тиреолиберин – является трипептидом, стимулирует секрецию тиреотропного гормона и пролактина, также проявляет свойства антидепрессанта.
Кортиколиберин – полипептид из 41 аминокислоты, стимулирует секрецию АКТГ и ?-эндорфина, широко влияет на деятельность нервной, эндокринной, репродуктивной, сердечно-сосудистой и иммунной систем.
Гонадолиберин (люлиберин) – пептид из 10 аминокислот, стимулирует высвобождение лютеинизирующего и фолликулостимулирующего гормонов. Гонадолиберин присутствует также в гипоталамусе, участвуя в центральной регуляции полового поведения.
Фоллиберин – стимулирует высвобождение фолликулостимулирующего гормона.
Пролактолиберин – стимулирует секрецию лактотропного гормона.
Пролактостатин – предполагается, что он является дофамином. Снижает синтез и секрецию лактотропного гормона.
Соматолиберин состоит из 44 аминокислот и повышает синтез и секрецию гормона роста.
Соматостатин – пептид из 12 аминокислот, ингибирующий секрецию ТТГ, пролактина, АКТГ и СТГ из гипофиза. Он образуется также в островках поджелудочной железы и контролирует высвобождение глюкагона и инсулина, а также гормонов желудочно-кишечного тракта.
Меланостимулирующий фактор, пентапептид, оказывает стимулирующее действие на синтез меланотропного гормона.
Меланостатин, может быть как три-, так и пентапептидом, обладает антиопиоидным эффектом и активностью в поведенческих реакциях.
Кроме рилизинг-гормонов в гипоталамусе синтезируются также вазопрессин (антидиуретический гормон) и окситоцин.
48. Понятие о рецепторах. Механизм действия гормонов через внутриклеточные рецепторы и рецепторы плазматических мембран и вторые посредники (общая характеристика).
Рецепция и эффект гормона на органы-мишени является основным звеном эндокринной регуляции. Способность гормона к передаче регуляторного сигнала обусловлена наличием в клетках-мишенях специфических рецепторов. Рецепторы в большинстве случаев – белки, преимущественно гликопротеиды, имеющие специфическое фосфолипидное микроокружение. Связывание гормона с рецептором определяется законом действующих масс по кинетике Михаэлиса. При рецепции возможно проявление положительного или отрицательного кооперативных эффектов, когда ассоциация первых молекул гормона с рецептором облегчает или затрудняет связывание последующих. Рецепторный аппарат обеспечивает избирательный прием гормонального сигнала и инициацию специфического эффекта в клетке. Локализация рецепторов в определенной мере обуславливает тип действия гормона. Выделяют несколько групп рецепторов:
1) Поверхностные: при взаимодействии с гормоном меняют конформацию мембран, стимулируя перенос ионов или субстратов в клетку (инсулин, ацетилхолин).
2). Трансмембранные: имеют контактный участок на поверхности и внутримембранную эффекторную часть, связанную с аденилат- или гуанилатциклазой. Образование внутриклеточных мессенджеров – цАМФ и цГМФ – стимулирует специфические протеинкиназы, влияющие на синтез белка, активность ферментов и т.д. (полипептиды, амины).
3) Цитоплазматические: связываются с гормоном и в виде активного комплекса поступают в ядро, где контактируют с акцептором, приводя к усилению синтеза РНК и белка (стероиды).
4) Ядерные: существуют в виде комплекса негистонового белка и хроматина. Контакт с гормоном напрямую включает механизм его действия (гормоны щитовидной железы).
Виды мембраносвязанных рецепторов
1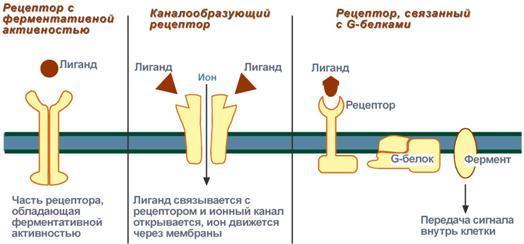 .
Рецепторы, обладающие каталитической
активностью
– при взаимодействии лиганда с рецептором
активируется внутриклеточная часть
(домен) рецептора, имеющий тирозинкиназную
или тирозинфосфатазную или гуанилатциклазную
активность. По этому механизму действуют
СТГ, инсулин, пролактин, интерлейкины,
ростовые факторы, интерфероны α, β, γ.
.
Рецепторы, обладающие каталитической
активностью
– при взаимодействии лиганда с рецептором
активируется внутриклеточная часть
(домен) рецептора, имеющий тирозинкиназную
или тирозинфосфатазную или гуанилатциклазную
активность. По этому механизму действуют
СТГ, инсулин, пролактин, интерлейкины,
ростовые факторы, интерфероны α, β, γ.
2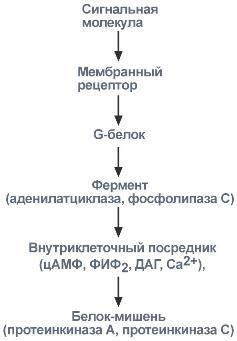 .
Каналообразующие рецепторы
– присоединение лиганда к рецептору
вызывает открытие ионного канала на
мембране. Таким образом действуют
нейромедиаторы (ацетилхолин, глицин,
ГАМК, серотонин, гистамин, глутамат);
.
Каналообразующие рецепторы
– присоединение лиганда к рецептору
вызывает открытие ионного канала на
мембране. Таким образом действуют
нейромедиаторы (ацетилхолин, глицин,
ГАМК, серотонин, гистамин, глутамат);
3. Рецепторы, связанные с G-белками – передача сигнала от гормона происходит при посредстве G-белка. G-белок влияет на ферменты, образующие вторичные мессенджеры (посредники ). Последние передают сигнал на внутриклеточные белки. Большинство гормонов действуют по данному механизму. К третьему виду относятся аденилатциклазный и кальций-фосфолипидный механизмы.
Величина эффекта гормона зависит от концентрации гормонального рецептора, поступающего к клеткам-мишеням, от числа специфических рецепторов, степени их сродства и избирательности к гормону. На величину эффекта может влиять действие других гормонов, как антагонистическое (инсулин и глюкокортикоиды разнонаправленно действуют на поступление глюкозы в клетку), так и потенцирующее (глюкокортикоиды усиливают влияние катехоламинов на сердце и мозг). Изучение функционирования рецепторного аппарата актуально в клинике, особенно при сахарном диабете, вызванном рецепторной инсулинорезистентностью, при синдроме тестикулярной феминизации или определении гормон-чувствительных опухолей молочной железы.
Гормоны оказывают свое действие, связываясь со специфическими рецепторами, располагающимися либо на поверхности мембраны клетки, либо в цитозоле. Связывание с рецепторами - обязательный этап в действии гормона. Белково-пептидные гормоны и гормоны-производные аминокислот являются гидрофильными веществами и проникновение их через плазматическую мембрану, состоящую из липидного бислоя, затруднено или невозможно. Рецепторы таких гормонов находятся на наружной поверхности плазматической мембраны. Гормоны связываются с рецепторными белками тех участков мембран клеток-мишеней, которые соприкасаются с кровью, что в свою очередь активирует ферментную систему, отвечающую за образование вторичного (внутриклеточного) посредника.
Рецепторы, находящиеся на клеточной мембране. Гормоны (первичные посредники), связываясь с рецепторами на поверхности клеточной мембраны, образуют комплекс гормон-рецептор, который трансформирует сигнал первичного посредника в изменение концентрации особых молекул внутри клетки - вторичных посредников. Вторичными посредниками могут быть следующие молекулы: цАМФ, цГМФ, ИФ3, ДАТ, Са2+, NO.
В этом случае гормон не проникает в клетку, а взаимодействует с рецептором на поверхности мембраны. Далее возможны два варианта событий:
1.Первый вариант — с рецептором связан фермент, который из специфического субстрата образует второй посредник. Второй посредник далее связывается со своим рецептором в клетке. Чаще всего рецептором посредника является протеинкиназа, которая за счет фосфата АТФ, фосфорилирует белки. В результате изменяются их свойства, возникает биохимический и физиологический эффект.
2.Второй вариант — рецептор связан не с ферментом мембраны, а с ионным каналом. При связывании гормона с рецептором, канал открывается, ион поступает в клетку и выполняет функции второго посредника. Хорошо изученными вторыми посредниками являются циклические нуклеотиды (цАМФ, цГМФ) и Са2+.
мембранный механизм - когда гормон связывается с рецептором на поверхности наружной мембраны клетки-мишени;
Гормоны обладающие мембранным механизмом действия:
1) все белковые и пептидные гормоны, а также амины (адреналин, норадреналин).
Гормоны оказывают влияние на клетки-мишени.
Клетки-мишени - это клетки, которые специфически взаимодействуют с гормонами с помощью специальных белков-рецепторов. Эти белки-рецепторы располагаются на наружной мембране клетки, или в цитоплазме, или на ядерной мембране и на других органеллах клетки.
Биохимические механизмы передачи сигнала от гормона в клетку-мишень.
Любой белок-рецептор состоит, минимум из двух доменов (участков), которые обеспечивают выполнение двух функций: 1) узнавание гормона; 2) преобразование и передачу полученного сигнала в клетку. Один из доменов белка-рецептора имеет в своем составе участок, комплементарный какой-то части сигнальной молекулы. Процесс связывания рецептора с сигнальной молекулой похож на процесс образования фермент-субстратного комплекса и может определяется величиной константы сродства. Между молекулой гормона и рецептором формируются электростатические и гидрофобные взаимодействия. При связывании рецептора с гормоном происходят конформационные изменения белка-рецептора и комплекс сигнальной молекулы с белком-рецептором активируется.
Механизмы действия гормонов на клетки-мишени В зависимости от строения гормона существуют два типа взаимодействия. Если молекула гормона липофильна, (например, стероидные гормоны), то она может проникать через липидный слой наружной мембраны клеток-мишеней. Если молекула имеет большие размеры или является полярной, то ее проникновение внутрь клетки невозможно. Поэтому для липофильных гормонов рецепторы находятся внутри клеток-мишеней, а для гидрофильных - рецепторы находятся в наружной мембране.
Для получения клеточного ответа на гормональный сигнал в случае гидрофильных молекул действует внутриклеточный механизм передачи сигнала. Это происходит с участием веществ, которых называют вторыми посредниками. Молекулы гормонов очень разнообразны по форме, а "вторые посредники" - нет. Надежность передачи сигнала обеспечивает очень высокое сродство гормона к своему белку-рецептору.
Что такое посредники, которые участвуют во внутриклеточной передаче гуморальных сигналов?
Э то
циклические нуклеотиды (цАМФ и цГМФ),
инозитолтрифосфат, кальций-связывающий
белок - кальмодулин, ионы кальция,
ферменты, участвующие в синтезе
циклических нуклеотидов, а также
протеинкиназы - ферменты фосфорилирования
белков. Все эти вещества участвуют в
регуляции активности отдельных ферментных
систем в клетках-мишенях. Существует
два главных способа передачи сигнала
в клетки-мишени от сигнальных молекул
с мембранным механизмом действия:
то
циклические нуклеотиды (цАМФ и цГМФ),
инозитолтрифосфат, кальций-связывающий
белок - кальмодулин, ионы кальция,
ферменты, участвующие в синтезе
циклических нуклеотидов, а также
протеинкиназы - ферменты фосфорилирования
белков. Все эти вещества участвуют в
регуляции активности отдельных ферментных
систем в клетках-мишенях. Существует
два главных способа передачи сигнала
в клетки-мишени от сигнальных молекул
с мембранным механизмом действия:
1) аденилатциклазная (или гуанилатциклазная) системы;2) фосфоинозитидный механизм.
Аденилатциклазная система.
Циклический АМФ (циклоАМФ, цАМФ) образуется в клетке, когда действуют гормоны гипофиза (ТТГ, ЛГ, МСГ, ФСГ. АКТГ), кальцитонин, соматостатин, глюкагон, паратгормон, адреналин (через α2- и β-адренорецепторы), вазопрессин (через V2-рецепторы). Этапы передачи сигнала:
1) Взаимодействие лиганда с рецептором приводит к изменению конформации последнего.
2)Это изменение передается на G-белок, который состоит из трех субъединиц (α, β и γ), α-субъединица связана с ГДФ.В составе G-белков α-субъединицы бывают 2х типов по отношению к аденилатциклазе: активирующие αS и ингибирующие αI.
3)В результате взаимодействия с рецептором β- и γ-субъединицы отщепляются, одновременно на α-субъединице ГДФ заменяется на ГТФ.
4)Активированная таким образом αS-субъединица стимулирует аденилатциклазу, которая начинает синтез цАМФ.
Если в действо была вовлечена αI-субъединица – она ингибирует аденилатциклазу, все останавливается.
5) Циклический АМФ – вторичный мессенджер – в свою очередь, взаимодействует с протеинкиназой А и активирует ее. Протеинкиназа А фосфорилирует ряд ферментов, среди которых киназа фосфорилазы гликогена, гликогенсинтаза, ТАГ-липаза.
6)Наработка цАМФ продолжается некоторое время, пока α-субъединица, которая является ГТФ-азой, отщепляет фосфат от ГТФ.
7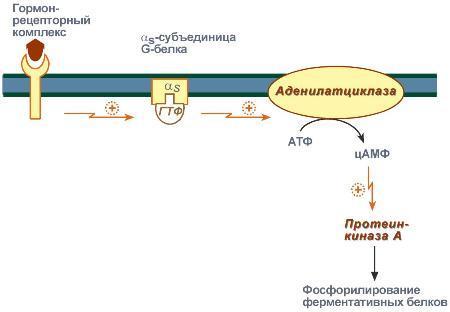 )
Как только ГТФ превратился в ГДФ, то
α-субъединица инактивируется, теряет
свое влияние на аденилатциклазу, обратно
соединяется с β- и γ-субъединицами. Все
возвращается в исходное положение.
)
Как только ГТФ превратился в ГДФ, то
α-субъединица инактивируется, теряет
свое влияние на аденилатциклазу, обратно
соединяется с β- и γ-субъединицами. Все
возвращается в исходное положение.
8)Гормон отрывается от рецептора еще раньше:
- если концентрация гормона в крови велика, то следующая его молекула присоединится к рецептору через малый промежуток времени и повторный запуск АЦ-механизма произойдет быстро – в клетке активируются соответствующие процессы.
- если гормона в крови мало – для клетки наступает некоторая пауза, изменения метаболизма нет. Механизм наработки цАМФ связан с активацией фермента аденилатциклазы и называется аденилатциклазный механизм.
Гормоны, для которых циклический АМФ служит в качестве вторичного медиатора:
Гормон Мишень: орган/ткань Типичное действие
Адренокортикотропный гормон Кора надпочечников Продуцирование кортизола
Кальцитонин Кости Концентрация кальция в сыворотке крови
Катехоламины (b-адренергические) Сердце ЧСС, сократимость миокарда
Хорионический гонадотропин Яичники, семенники Продуцирование половых гормонов
Фолликулостимулирующий гормон Яичники, семенники Гаметогенез
Глюкагон Печень Гликогенолиз, высвобождение глюкозы
Лютеинизирующий гормон Яичники, семенники Продуцирование половых гормонов
Рилизинг-фактор лютеинизирующего гормона Гипофиз Высв-е лютеинизирующего гормона
Меланоцитстимулирующий гормон Кожа (меланоциты) Пигментация
Гормон паращитовидных желез Кости, почки Концентрация Са и Р в сыворотке крови
Простациклин, простагландин Тромбоциты Агрегация тромбоцитов
Тиреотропный гормон Щитовидная железа Продуцирование и высвобождение Тз и Т 4
Рилизинг-фактор тиреотропного гормона Гипофиз Высвоб-е тиреотропного гормона
Вазопрессин Почки Концентрация мочи
П о
этому механизму, который получил названиекальций-фосфолипидный
механизм,
действуют вазопрессин (через V1-рецепторы),
адреналин (через α1-адренорецепторы),
ангиотензин II.
о
этому механизму, который получил названиекальций-фосфолипидный
механизм,
действуют вазопрессин (через V1-рецепторы),
адреналин (через α1-адренорецепторы),
ангиотензин II.
Принцип работы этого механизма совпадает с предыдущим, но вместо аденилатциклазы мишеневым ферментом для α-субъединицы служит фосфолипаза С. Фосфолипаза С расщепляет мембранный фосфолипид фосфатидилинозитолдифосфат (ФИФ2) до вторичных мессенджеров инозитолтрифосфата (ИФ3) и диацилглицерола (ДАГ).
Этапы передачи сигнала:
1)Взаимодействие гормона с рецептором приводит к изменению конформации последнего.
2) Это изменение передается на G-белок, который состоит из трех субъединиц (αP, β и γ), α-субъединица связана с ГДФ.
3)В результате взаимодействия с рецептором β- и γ-субъединицы отщепляются, одновременно на αP-субъединице ГДФ заменяется на ГТФ.
4)Активированная таким образом αP-субъединица стимулирует фосфолипазу С, которая начинает расщепление ФИФ2 до двух вторичных мессенджеров – ИФ3 и ДАГ.
5)Инозитолтрифосфат открывает кальциевые каналы в эндоплазматическом ретикулуме, что вызывает увеличение концентрации ионов Cа2+. Диацилглицерол совместно с ионами Са2+ активирует протеинкиназу С. Кроме этого, диацилглицерол имеет и другую сигнальную функцию: он может распадаться на 1-моноацилглицерол и полиеновую жирную кислоту (обычно арахидоновую), из которой образуются эйкозаноиды.
6)Протеинкиназа С фосфорилирует ряд ферментов и в целом участвует в процессах клеточной пролиферации. Накопление ионов Са2+ в цитоплазме вызывает активацию определенных кальций-связывающих белков (например, кальмодулина).
7)Гидролиз ФИФ2 продолжается некоторое время, пока αP-субъединица, которая является ГТФ-азой, отщепляет фосфат от ГТФ.
8)Как только ГТФ превратился в ГДФ, то αP-субъединица инактивируется, теряет свое влияние на фосфолипазу C, обратно соединяется с β- и γ-субъединицами. Все возвращается в исходное положение.
9) Гормон отрывается от рецептора еще раньше:
- если концентрация гормона в крови велика, то следующая его молекула присоединится к рецептору через малый промежуток времени и повторный запуск механизма произойдет быстро – в клетке активируются соответствующие процессы.
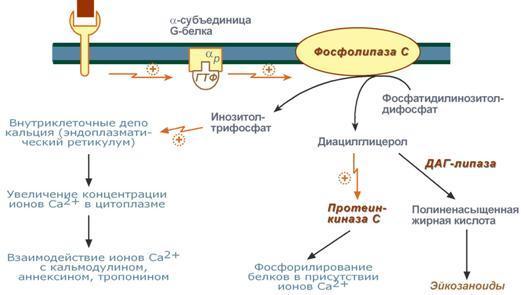 -
если гормона в крови мало – для клетки
наступает некоторая пауза, изменения
метаболизма нет.
-
если гормона в крови мало – для клетки
наступает некоторая пауза, изменения
метаболизма нет.
Гуанилатциклазный механизм пока изучен недостаточно подробно, но известно, что по нему работает атриопептин (предсердный натрийуретический пептид), оксид азота (NO) и другие, пока малоизученные, соединения.
Гуанилатциклазный механизм передачи сигнала в общих чертах схож с аденилатциклазным: после появления какой-либо сигнальной молекулы сигнал воспринимается ферментом гуанилатциклазой и далее передается при помощи вторичного мессенджера цГМФ. Он воздействует на протеинкиназу G, которая фосфорилирует определенные белки, чем изменяет активность клетки.Но, в отличие от аденилатциклазы, данный фермент имеет четыре разновидности, три из которых связаны с мембраной, четвертый – цитозольный:
мембраносвязанные формы гуанилатциклазы работают как рецепторы, обладающие каталитической активностью.
цитозольный фермент является димером и содержит в своем составе гем, он непосредственно взаимодействует в цитозоле с сигнальной молекулой (например, оксидом азота). Система, генерирующая цГМФ как вторичный посредник, сопряжена с гуанилатциклазой. Этот фермент катализирует реакцию образования цГМФ из ГТФ (подобно аденилатциклазе). Молекулы цГМФ могут активировать транспортные системы мембран клеток или активируют цГМФ-зависимую протеинкиназу G, которая участвует в фосфорилировании других белков в клетке. Циклические нуклеотиды запускают каскады реакций аденилатциклазного или гуанилатциклазного механизмов регуляции активности ферментов. Одна молекула гормона, активирующая рецептор, может «включать» несколько G-белков. Каждый из них в свою очередь активирует несколько молекул аденилатциклазы с образованием тысяч молекул цАМФ или цГМФ. Образующийся вторичный посредник усиливает сигнал в тысячу раз. Суммарное усиление сигнала равно 106 – 107 раз. Снятие гормонального сигнала достигается уменьшением концентрации вторичного посредника. Реакции превращения цАМФ или цГМФ в неактивные метаболиты АМФ или ГМФ катализируют ферменты фосфодиэстеразы. К настоящему времени получено много данных, что цГМФ принадлежит самостоятельная роль в регуляции функции клеток. В частности, в почках и кишечнике он контролирует ионный транспорт и обмен воды, в сердечной мышце служит сигналом релаксации и т.д. Гуанилатциклаза открыта во многих органах (сердце, легкие, почки, надпочечники, эндотелий кишечника, сетчатка и др.), что свидетельствует о широком ее участии в регуляции внутриклеточного метаболизма, опосредованном через цГМФ. Мембраносвязанный фермент активируется через соответствующие рецепторы короткими внеклеточными пептидами в частности гормоном предсердным натрийуретическим пептидом.
Инозитолтрифосфат - это вещество, которое является производным сложного липида - инозитфосфатида. Оно образуется в результате действия специального фермента - фосфолипазы "С", который активируется в результате конформационных изменений внутриклеточного домена мембранного белка-рецептора. Функционирование инозитолфосфатной системы трансмембранной передачи сигнала обеспечивают: R (рецептор), фосфолипаза С, Gplc - белок, активирующий фосфолипазу С, белки и ферменты мембран и цитозоля. Этот фермент гидролизует фосфоэфирную связь в молекуле фосфатидил-инозитол-4,5-бисфосфата и в результате образуются диацилглицерин и инозитолтрифосфат.
Известно, что образование диацилглицерина и инозитолтрифосфата приводит к увеличению концентрации ионизированного кальция внутри клетки. Это приводит к активации многих кальций-зависимых белков внутри клетки, в том числе активируются различные протеинкиназы. И здесь, как и при активации аденилатциклазной системы, одной из стадий передачи сигнала внутри клетки является фосфорилирование белков, которое в приводит к физиологическому ответу клетки на действие гормона (Пример – АКТГ). В работе фосфоинозитидного механизма передачи сигналов в клетке-мишени принимает участие специальный кальций-связывающий белок - кальмодулин. Это низкомолекулярный белок (17 кДа), на 30 % состоящий из отрицательно заряженных аминокислот (Глу, Асп) и поэтому способный активно связывать Са+2. Одна молекула кальмодулина имеет 4 кальций-связывающих участка. После взаимодействия с Са+2 происходят конформационные изменения молекулы кальмодулина и комплекс "Са+2-кальмодулин" становится способным регулировать активность (аллостерически угнетать или активировать) многие ферменты - аденилатциклазу, фосфодиэстеразу, Са+2,Мg+2-АТФазу и различные протеинкиназы. В разных клетках при воздействии комплекса "Са+2-кальмодулин" на изоферменты одного и того же фермента (например, на аденилатциклазу разного типа) в одних случаях наблюдается активация, а в других - ингибирование реакции образования цАМФ. Такие различные эффекты происходят потому, что аллостерические центры изоферментов могут включать в себя различные радикалы аминокислот и их реакция на действие комплекса Са+2-кальмодулин будет отличаться.
Действие гормонов через внутриклеточные рецепторы.
Некоторые гормоны, такие как стероидные гормоны и гормоны щитовидной железы, по свойствам являются гидрофобными. В плазме крови для их транспортировки используются специальные белки-транспортеры. В комплексе с этими белками они не способны взаимодействовать с мембранными рецепторами, но способны отрываться от них и диффундировать через клеточную мембрану внутрь клетки. После перехода в цитозоль гормоны немедленно подхватываются другими белками, которые уже являются рецепторами.
К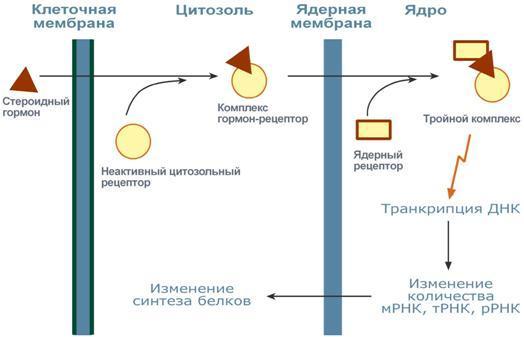 омплекс
гормон-рецептор в некоторых случаях
дополнительно модифицируется и
активируется. Далее он проникает в ядро,
где может связываться с ядерным
рецептором. В результате гормон
приобретает сродство к ДНК. Связываясь
с гормон-чувствительным элементом в
ДНК, гормон влияет на транскрипцию
определенных генов и изменяет концентрацию
РНК в клетке и, соответственно, количество
определенных белков в клетке.Взаимодействие
комплекса гормон-рецептор с определённой
последовательностью нуклеотидрв в
промоторной части ДНК приводит к
активации транскрипции. Последовательность
событий, приводящих к активации
транскрипции:
омплекс
гормон-рецептор в некоторых случаях
дополнительно модифицируется и
активируется. Далее он проникает в ядро,
где может связываться с ядерным
рецептором. В результате гормон
приобретает сродство к ДНК. Связываясь
с гормон-чувствительным элементом в
ДНК, гормон влияет на транскрипцию
определенных генов и изменяет концентрацию
РНК в клетке и, соответственно, количество
определенных белков в клетке.Взаимодействие
комплекса гормон-рецептор с определённой
последовательностью нуклеотидрв в
промоторной части ДНК приводит к
активации транскрипции. Последовательность
событий, приводящих к активации
транскрипции:
1) гормон проходит через двойной липидный слой клеточной мембраны.
2)взаимодействие гормона с рецептором (R) приводит к изменению конформации рецептора и снижению сродства к белкам-шаперонам, отделяющимся от комплекса гормон-рецептор.
3) комплекс гормон-рецептор проходит в ядро, взаимодействует с регуляторной нуклеотидной последовательностью в ДНК - энхансером или сайленсером.
4) увеличивается (при взаимодействии с энхансером) или уменьшается (при взаимодействии с сайленсером) доступность промотора для РНК-полимеразы.
5) соответственно увеличивается или уменьшается скорость транскрипции структурных генов.
6) увеличивается или уменьшается скорость трансляции.
7) изменяется количество белков, которые могут влиять на метаболизм и функциональное состояние клетки. Таким образом, данные гормоны влияют на количество ферментов в клетке.
Эффекты гормонов, которые передают сигнал через внутриклеточные рецепторы, нельзя наблюдать сразу, так как на протекание матричных процессов (транскрипцию и трансляцию) требуются часы.
Кратко:
Рецепторы могут находиться внутри клетки, а также на кле¬точной мембране.
Механизм действия гормонов ч/з внутриклеточные регуляторы.Гормон проникает в клетку, связывается с рецептором. Образованный таким образом гормон-рецепторный комплекс пере¬мещается в ядро и действует на генетический аппарат клетки. В результате меняется процесс транскрипции, а в дальнейшем, синтез белков. Таким образом, данные гормоны влияют на коли¬чество ферментов в клетке.Механизм действия гормонов через рецепторы плазматических мембран
В этом случае гормон не проникает в клетку, а взаимодей¬ствует с рецептором на поверхности мембраны. Далее возмож¬ны два варианта событий:
1.Первый вариант — с рецептором связан фермент, кото¬рый из специфического субстрата образует второй посред¬ник. Второй посредник далее связывается со своим рецептором в клетке. Чаще всего рецептором посредника является протеинкиназа, которая за счет фосфата АТФ, фосфорилирует белки. В результате изменяются их свойства, возникает биохимический и физиологический эффект.2.Второй вариант — рецептор связан не с ферментом мембраны, а с ионным каналом. При связывании гормона с рецептором, канал открывается, ион поступает в клетку и выполняет функции второго посредника.Хорошо изученными вторыми посредниками являются цик-лические нуклеотиды (цАМФ, цГМФ) и Са2+. Механизм действия гормонов через цАМФКогда соответствующий гормон связывается с рецептором, в мембране активируется фермент аденилатциклаза, который из АТф образует цАМФ. цАМФ является аллостерическим актива¬тором протеинкиназы, которая фосфорилирует белки и изменяет их свойства. Например, фосфорилирование фосфорилазы при¬водит к повышению ее активности, а фосфорилирование глико-генсинтетазы — к снижению. цАМФ расщепляется до АМФ фос-фодиэстеразой.Содержание цАМФ в клетке увеличивают: глюкагон, катехо-ламины (через в-рецепторы), антидиуретический гормон, гиста-мин (Н2-рецепторы), простагландин-Е, простациклин, тиреотроп-ный гормон, АКТГ, холерный токсин.Содержание цАМФ в клетке снижают: ацетилхолин (М-холи-норецепторы), катехоламины (а2-рецепторы), соматостатин, ан-гиотензин-П, опиаты, коклюшный токсин.Функции цАМФ: Как второй посредник участвует в регуляции:проницаемости мембран;синтеза макромолекул;активности ферментов;процессов деления; в нейронах — увеличения возбудимости;в сердце — стимуляции;в гладких мышцах — расслабления;в железах — увеличения секреции;изменения иммунных реакций; дезагрегации тромбоцитов.
Механизм действия гормонов через Са2+ В невозбужденной клетке концентрация кальция 10"7М. При возбуждении концентрация кальция возрастает до 10"6-10~5М. Источниками кальция для этого являются: межклеточная жидкость (содержание кальция — 10-3М), эндоплазматический ретикулум (тоже содержание кальция — 103М).
Когда гормон связывается с рецептором, в мембране откры¬вается кальциевый канал. В результате содержание кальция в клетке возрастает. Кальций связывается с белком клеток — каль-модулином, образуется комплекс, который может действовать непосредственно на белки, вызывая эффекты, или действовать на кальмодулин-зависимую протеинкиназу. Эта протеинкиназа фосфорилирует белки, в результате изменяются их свойства. Са2+ в качестве второго посредника выполняет те же функции, что и цАМФ, за исключением того, что в гладких мышцах вызывает сокращение, тромбоцитах — агрегацию.Содержание кальция в клетке повышают: катехоламины че¬рез а1-рецепторы, ацетилхолин через М-холинорецепторы, гистамин через Н1- рецепторы, тромбоксан, ангиотензин-II.
49. Инсулин. Строение, образование из проинсулина, метаболизм, регуляция секреции. Влияние на обмен веществ.
Строение: Представляет собой полипептид из 51 аминокислоты, массой 5,7 кД, состоящий из двух цепей А и В, связанных между собой дисульфидными мостиками.
Синтез: Синтезируется в клетках поджелудочной железы в виде проинсулина, в этом виде он упаковывается в секреторные гранулы и уже здесь образуется инсулин и С-пептид.
Регуляция синтеза и секреции: Активируют синтез и секрецию:
-глюкоза крови – главный регулятор, пороговая концентрация для секреции инсулина – 5,5 ммоль/л,
-жирные кислоты и аминокислоты,
-влияния n.vagus – находится под контролем гипоталамуса, активность которого определяется концентрацией глюкозы крови,
-гормоны ЖКТ: холецистокинин, секретин, гастрин, энтероглюкагон, желудочный ингибирующий полипептид,
-хроническое воздействие гормона роста, глюкокортикоидов, эстрогенов, прогестинов.
Уменьшают: влияние симпато-адреналовой системы.
Механизм действия: После связывания инсулина с рецептором активируется ферментативный домен рецептора. Так как он обладает тирозинкиназной активностью, то фосфорилирует внутриклеточные белки протеинфосфатазы. Конечным эффектом является дефосфорилирование "метаболических" ферментов – ТАГ-липазы, гликогенсинтазы, гликогенфосфорилазы, киназы гликогенфосфорилазы, ацетил-SКоА-карбоксилазы и других.
Мишени и эффекты: Основным эффектом является снижение глюкозы в крови благодаря усилению транспорта глюкозы внутрь миоцитов и адипоцитов и через активацию внутриклеточных реакций утилизации глюкозы.
Печень -активация ферментов гликолиза (гексокиназы, фосфофруктокиназы, пируваткиназы) и гликогеногенеза (гликогенсинтаза),
подавление глюконеогенеза,
усиление синтеза жирных кислот (активация ацетил-SКоА-карбоксилазы) и ЛПОНП.
Мышцы -стимуляция транспорта глюкозы в клетки,
активация синтеза гликогена,
усиление транспорта нейтральных аминокислот в мышцы,
стимулирование трансляции, т.е. рибосомальный синтез белков.
Жировая ткань
стимулирование транспорта глюкозы в клетки,
активация синтеза липопротеинлипазы,
усиление синтеза жирных кислот через активацию ацетил-SКоА-карбоксилазы
усиление синтеза триацилглицеролов через инактивацию ТАГ-липазы.
Патология: Гипофункция - Инсулинзависимый и инсулиннезависимый сахарный диабет.
Согласно современным представлениям, биосинтез инсулина осуществляется в β-клетках панкреатических островков из своего предшественника проинсулина. Проинсулин представлен одной полипептидной цепью, содержащей 84 аминокислотных остатка; он лишен биологической, т.е. гормональной, активности. Местом синтеза проинсули-на считается фракция микросом β-клеток панкреатических островков; превращение неактивного проинсулина в активный инсулин (наиболее существенная часть синтеза) происходит при перемещении проинсулина от рибосом к секреторным гранулам путем частичного протеолиза (отщепление с С-конца полипептидной цепи пептида, содержащего 33 аминокислотных остатка и получившего наименование соединяющего пептида, или С-пепти-да). Длина и первичная структура С-пептида подвержена большим изменениям у разных видов животных, чем последовательность цепей А и В инсулина. Установлено, что исходным предшественником инсулина является препроинсулин, содержащий, помимо проинсулина, его так называемую лидерную, или сигнальную, последовательность на N-конце, состоящую из 23 остатков аминокислот; при образовании молекулы проинсулина этот сигнальный пептид отщепляется специальной пептидазой. Далее молекула проинсулина также подвергается частичному протеолизу, и под действием трипсиноподобной протеиназы отщепляются по две основные аминокислоты с N- и С-конца пептида С – соответственно дипептиды Aрг–Aрг и Лиз– –Aрг. Синтезированный из проинсулина инсулин может существовать в нескольких формах, различающихся по биологическим, иммунологическим и физико-химическим свойствам. Различают две формы инсулина: 1) свободную, вступающую во взаимодействие с антителами, полученными к кристаллическому инсулину, и стимулирующую усвоение глюкозы мышечной и жировой тканями; 2) связанную, не реагирующую с антителами и активную только в отношении жировой ткани. В настоящее время доказано существование связанной формы инсулина и установлена локализация ее в белковых фракциях сыворотки крови, в частности в области трансферринов и α-глобулинов. Молекулярная масса связанного инсулина от 60000 до 100000. Различают, кроме того, так называемую форму А инсулина, отличающуюся от двух предыдущих рядом физико-химических и биологических свойств, занимающую промежуточное положение и появляющуюся в ответ на быструю, срочную потребность организма в инсулине.
50. Сахарный диабет. Патогенез. Нарушения обмена веществ при сахарном диабете. Определение толерантности к глюкозе при диагностике сахарного диабета.
Сахарный диабет - заболевание, возникающее вследствие абсолютного или относительного дефицита инсулина. Его классифицируют с учётом различия генетических факторов и клинического течения на две основные формы: диабет I типа - инсулинзависимый (ИЗСД), и диабет II типа - инсулиннезависимый (ИНСД).
1. Инсулинзависимый сахарный диабет - заболевание, вызываемое разрушением р-клеток островков Лангерханса поджелудочной железы. Деструкция β-клеток - результат аутоиммунных реакций. В аутоиммунной реакции принимают участие лимфоциты и макрофаги (моноциты). Эти клетки продуцируют цитокины, которые либо непосредственно повреждают β-клетки, либо опосредуют клеточные реакции против β-клеток. Провоцировать возникновение диабета I типа может вирусная инфекция, вызывающая деструкцию b-клеток. К таким вирусам, называемым β-цитотропными, относят вирусы оспы, краснухи, кори, цитомегаловирус, эпидемического паротита, Коксаки, аденовирус. Некоторые р-цитотропные вирусы вызывают лизис β-клеток. Известны некоторые токсические вещества, например, такие как производные нитрозомочевины и другие нитро- или аминосодержащие соединения, избирательно поражающие β-клетки и индуцирующие аутоиммунную реакцию. Кроме того, ИЗСД может быть результатом частичного генетически обусловленного дефекта системы иммунологического надзора и сочетаться с другими аутоиммунными заболеваниями. На долю ИЗСД приходится примерно 25-30% всех случаев сахарного диабета. Как правило, разрушение β-клеток происходит медленно, и начало заболевания не сопровождается нарушениями метаболизма. Когда погибает 80-95% клеток, возникает абсолютный дефицит инсулина, и развиваются тяжёлые метаболические нарушения. ИЗСД поражает в большинстве случаев детей, подростков и молодых людей, но может проявиться в любом возрасте (начиная с годовалого).
2. Инсулинонезависимый сахарный диабет - общее название нескольких заболеваний, развивающихся в результате относительного дефицита инсулина, возникающего вследствие нарушения секреции инсулина, нарушения превращения проинсулина в инсулин, повышения скорости катаболизма инсулина, а также повреждения механизмов передачи инсулинового сигнала в клетки-мишени (например, дефекта рецептора инсулина, повреждения внутриклеточных посредников инсулинового сигнала и др.). ИНСД поражает людей, как правило, старше 40 лет. Сахарный диабет II типа характеризуется высокой частотой семейных форм. Риск ИНСД у ближайших родственников больного достигает 50%, тогда как при ИЗСД он не превышает 10%. Заболевание поражает преимущественно жителей развитых стран, особенно горожан. Возможными причинами ИНСД могут быть: образование антител к рецепторам инсулина; генетический дефект пострецепторного аппарата инсулинзависимых тканей; нарушения регуляции секреции инсулина. К факторам, определяющим развитие и клиническое течение болезни, относят ожирение, неправильный режим питания, малоподвижный образ жизни, стресс. Мутации генов, контролирующих секрецию инсулина, энергетический обмен в β-клетках и обмен глюкозы в клетках-мишенях инсулина, приводят к возникновению нескольких форм ИНСД с аутосомно-доминантным наследованием. Основным провоцирующим фактором инсулинонезависимого диабета служит ожирение.
Этот тип диабета часто сочетается с гиперинсулинемией, что способствует ожирению. Таким образом, ожирение, с одной стороны, важнейший фактор риска, а с другой - одно из ранних проявлений сахарного диабета.
При сахарном диабете, как правило, соотношение инсулин/глюкагон снижено. При этом ослабевает стимуляция процессов депонирования гликогена и жиров, и усиливается мобилизация запасов энергоносителей. Печень, мышцы и жировая ткань даже после приёма пищи функционируют в режиме постабсорбтивного состояния.
1. Симптомы сахарного диабета. Для всех форм диабета характерно повышение концентрации глюкозы в крови - гипергликемия. После приёма пищи концентрация глюкозы может достигать 300-500 мг/дл и сохраняется на высоком уровне в постабсорбтивном периоде, т.е. снижается толерантность к глюкозе. Снижение толерантности к глюкозе наблюдают в случаях скрытой (латентной) формы сахарного диабета. В этих случаях у людей отсутствуют жалобы и клинические симптомы, характерные для сахарного диабета, а концентрация глюкозы в крови натощак соответствует норме. Однако использование провокационных проб (например, сахарной нагрузки) выявляет снижение толерантности к глюкозе.Определение толерантности к глюкозе используют для диагностики сахарного диабета. Обследуемый принимает раствор глюкозы из расчёта 1 г на 1 кг массы тела (сахарная нагрузка). Концентрацию глюкозы в крови измеряют в течение 2-3 ч с интервалами в 30 мин. 1 - у здорового человека; 2 - у больного сахарным диабетом.
П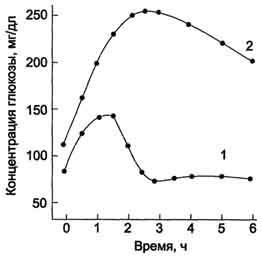 овышение
концентрации глюкозы в плазме крови
обусловлено снижением скорости
использования глюкозы тканями вследствие
недостатка инсулина или снижения
биологического действия инсулина в
тканях-мишенях.
овышение
концентрации глюкозы в плазме крови
обусловлено снижением скорости
использования глюкозы тканями вследствие
недостатка инсулина или снижения
биологического действия инсулина в
тканях-мишенях.
При дефиците инсулина уменьшается количество белков-переносчиков глюкозы (ГЛЮТ-4) на мембранах инсулинзависимых клеток (жировой ткани и мышц). В мышцах и печени глюкоза не депонируется в виде гликогена, в жировой ткани уменьшается скорость синтеза и депонирования жиров. Кроме того, при снижении инсулинглюкагонового индекса активируется глюконеогенез из аминокислот, глицерола и лактата. Повышение концентрации глюкозы в крови при сахарном диабете превышает концентрационный почечный порог, что становится причиной выделения глюкозы с мочой (глюкозурия). В норме проксимальные канальцы почек реабсорбируют всю фильтрующуюся в клубочках глюкозу, если её уровень не превышает 8,9 ммоль/л (160 мг/дл).
К характерным признакам сахарного диабета относят также повышение концентрации в крови кетоновых тел - кетонемия. При низком соотношении инсулин/глюкагон жиры не депонируются, а ускоряется их катаболизм, так как гормончувствительная липаза в жировой ткани находится в фосфорилированной активной форме. Концентрация неэтерифицирован-ных жирных кислот в крови повышается. Печень захватывает жирные кислоты, окисляет их до ацетил-КоА, который, в свою очередь, превращается в β-гидроксимасляную и ацетоуксусную кислоты. В тканях ацетоацетат частично декарбоксилируется до ацетона, запах которого исходит от больных сахарным диабетом и ощущается даже на расстоянии. Увеличение концентрации кетоновых тел в крови (выше 20 мг/дл, иногда до 100 мг/дл) приводит к кетонурии. Накопление кетоновых тел снижает буферную ёмкость крови и вызывает ацидоз.
Ещё один характерный признак сахарного диабета - повышенный уровень в крови ли-попротеинов (в основном, ЛПОНП) - гипер-липопротеинемия. Пищевые жиры не депонируются в жировой ткани вследствие ослабления процессов запасания, а поступают в печень, где частично превращаются в триацилглицеролы, которые транспортируются из печени в составе ЛПОНП.
При сахарном диабете дефицит инсулина приводит к снижению скорости синтеза белков в организме и усилению распада белков. Это вызывает повышение концентрации аминокислот в крови. Аминокислоты поступают в печень и дезаминируются. Безазотистые остатки гликогенных аминокислот включаются в глюконеогенез, что ещё более усиливает гипергликемию. Образующийся при этом аммиак вступает в орнитиновый цикл, что приводит к увеличению концентрации мочевины в крови и, соответственно, в моче - азотемия и азотурия.
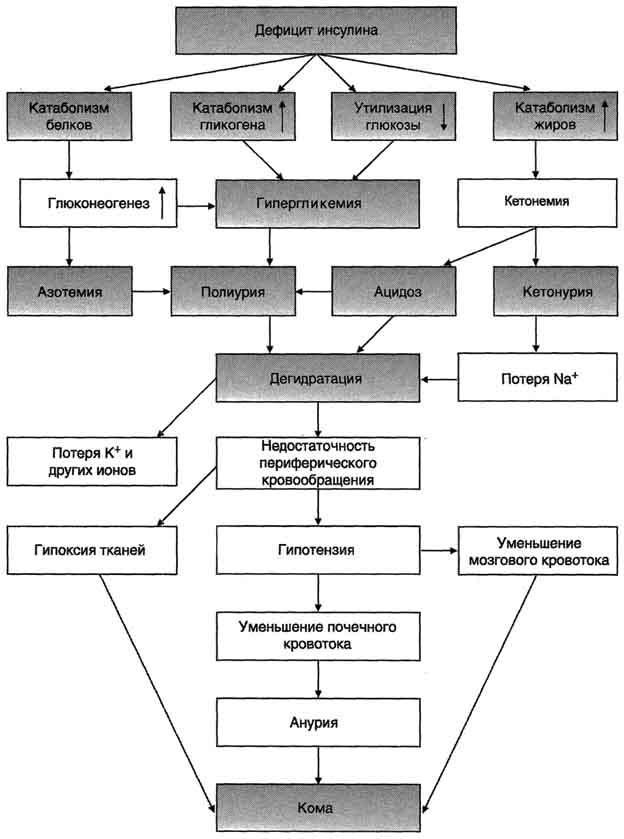 Высокие
концентрации глюкозы, кетоновых тел,
мочевины требуют усиленной экскреции
их из организма. Поскольку концентрационная
способность почек ограничена, резко
увеличивается выделение большого
количества воды, в результате чего может
наступить обезвоживание организма.
Выделение мочи у больных возрастает в
несколько раз и в некоторых случаях
достигает 8-9 л в сутки, но чаще не превышает
3-4 л - полиурия. Потеря воды вызывает
постоянную жажду - полидипсия.
Высокие
концентрации глюкозы, кетоновых тел,
мочевины требуют усиленной экскреции
их из организма. Поскольку концентрационная
способность почек ограничена, резко
увеличивается выделение большого
количества воды, в результате чего может
наступить обезвоживание организма.
Выделение мочи у больных возрастает в
несколько раз и в некоторых случаях
достигает 8-9 л в сутки, но чаще не превышает
3-4 л - полиурия. Потеря воды вызывает
постоянную жажду - полидипсия.
2. Острые осложнения сахарного диабета. Механизмы развития диабетической комы.
Нарушения обмена углеводов, жиров и белков при сахарном диабете могут приводить к развитию коматозных состояний (острые осложнения). Диабетическая кома проявляется в резком нарушении всех функций организма с потерей сознания. Основные предшественники диабетической комы - ацидоз и дегидратация тканей. Параллельно кетоацидозу при декомпенсации диабета развивается нарушение водно-электролитного обмена. В его основе лежит гипергликемия, сопровождающаяся повышением осмотического давления в сосудистом русле. Для сохранения осмолярности начинается компенсаторное перемещение жидкости из клеток и внеклеточного пространства в сосудистое русло. Это ведёт к потере тканями воды и электролитов, прежде всего ионов Na+, K+, С1-, НСО3. В результате развиваются тяжёлая клеточная дегидратация и дефицит внутриклеточных ионов (прежде всего К+), затем возникает общая дегидратация. Это приводит к снижению периферического кровообращения, уменьшению мозгового и почечного кровотока и гипоксии. Диабетическая кома развивается медленно, в течение нескольких дней, но иногда может возникнуть и в течение нескольких часов. Первыми признаками могут быть тошнота, рвота, заторможенность. АД у больных снижено.
Коматозные состояния при сахарном диабете могут проявляться в трёх основных формах: кетоацидотической, гиперосмолярной и лакто-ацидотической. Для кетоацидотической комы характерны выраженный дефицит инсулина, кетоацидоз, полиурия, полидипсия. Гипергликемия (20-30 ммоль/л), обусловленная инсулиновой недостаточностью, сопровождается большими потерями жидкости и электролитов, дегидратацией и гиперосмоляльностью плазмы. Общая концентрация кетоновых тел достигает 100 мг/дл и выше.
При гиперосмолярной коме наблюдают чрезвычайно высокие уровни глюкозы в плазме крови, полиурию, полидипсию, всегда проявляется тяжёлая дегидратация. Предполагают, что у большинства больных гипергликемия обусловлена сопутствующим нарушением функции почек. Кетоновые тела в сыворотке крови обычно не определяются.
При лактоацидотической коме преобладают гипотония, снижение периферического кровообращения, гипоксия тканей, приводящая к смещению метаболизма в сторону анаэробного гликолиза, что обусловливает повышение концентрации молочной кислоты в крови (лакто-ацидоз).
Разные варианты диабетической комы в чистом виде практически не встречаются. Их возникновение может быть обусловлено разными факторами, например инфекционными заболеваниями, травмами, хирургическими вмешательствами, токсическими соединениями и др.
3. Поздние осложнения сахарного диабета. Главная причина поздних осложнений сахарного диабета - гипергликемия. Гипергликемия приводит к повреждению кровеносных сосудов и нарушению функций различных тканей и органов.
Одним из основных механизмов повреждения тканей при сахарном диабете является гликозилирование белков, приводящее к изменению их конформации и функций. Некоторые белки в норме содержат углеводные компоненты, причём образование таких гликопротеинов протекает ферментативно (например, образование гликопротеиновых гормонов аденогипофиза). Однако в организме человека может происходить и неферментативное взаимодействие глюкозы со свободными аминогруппами белков - неферментативное гликозилирование белков. В тканях здоровых людей эта реакция протекает медленно. При гипергликемии процесс гликозилирования ускоряется. Степень гликозилирования белков зависит от скорости их обновления. В медленно обменивающихся белках накапливается больше изменений. К одним из первых признаков сахарного диабета относят увеличение в 2-3 раза количества гликозилированного гемоглобина (норма НbА1С 5,8-7,2%). Другим примером медленно обменивающихся белков служат кристаллины - белки хрусталика. При гликозилировании кристаллины образуют многомолекулярные агрегаты, увеличивающие преломляющую способность хрусталика. Прозрачность хрусталика уменьшается, возникает его помутнение, или катаракта.
К медленно обменивающимся белкам относятся белки межклеточного матрикса, базальных мембран. Утолщение базальных мембран, одно из характерных осложнений сахарного диабета, приводит к развитию диабетических ангиопатий.
Причиной многих поздних осложнений сахарного диабета также служит повышение скорости превращения глюкозы в сорбитол.
*Реакция превращения глюкозы в шестиатомный спирт (сорбитол) катализируется ферментом альдозоредуктазой. Сорбитол не используется в других метаболических путях, а скорость его диффузии из клеток невелика. У больных сахарным диабетом сорбитол накапливается в сетчатке и хрусталике глаза, клетках клубочков почек, шванновских клетках, в эндотелии.
*Сорбитол в высоких концентрациях токсичен для клеток. Его накопление в нейронах приводит к увеличению осмотического давления, набуханию клеток и отёку тканей. Так, например, помутнение хрусталика может развиться вследствие вызванного накоплением сорбитола набухания хрусталика и нарушения упорядоченной структуры кристаллинов.
Диабетические ангиопатии. Диабетические ангиопатий обусловлены прежде всего поражением базальных мембран сосудов. При высокой концентрации глюкозы в плазме крови протеогликаны, коллагены, гликопротеины гликозилируются, нарушается обмен и соотношение между компонентами базальных мембран, нарушается их структурная организация.
Макроангиопатии проявляются в поражениях крупных и средних сосудов сердца, мозга, нижних конечностей. Патологические изменения во внутренней оболочке артерий и повреждения артериальной стенки в средних и наружных слоях - следствие гликозилирования базальных мембран и белков межклеточного матрикса (коллагена и эластина), что приводит к снижению эластичности артерий. В сочетании с гиперли-пидемией это может быть причиной развития атеросклероза. При сахарном диабете атеросклероз встречается чаще, развивается в более раннем возрасте и прогрессирует значительно быстрее, чем в отсутствие диабета. Микроангиопатии - результат повреждения капилляров и мелких сосудов. Проявляются в форме нефро-, нейро- и ретинопатии.
Нефропатия развивается примерно у трети больных сахарным диабетом. Электронно-микроскопические изменения базальной мембраны в почечных клубочках можно обнаружить уже на первом году после установления диагноза. Однако у большинства больных клинические признаки диабетической нефропатии проявляются через 10-15 лет существования диабета. Признаком ранних стадий нефропатии служит микроальбуминурия (в пределах 30-300 мг/сут), которая в дальнейшем развивается до классического нефротического синдрома, характеризующегося высокой протеинурией, гипоальбуминемией и отёками.
Ретинопатия, самое серьёзное осложнение сахарного диабета и наиболее частая причина слепоты, развивается у 60-80% больных сахарным диабетом. На ранних стадиях развивается базальная ретинопатия, которая проявляется в кровоизлияниях в сетчатку, расширении сосудов сетчатки, отёках, Если изменения не затрагивают жёлтого пятна, потеря зрения обычно не происходит. В дальнейшем может развиться пролиферативная ретинопатия, проявляющаяся в новообразовании сосудов сетчатки и стекловидного тела. Ломкость и высокая проницаемость новообразованных сосудов определяют частые кровоизлияния в сетчатку или стекловидное тело. На месте тромбов развивается фиброз, приводящий к отслойке сетчатки и потере зрения.
Обычно диагноз сахарного диабета можно поставить на основе классических симптомов сахарного диабета - гипергликемии, полиурии, полидипсии, полифагии, ощущения сухости во рту. Важнейшие биохимические признаки ИЗСД выявляют на основе:
1. теста толерантности к глюкозе (см. рис. 11-30). Уровень глюкозы в плазме крови выше 10 ммоль/л через 2 ч после сахарной нагрузки свидетельствует о сахарном диабете;
2. определения гликозилированного гемоглобина. При сахарном диабете уровень НbА1с, в норме составляющий около 5% от всего содержания гемоглобина, увеличивается в 2-3 раза;
3. отсутствия или низкого уровня инсулина и С-пептида в крови и моче. В норме инсулин и С-пептид секретируются в эквимолярных концентрациях. Поскольку печенью задерживается примерно 2/3 инсулина, соотношение инсулин/С-пептид в воротной вене и периферических сосудах в норме составляет 1/3. Величина уровня С-пептида в сыворотке или моче позволяет достаточно точно оценить функциональное состояние β-клеток;
4. альбуминурии. При сахарном диабете суточное выведение альбумина составляет примерно 30-300 мг - микроальбуминурия (в норме около 8 мг).
Поскольку ИНСД развивается значительно медленнее, классические клинические симптомы, гипергликемию и дефицит инсулина диагностируют позднее, часто в сочетании с симптомами поздних осложнений сахарного диабета.
Лечение сахарного диабета зависит от его типа (I или II), является комплексным и включает диету, применение сахаропонижающих средств, инсулинотерапию, а также профилактику и лечение осложнений.
Современные сахаропонижающие препараты делят на две основные группы: производные суль-фонилмочевины и бигуаниды. К препаратам, действие которых направлено на стимуляцию секреции инсулина, относят производные сульфонилмочевины (например, манинил). Механизм действия препаратов сульфонилмочевины объясняют их влиянием на функцию АТФ-чувствительных К+-каналов. Повышение внутриклеточной концентрации К+ приводит к деполяризации мембраны и ускорению транспорта ионов кальция в клетку, вследствие чего стимулируется секреция инсулина.
Другую основную группу сахаропонижающих препаратов составляют бигуаниды. По данным некоторых исследований, бигуаниды увеличивают количество переносчиков глюкозы ГЛЮТ-4 на поверхности мембран клеток жировой ткани и мышц.
К перспективным методам лечения сахарного диабета относят следующие: трансплантация островков поджелудочной железы или изолированных β-клеток, трансплантация генетически реконструированных клеток, а также стимуляция регенерации панкреатических островков.
При сахарном диабете обоих типов важнейшее значение имеет диетотерапия. Рекомендуют хорошо сбалансированную диету: на долю углеводов должно приходиться 50-60% общей калорийности пищи (исключение должны составлять легкоусвояемые углеводы, пиво, спиртные напитки, сиропы, пирожные и др.); на долю белков - 15-20%; на долю всех жиров - не более 25-30%. Пищу следует принимать 5-6 раз в течение суток.
51. Соматотропный гормон, глюкагон и другие пептидные гормоны. Биологическое значение.
Строение: Представляет собой полипептид, включающий 191 аминокислоту с молекулярной массой 22 кДа и периодом полураспада 20-25 мин.
Синтез: Осуществляется в ацидофильных клетках гипофиза – подкласс соматотрофов с волнообразной секрецией и пиком каждые 20-30 мин.
Регуляция синтеза и секреции: Активируют: стресс (боль, тревога, холод), гипогликемия (при физической нагрузке и кратком голодании), андрогены и эстрогены, некоторые аминокислоты (например, аргинин), медленная фаза сна (вскоре после засыпания), морфин, вазопрессин, трийодтиронин (особенно у детей, через высвобождение соматолиберина).
Уменьшают: гипергликемия, соматомедины.
Механизм действия: Рецептор с каталитической тирозинкиназной активностью. Часть эффектов связана с увеличением количества молекул аденилатциклазы в цитоплазматической мембране. Существенную роль в эффектах гормона играют соматомедины (ростовые факторы), вырабатываемые в печени после воздействия на нее СТГ.
Мишени и эффекты: Мишенью являются костная, хрящевая, мышечная, жировая ткани и печень. Гормон стимулирует общий рост клетки-мишени, но не ее дифференцировку.
Белковый обмен: Вызывает положительный азотистый баланс, в целом повышает транспорт аминокислот в печень, мышечную, хрящевую и костную ткани, активирует все стадии биосинтеза белка.
Нуклеиновый обмен: Активирует синтез РНК и ДНК.
Углеводный обмен: Подавляет поглощение глюкозы в периферических тканях, переключая их на использование жирных кислот, стимулирует глюконеогенез и гликогенолиз в печени, что вызывает гипергликемию. В мышцах подавляет гликолиз и стимулирует синтез гликогена. У детей стимулирует образование хондроитинсульфата в костной ткани.
Жировой обмен: Активирует липолиз, накопление жирных кислот в крови и, при недостатке инсулина, кетогенез.
Минеральный обмен: Стимулирует гидроксилирование и активацию витамина D в почках. Формирует положительный баланс ионов Mg2+, Ca2+, Na+, К+, Cl–, SO42–, фосфатов.
Патология: Гипофункция - при уменьшении выработки и снижении концентрации в крови возникает гипофизарный нанизм (карликовость), частота в России около 1:20000. Проявляется на 2-4 году жизни, критерием служит снижение скорости роста до 4 см в год и менее. -при нарушении синтеза у взрослых отмечается снижение мышечной массы и тенденция к гипогликемии, -при нарушении рецепции или пострецепторной передачи сигнала происходит пропорциональное, но недостаточное развитие тела. Примером могут служить пигмеи, племена Центральной Африки.
Гиперфункция - у детей возникает гигантизм, так как еще нет зарастания эпифизарных щелей и возможен ускоренный рост кости; у взрослых развивается акромегалия – из-за акрального роста кости происходит увеличение размера носа, стопы, кистей, челюсти.
Пептиды проопиомеланокортина. Проопиомеланокортин представляет собой пептид, включающий 254 аминокислоты. При его гидролизе в клетках переднего и промежуточного гипофиза появляются три основные группы пептидов этого семейства:
1. Адренокортикотропный гормон ( АКТГ) из которого может образоваться α-меланоцитстимулирующий гормон (МСГ),
2. β-Липотропин, служащий предшественником α-липотропина, β-МСГ и β-эндорфина.
3. γ-Меланоцитстимулирующий гормон.
Указанные пептиды способны претерпевать дополнительные модификации с образованием новых регуляторных пептидов. Механизмы действия и эффекты большинства производных проопиомеланокортина недостаточно изучены.
Липотропный гормон. β-Липотропин представляет собой полипептид из 91 аминокислоты.
Мишени и эффекты: Мишенью являются жировая ткань, где он стимулирует липолиз и мобилизацию жирных кислот. Основная роль – источник эндогенных опиатов (α-, β-, γ-эндорфинов) в головном мозге, которые вызывают обезболивание, снятие ощущений страха и т.п.
Меланоцитстимулирующий гормон. Строение: Представляет собой группу пептидов α-, β-, γ-МСГ. По строению, например, α-МСГ включает 13 аминокислот, γ-МСГ включает 11 аминокислот.
Синтез:Происходит в средней доле гипофиза.
Механизм действия: Аденилатциклазный.
Мишени и эффекты: Мишенью являются меланоциты кожи, радужки, пигментного эпителия сетчатки глаза, в которых стимулирует меланиногенез и пигментацию.
Патология: Гиперфункция - Проявляется как симптом усиленной пигментации кожи при первичной недостаточности коры надпочечников (болезни Аддисона), в связи с чем такой гипокортицизм также называют "бронзовая болезнь".
Глюкагон. Строение:Представляет собой полипептид, включающий 29 аминокислот с молекулярной массой 3,5 кДа и периодом полураспада 3-6 мин.
Синтез: Осуществляется в клетках поджелудочной железы и в клетках тонкого кишечника.
Регуляция синтеза и секреции:Уменьшают: глюкоза.
Механизм действия:Аденилатциклазный.
Мишени и эффекты: Конечным эффектом является повышение концентрации глюкозы и жирных кислот в крови. Жировая ткань - повышает активность внутриклеточной гормон-чувствительной ТАГ-липазы и, соответственно, стимулирует липолиз.
Печень - активация глюконеогенеза и гликогенолиза, за счет повышенного поступления жирных кислот из жировой ткани усиливает кетогенез.
52. Гормоны коры надпочечников. Синтез, метаболизм, регуляция секреции. Глюкокортикостероиды, влияние на обмен веществ. Гипо- и гиперкортицизм.
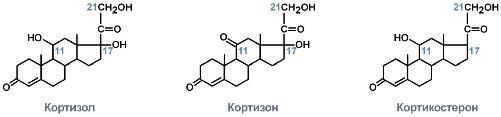 К
настоящему времени из коркового вещества
надпочечников человека выделено около
50 различных соединений, которым дано
общее название «кортикоиды», или
«кортикостероиды». Общее число всех
стероидов, которые синтезируются в
надпочечниках многих животных,
приближается к 100, однако биологической
активностью наделены не все кортикостероиды.
КОРТИКОИДЫ
(кортикостероиды), прир. стероидные
гормоны, вырабатываемые корой надпочечников
позвоночных. Биологически активные
кортикостероиды объединяют в 3 основные
класса: Глюкокортикоиды,
С21-стероиды, играют важную роль в
адаптации к стрессу. Они оказывают
разнообразные эффекты, но наиболее
важный - стимуляция глюконеогенеза. Для
жизнедеятельности орг-ма имеют: кортизол,
кортизон, кортикостерон. Минералокортикоиды,
С21-стероиды, необходимы для поддержания
уровня Na+
и К+.
Самый активный гормон этого класса –
альдостерон. Андрогены
- С19-стероиды. В коре надпочечников
образуются предшественники андрогенов,
из которых наиболее активный -
дегидроэпиандростерон (ДЭА) и слабый -
андростендион. Самый мощный андроген
надпочечников тестостерон синтезируется
в надпочечниках в небольшом количестве.
Эти стероиды превращаются в более
активные андрогены вне надпочечников.
Тестостерон в незначительных количествах
может превращаться в надпочечниках в
эстрадиол. Но в норме продукция этих
гормонов надпочечниками не играет
существенной роли. Общим
предшественником
кортикостероидов служит холестерол. В
митохондриях холестерол превращается
в прегненолон при участии гидроксилазы,
относящейся к группе цитохромов Р450.
Цитохром Р450, отщепляющий боковую цепь,
локализован во внутренней мембране
митохондрий. Отщепление боковой цепи
холестерола включает 2 реакции
гидроксилирования: одна - по атому С22,
другая - по С20. Последующее отщепление
шестиуглеродного фрагмента приводит
к образованию С21-стероида - прегненолона.
Дальнейшее превращение прегненолона
происходит под действием различных
гидроксилаз с участием молекулярного
кислорода и NADPH, а также дегидрогеназ,
изомераз и лиаз. Эти ферменты имеют
различную внутри- и межклеточную
лбкализацию. В коре надпочечников
различают 3 типа клеток, образующих 3
слоя, или зоны: клубочковую, пучковую и
сетчатую. Каким именно стероидом окажется
конечный продукт, зависит от набора
ферментов в клетке и последовательности
реакций гидроксилирования. Глюкокортикоиды
являются производными холестерола –
стероидные гормоны. Основным гормоном
у человека является кортизол.
Синтез
осуществляется в сетчатой и пучковой
зонах коры надпочечников. Кортизол
синтезируется из холестерола, который
в основном поступает из крови в составе
ЛПНП или синтезируется в клетках из
ацетил-КоА. Значительная часть эфиров
холестерола накапливается в цитозоле
клеток в липидных каплях. Под влиянием
АКТГ происходит активация специфической
эстеразы, и свободный холестерол
транспортируется в митохондрии. Синтез
кортизола начинается с превращения
прегненолона в прогестерон. Эта реакция
протекает в цитозоле клеток пучковой
зоны коры надпочечников, куда прегненолон
транспортируется из митохондрий. Реакцию
катализирует 3-β-гидроксистероиддегидрогеназа.
В мембранах ЭР при участии 17-α-гидроксилазы
происходит гидроксилирование прогестерона
по С17 с образованием 17-гидроксипрогестерона.
Этот же фермент катализирует превращение
прегненолона в 17-гидроксипрегненолон,
от которого далее при участии 17,20-
лиазы
может отщепляться двухуглеродная
боковая цепь с образованием С19-стероида
- дегидроэпиандростерона. 17
-гидроксипрогестерон служит предшественником
кортизола, а дегидроэпиандростерон -
предшественником андрогенов. Далее
17-ОН-прогестерон гидроксилируется
21-гидроксилазой, локализованной в
мембране ЭР, и превращается в
11-дезоксикортизол, который переносится
во внутреннюю мембрану митохондрий,
где гидроксилируется при участии
цитохрома Р450-с11 с образованием кортизола.
Регуляция
синтеза и секреции:
Активируют:
АКТГ, обеспечивающий нарастание
концентрации кортизола в утренние часы,
к концу дня содержание кортизола снова
снижается. В ответ на стресс, травму,
инфекцию, понижение концентрации глюкозы
в крови. Кроме этого, имеется нервная
стимуляция секреции гормонов. Уменьшают:
кортизол по механизму обратной
отрицательной связи. Мишени
и эффекты:
Мишенью является мышечная, лимфоидная,
эпителиальная (слизистые оболочки и
кожа), жировая и костная ткани, печень.
Белковый
обмен: значительное
повышение катаболизма белков в мишеневых
тканях. Однако в печени в целом стимулирует
анаболизм белков. Углеводный
обмен:В
целом вызывают повышение концентрации
глюкозы крови:
снижение
проницаемости мембран для глюкозы в
инсулинзависимых тканях. стимуляция
глюконеогенеза посредством увеличения
синтеза фосфоенолпируват-карбоксикиназы
и синтеза аминотрансфераз, обеспечивающих
использование углеродного скелета АК,
увеличение синтеза гликогена в печени
за счет активации фосфатаз и
дефосфорилирования гликогенсинтазы.
Липидный
обмен:
стимуляция липолиза в жировой ткани
благодаря увеличению синтеза ТАГ-липазы,
что усиливает эффект АКТГ, СТГ, глюкагона,
катехоламинов (пермиссивное действие,
англ. permission - позволение). Водно-электролитный
обмен:
слабый минералокортикоидный эффект на
канальцы почек вызывает реабсорбцию
натрия и потерю калия, потеря воды в
результате подавления секреции
вазопрессина и излишняя задержка натрия
из-за увеличения активности
ренин-ангиотензин-альдостероновой
системы. Противовоспалительное
и иммунодепрессивное действие:увеличение
перемещения лимфоцитов, моноцитов,
эозинофилов и базофилов в лимфоидную
ткань, повышение уровня лейкоцитов в
крови за счет их выброса из костного
мозга и тканей, подавление функций
лейкоцитов и тканевых макрофагов через
снижение синтеза эйкозаноидов посредством
нарушения транскрипции ферментов
фосфолипазы А2 и циклооксигеназы.
К
настоящему времени из коркового вещества
надпочечников человека выделено около
50 различных соединений, которым дано
общее название «кортикоиды», или
«кортикостероиды». Общее число всех
стероидов, которые синтезируются в
надпочечниках многих животных,
приближается к 100, однако биологической
активностью наделены не все кортикостероиды.
КОРТИКОИДЫ
(кортикостероиды), прир. стероидные
гормоны, вырабатываемые корой надпочечников
позвоночных. Биологически активные
кортикостероиды объединяют в 3 основные
класса: Глюкокортикоиды,
С21-стероиды, играют важную роль в
адаптации к стрессу. Они оказывают
разнообразные эффекты, но наиболее
важный - стимуляция глюконеогенеза. Для
жизнедеятельности орг-ма имеют: кортизол,
кортизон, кортикостерон. Минералокортикоиды,
С21-стероиды, необходимы для поддержания
уровня Na+
и К+.
Самый активный гормон этого класса –
альдостерон. Андрогены
- С19-стероиды. В коре надпочечников
образуются предшественники андрогенов,
из которых наиболее активный -
дегидроэпиандростерон (ДЭА) и слабый -
андростендион. Самый мощный андроген
надпочечников тестостерон синтезируется
в надпочечниках в небольшом количестве.
Эти стероиды превращаются в более
активные андрогены вне надпочечников.
Тестостерон в незначительных количествах
может превращаться в надпочечниках в
эстрадиол. Но в норме продукция этих
гормонов надпочечниками не играет
существенной роли. Общим
предшественником
кортикостероидов служит холестерол. В
митохондриях холестерол превращается
в прегненолон при участии гидроксилазы,
относящейся к группе цитохромов Р450.
Цитохром Р450, отщепляющий боковую цепь,
локализован во внутренней мембране
митохондрий. Отщепление боковой цепи
холестерола включает 2 реакции
гидроксилирования: одна - по атому С22,
другая - по С20. Последующее отщепление
шестиуглеродного фрагмента приводит
к образованию С21-стероида - прегненолона.
Дальнейшее превращение прегненолона
происходит под действием различных
гидроксилаз с участием молекулярного
кислорода и NADPH, а также дегидрогеназ,
изомераз и лиаз. Эти ферменты имеют
различную внутри- и межклеточную
лбкализацию. В коре надпочечников
различают 3 типа клеток, образующих 3
слоя, или зоны: клубочковую, пучковую и
сетчатую. Каким именно стероидом окажется
конечный продукт, зависит от набора
ферментов в клетке и последовательности
реакций гидроксилирования. Глюкокортикоиды
являются производными холестерола –
стероидные гормоны. Основным гормоном
у человека является кортизол.
Синтез
осуществляется в сетчатой и пучковой
зонах коры надпочечников. Кортизол
синтезируется из холестерола, который
в основном поступает из крови в составе
ЛПНП или синтезируется в клетках из
ацетил-КоА. Значительная часть эфиров
холестерола накапливается в цитозоле
клеток в липидных каплях. Под влиянием
АКТГ происходит активация специфической
эстеразы, и свободный холестерол
транспортируется в митохондрии. Синтез
кортизола начинается с превращения
прегненолона в прогестерон. Эта реакция
протекает в цитозоле клеток пучковой
зоны коры надпочечников, куда прегненолон
транспортируется из митохондрий. Реакцию
катализирует 3-β-гидроксистероиддегидрогеназа.
В мембранах ЭР при участии 17-α-гидроксилазы
происходит гидроксилирование прогестерона
по С17 с образованием 17-гидроксипрогестерона.
Этот же фермент катализирует превращение
прегненолона в 17-гидроксипрегненолон,
от которого далее при участии 17,20-
лиазы
может отщепляться двухуглеродная
боковая цепь с образованием С19-стероида
- дегидроэпиандростерона. 17
-гидроксипрогестерон служит предшественником
кортизола, а дегидроэпиандростерон -
предшественником андрогенов. Далее
17-ОН-прогестерон гидроксилируется
21-гидроксилазой, локализованной в
мембране ЭР, и превращается в
11-дезоксикортизол, который переносится
во внутреннюю мембрану митохондрий,
где гидроксилируется при участии
цитохрома Р450-с11 с образованием кортизола.
Регуляция
синтеза и секреции:
Активируют:
АКТГ, обеспечивающий нарастание
концентрации кортизола в утренние часы,
к концу дня содержание кортизола снова
снижается. В ответ на стресс, травму,
инфекцию, понижение концентрации глюкозы
в крови. Кроме этого, имеется нервная
стимуляция секреции гормонов. Уменьшают:
кортизол по механизму обратной
отрицательной связи. Мишени
и эффекты:
Мишенью является мышечная, лимфоидная,
эпителиальная (слизистые оболочки и
кожа), жировая и костная ткани, печень.
Белковый
обмен: значительное
повышение катаболизма белков в мишеневых
тканях. Однако в печени в целом стимулирует
анаболизм белков. Углеводный
обмен:В
целом вызывают повышение концентрации
глюкозы крови:
снижение
проницаемости мембран для глюкозы в
инсулинзависимых тканях. стимуляция
глюконеогенеза посредством увеличения
синтеза фосфоенолпируват-карбоксикиназы
и синтеза аминотрансфераз, обеспечивающих
использование углеродного скелета АК,
увеличение синтеза гликогена в печени
за счет активации фосфатаз и
дефосфорилирования гликогенсинтазы.
Липидный
обмен:
стимуляция липолиза в жировой ткани
благодаря увеличению синтеза ТАГ-липазы,
что усиливает эффект АКТГ, СТГ, глюкагона,
катехоламинов (пермиссивное действие,
англ. permission - позволение). Водно-электролитный
обмен:
слабый минералокортикоидный эффект на
канальцы почек вызывает реабсорбцию
натрия и потерю калия, потеря воды в
результате подавления секреции
вазопрессина и излишняя задержка натрия
из-за увеличения активности
ренин-ангиотензин-альдостероновой
системы. Противовоспалительное
и иммунодепрессивное действие:увеличение
перемещения лимфоцитов, моноцитов,
эозинофилов и базофилов в лимфоидную
ткань, повышение уровня лейкоцитов в
крови за счет их выброса из костного
мозга и тканей, подавление функций
лейкоцитов и тканевых макрофагов через
снижение синтеза эйкозаноидов посредством
нарушения транскрипции ферментов
фосфолипазы А2 и циклооксигеназы.
Другие эффекты: Повышает чувствительность бронхов и сосудов к катехоламинам, что обеспечивает нормальное функционирование сердечно-сосудистой и бронхолегочной систем.
Патология: Гипофункция - Первичная недостаточность – болезнь Аддисона проявляется:
гипогликемия, повышенная чувствительность к инсулину, анорексия и снижение веса, слабость, гипотензия, гипонатриемия и гиперкалиемия, усиление пигментации кожи и слизистых (компенсаторное увеличение количества АКТГ, обладающего небольшим меланотропным действием).
Вторичная недостаточность возникает при дефиците АКТГ или снижении его эффекта на надпочечники – возникают все симптомы гипокортицизма, кроме пигментации.
Гиперфункция
- Первичная
– болезнь Кушинга проявляется:
снижение
толерантности к глюкозе – аномальная
гипергликемия после сахарной нагрузки
или после еды,
гипергликемия
из-за активации глюконеогенеза,
ожирение
лица и туловища (связано с повышенным
влиянием инсулина при гипергликемии
на жировую ткань) – буйволиный горбик,
фартучный (лягушачий) живот, лунообразное
лицо,
глюкозурия,
повышение
катаболизма белков и повышение азота
крови,
остеопороз
и усиление потерь кальция и фосфатов
из костной ткани,
снижение
роста и деления клеток – лейкопения,
иммунодефициты, истончение кожи, язвенная
болезнь желудка и двенадцатиперстной
кишки,
нарушение
синтеза коллагена и гликозаминогликанов,
гипертония
благодаря активации ренин-ангиотензиновой
системы.
Вторичная
–
синдром Иценко-Кушинга (избыток АКТГ)
проявляется схоже с первичной формой.
С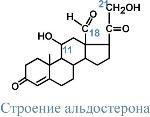 интез
минералокортикоидов
в клетках клубочковой зоны коры
надпочечников также начинается с
превращения холестерола в прегненолон,
а затем в прогестерон. Прогестерон
гидроксилируется вначале по С21 с
образованием 11-дезоксикортикостерона.
Следующее гидроксилирование происходит
по С11, что приводит к образованию
кортикостерона, обладающего слабовыраженной
глюкокортикоидной и минералокортикоидной
активностью. В клетках клубочковой зоны
17-α-гидроксилаза отсутствует, но есть
митохондриальная 18-гидроксилаза, при
участии которой кортикостерон
гидроксилируется, а затем дегидрируется
с образованием альдегидной группы у
С18. Основным гормоном у человека является
альдостерон.
Регуляция
синтеза и секреции:
Активируют:
ангиотензин
II, выделяемый при активации
ренин-ангиотензиновой системы,
повышение
концентрации ионов калия в крови (связано
с деполяризацией мембран, открытием
кальциевых каналов и активацией
аденилатциклазы).
интез
минералокортикоидов
в клетках клубочковой зоны коры
надпочечников также начинается с
превращения холестерола в прегненолон,
а затем в прогестерон. Прогестерон
гидроксилируется вначале по С21 с
образованием 11-дезоксикортикостерона.
Следующее гидроксилирование происходит
по С11, что приводит к образованию
кортикостерона, обладающего слабовыраженной
глюкокортикоидной и минералокортикоидной
активностью. В клетках клубочковой зоны
17-α-гидроксилаза отсутствует, но есть
митохондриальная 18-гидроксилаза, при
участии которой кортикостерон
гидроксилируется, а затем дегидрируется
с образованием альдегидной группы у
С18. Основным гормоном у человека является
альдостерон.
Регуляция
синтеза и секреции:
Активируют:
ангиотензин
II, выделяемый при активации
ренин-ангиотензиновой системы,
повышение
концентрации ионов калия в крови (связано
с деполяризацией мембран, открытием
кальциевых каналов и активацией
аденилатциклазы).
Активация ренин-ангиотензиновой системы. 1.Для активации этой системы существует два пусковых момента:
-снижение давления в приносящих артериолах почек, которое определяется барорецепторами клеток юкстагломерулярного аппарата. Причиной этого может быть любое нарушение почечного кровотока – атеросклероз почечных артерий, повышенная вязкость крови, обезвоживание, кровопотери и т.п.
-снижение концентрации ионов Na+ в первичной моче в дистальных канальцах почек, которое определяется осморецепторами клеток юкстагломерулярного аппарата. Возникает в результате бессолевой диеты, при длительном использовании диуретиков.
2. При выполнении одного или обоих пунктов клетки юкстагломерулярного аппарата активируются и из них в плазму крови секретируется фермент ренин.
3. Для ренина в плазме имеется субстрат – белок глобулиновой фракции ангиотензиноген.
4. В результате протеолиза от белка отщепляется декапептид под названием ангиотензин I.
5. Ангиотензин I при участии ангиотензин-превращающего фермента превращается в ангиотензин II.
6. Главными мишенями ангиотензина II служат кровеносные сосуды и клубочковая зона коры надпочечников.
7. Стимуляция кровеносных сосудов вызывает их спазм и восстановление артериального давления.
8. Из надпочечников после стимуляции секретируется альдостерон, действующий на дистальные канальцы почек.
9. При воздействии на канальцы почек увеличивается реабсорбция ионов Na+, вслед за натрием движется вода. В результате давление в системе вос-ся и концентрация ионов натрия увеличивается в плазме крови, а, значит и в первичной моче.
Транспорт кортикостеровдов. Кортизол в плазме крови находится в комплексе с α-глобулином транскортином и в небольшом количестве в свободной форме. Синтез транскортина протекает в печени и стимулируется эстрогенами. Т1/2 кортизола составляет 1,5-2 ч. Несвязанный, или свободный кортизол, составляет около 8% от общего количества гормона в плазме и является биологически активной фракцией. Альдостерон не имеет специфического транспортного белка, но образует слабые связи с альбумином. Катаболизм гормонов коры надпочечников происходит прежде всего в печени. Здесь протекают реакции гидроксилирования, окисления и восстановления гормонов. Продукты катаболизма кортикостеровдов (кроме кортикостерона и альдостерона) выводятся с мочой в форме 17-кетостероидов, образующихся в результате отщепления боковой цепи. Эти продукты метаболизма выделяются преимущественно в виде конъюгатов с глюкуроновой и серной кислотами. Определение 17-кетостероидов в моче позволяет оценить как количество глюкокортикоидов, секретируемых корой надпочечников, так и функцию надпочечников. Мишени и эффекты: Воздействует на слюнные железы, на дистальные канальцы и собирательные трубочки почек. В почках усиливает реабсорбцию ионов натрия и потерю ионов калия посредством следующих эффектов: увеличивает количество Na+,K+-АТФазы на базальной мембране эпителиальных клеток, стимулирует синтез митохондриальных белков и увеличение количества нарабатываемой в клетке энергии для работы Na+,K+-АТФазы, стимулирует образование Na-каналов на апикальной мембране клеток почечного эпителия.
Патология: Гипофункция -Не отмечена. Гиперфункция - Синдром Конна (первичный альдостеронизм) – возникает при аденомах клубочковой зоны. Характеризуется триадой признаков: гипертензия, гипернатриемия, алкалоз. Вторичный гиперальдостеронизм – гиперплазия и гиперфункция юкстагломерулярных клеток и избыточная секреция ренина и ангиотензина II.
53. Строение, синтез и метаболизм йодтиронинов. Влияние на обмен веществ. Гипо- и гипертиреозы: механизм возникновения и последствия.
В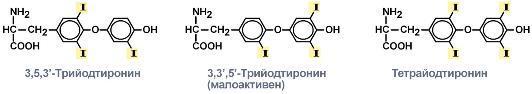 щитовидной железе синтезируются гормоны
- йодированные производные тирозина.
Они объединены общим названием
йодтиронины. К ним относят 3,5,3'-трийодтиронин
(трийодтиронин,
Т3) и 3,5,3',5'-тетрайодтиронин (Т4), или
тироксин.
щитовидной железе синтезируются гормоны
- йодированные производные тирозина.
Они объединены общим названием
йодтиронины. К ним относят 3,5,3'-трийодтиронин
(трийодтиронин,
Т3) и 3,5,3',5'-тетрайодтиронин (Т4), или
тироксин.
Й одтиронины
синтезируются в составе белка
тиреоглобулина (Тг) в фолликулах, которые
представляют собой морфологическую и
функциональную единицу щитовидной
железы. Тиреоглобулин синтезируется
в базальной части клеток, перемещается
к просвету и хранится во внеклеточных
коллоидах, при тиреотропной стимуляции
пиноцитируется фолликулярными клетками,
сливается с лизосомами и гидролизуется.
Три- и тетрайодтиронин секретируются
в кровь. В крови гормоны транспортируются
специфическим глобулином, а также
альбумином. Этапы синтеза тиреоидных
гормонов:1.Транспорт
йода в клетки щитовидной железы:
Йод в виде органических и неорганических
соединений поступает в ЖКТ с пищей и
питьевой водой. Суточная потребность
в йоде составляет 150-200 мкг. 25-30% этого
количества йодидов захватывается
щитовидной железой. Транспорт йодида
в кл щитовидной железы - энергозависимый
процесс и происходит при участии
транспортного белка против электрохимического
градиента (соотношение концентраций
I- в железе к концентрации I- в сыворотке
крови в норме составляет 25:1). Работа
этого йодид-переносящего белка сопряжена
с Nа+,К+-АТФ-азой. Концентрационная
способность железы регулируется ТТГ
2. Окисление
йода. Окисление
I-
в I+
происходит при участии гемсодержащей
тиреопероксидазы и Н2О2
в качестве окислителя. Окисление йодида
до состояния с более высокой валентностью,
что необходимо для органификации йодида
и биосинтеза тиреоидных гормонов. 3.
Йодирование тирозина
(органификация йодида) – Окисленный
йод взаимодействует с остатками тирозина
в молекуле тиреоглобулина. Эта реакция
также катализируется тиреопероксидазой.
4. Образование
йодтиронинов.
Под действием тиреопероксидазы окисленный
йод реагирует с остатками тирозина с
образованием монойод-тирозинов (МИТ) и
дийодтирозинов (ДИТ). Две молекулы ДИТ
конденсируются с образованием йодтиронина
Т4, а МИТ и ДИТ - с образованием йодтиронина
Т3. Йодтиреоглобулин транспортируется
из коллоида в фолликулярную клетку
путём эндоцитоза и гидролизуется
ферментами лизосом с освобождением Т3
и Т4. Если йода поступает достаточно,
соотношение Т4/Т3=7:1. При недостатке,
Т4/Т3 и ДИТ/МИТ снижается. Чем хуже железа
обеспечена йодом, тем выше доля МИТ и
Т3, что считается компенсаторным явлением.
одтиронины
синтезируются в составе белка
тиреоглобулина (Тг) в фолликулах, которые
представляют собой морфологическую и
функциональную единицу щитовидной
железы. Тиреоглобулин синтезируется
в базальной части клеток, перемещается
к просвету и хранится во внеклеточных
коллоидах, при тиреотропной стимуляции
пиноцитируется фолликулярными клетками,
сливается с лизосомами и гидролизуется.
Три- и тетрайодтиронин секретируются
в кровь. В крови гормоны транспортируются
специфическим глобулином, а также
альбумином. Этапы синтеза тиреоидных
гормонов:1.Транспорт
йода в клетки щитовидной железы:
Йод в виде органических и неорганических
соединений поступает в ЖКТ с пищей и
питьевой водой. Суточная потребность
в йоде составляет 150-200 мкг. 25-30% этого
количества йодидов захватывается
щитовидной железой. Транспорт йодида
в кл щитовидной железы - энергозависимый
процесс и происходит при участии
транспортного белка против электрохимического
градиента (соотношение концентраций
I- в железе к концентрации I- в сыворотке
крови в норме составляет 25:1). Работа
этого йодид-переносящего белка сопряжена
с Nа+,К+-АТФ-азой. Концентрационная
способность железы регулируется ТТГ
2. Окисление
йода. Окисление
I-
в I+
происходит при участии гемсодержащей
тиреопероксидазы и Н2О2
в качестве окислителя. Окисление йодида
до состояния с более высокой валентностью,
что необходимо для органификации йодида
и биосинтеза тиреоидных гормонов. 3.
Йодирование тирозина
(органификация йодида) – Окисленный
йод взаимодействует с остатками тирозина
в молекуле тиреоглобулина. Эта реакция
также катализируется тиреопероксидазой.
4. Образование
йодтиронинов.
Под действием тиреопероксидазы окисленный
йод реагирует с остатками тирозина с
образованием монойод-тирозинов (МИТ) и
дийодтирозинов (ДИТ). Две молекулы ДИТ
конденсируются с образованием йодтиронина
Т4, а МИТ и ДИТ - с образованием йодтиронина
Т3. Йодтиреоглобулин транспортируется
из коллоида в фолликулярную клетку
путём эндоцитоза и гидролизуется
ферментами лизосом с освобождением Т3
и Т4. Если йода поступает достаточно,
соотношение Т4/Т3=7:1. При недостатке,
Т4/Т3 и ДИТ/МИТ снижается. Чем хуже железа
обеспечена йодом, тем выше доля МИТ и
Т3, что считается компенсаторным явлением.
Регуляция синтеза и секреции: Активируют: тиреотропный гормон на этапах поглощения йода, синтеза тиреоглобулина, эндоцитоза и секреции Т3 и Т4 в кровь.Уменьшают: тироксин и трийодтиронин (по механизму обратной отрицательной связи), высокие концентрации йода в крови (бесконтрольный прием препаратов KJ).
Метаболизм йодтиронинов. От половины до двух третей Т3 и Т4 находятся в организме вне щитовидной железы. Большая часть их циркулирует в крови в связанной форме в комплексе с белками: тироксинсвязывающим глобулином (ТСГ) и тироксинсвязывающим преальбумином (ТСПА). ТСГ служит основным транспортным белком йодтиронинов, а также формой их депонирования. Он обладает более высоким сродством к Т3 и Т4 и в нормальных условиях связывает почти всё количество этих гормонов. Только 0,03% Т4 и 0,3% Т3 находятся в крови в свободной форме. Т1/2 Т4 в плазме в 4-5 раз больше, чем Т3. Для Т4 этот период составляет около 7 дней, а для Т3 - 1-1,5 дня. Биологическая активность йодтиронинов обусловлена несвязанной фракцией. Т3 - основная биологически активная форма йодтиронинов; его сродство к рецептору клеток-мишеней в 10 раз выше, чем у Т4. Другие пути метаболизма йодтиронинов включают полное дейодирование, дезаминирование или декарбоксилирование. Йодированные продукты катаболизма йодтиронинов конъюгируют-ся в печени с глюкуроновой или серной кислотами, секретируются с жёлчью, в кишечнике вновь всасываются, дейодируются в почках и выделяются с мочой. Механизм действия: Цитозольный.
Мишени и эффекты: Клетки-мишени йодтиронинов имеют 2 типа рецепторов к этим гормонам. Основные эффекты йодтиронинов - результат их взаимодействия с высокоспецифичными рецепторами, которые в комплексе с гормонами постоянно находятся в ядре и взаимодействуют с определёнными последовательностями ДНК, участвуя в регуляции экспрессии генов. Другие рецепторы расположены в плазматической мембране клеток, но это не те же самые белки, что в ядре. Они обладают более низким сродством к йодтиронинам и обеспечивают связывание гормонов для удержания их в непосредственной близости к клетке. Рецепторы к йодтиронинам имеют все ткани организма. В клетках-мишенях тироксин дейодируется и активной формой является трийодтиронин (3,5,3'-производное). Эта реакция ослаблена у плода, новорожденных и престарелых. Главным эффектом трийодтиронина является повышение активности Na+,K+-АТФазы, что приводит к быстрому расходованию АТФ и по механизму дыхательного контроля запускает катаболизм углеводов и липидов. В митохондриях увеличивается количество АТФ/АДФ-транслоказы и потребление кислорода. Сопутствующим эффектом усиления катаболизма является наработка тепла.
Белковый обмен: Усиливает транспорт аминокислот в клетки. Активирует синтез дифференцировочных белков в ЦНС, гонадах, костной ткани и обусловливает развитие этих тканей.
Углеводный обмен: Увеличивает гликогенолиз и аэробное окисление глюкозы.
Липидный обмен: Стимулирует липолиз, β-окисление жирных кислот, подавляет стероидогенез.
Нуклеиновый обмен: Активирует начальные стадии синтеза пуринов и синтеза пиримидинов, стимулирует дифференцировочный синтез РНК и ДНК.
Также трийодтиронин усиливает выделение соматолиберина, что стимулирует секрецию гормона роста, также опосредует его метаболические эффекты. Этот эффект обеспечивает у детей в целом анаболическое действие тиреоидных гормонов. У взрослых действие тиреоидных гормонов в целом катаболическое, в надпочечниках подавляет синтез катехоламинов.
Патология. Гипофункция. Причина. Развивается при снижении синтеза гормонов в результате недостаточной стимуляции со стороны гипофиза и гипоталамуса, при заболевании самой железы, при нехватке необходимых веществ (аминокислоты, йод, селен). В 90% случаев причиной выраженного гипотиреоза является болезнь Хашимото, при которой вырабатываются блокирующие антиантитела к рецепторам ТТГ. Клиническая картина. Симптомами субклинического гипотиреоза, зачастую неспецифическими, могут быть отечность, сухость кожи и волос, брадикардия, легкое увеличение массы тела, повышение диастолического давления (точнее – понижение систолического), вялость, сонливость, запоры, чувствительность к холоду, снижение утренней температуры тела до 36,0°-35,5°С и ниже, бледность, скованность мышц, психическая инертность, апатия. У подростков отмечается отставание в физическом развитии, позднее половое созревание, функциональная дебильность, т.е. замедление мышления, снижение успеваемости в школе, неспособность к творческой деятельности, утрата чувства юмора. При наличии выраженного гипотиреоза у плодов, новорожденных и детей младшего возраста развивается кретинизм. При возникновении выраженного гипотиреоза у взрослых отмечается микседема, у женщин – бесплодие и галакторея, у обоих полов – деменция, психоз.
Гиперфункция. Причина. 90% случаев выраженного гипертиреоза вызвано наличием активирующих антиантител к рецепторам ТТГ. В этом случае заболевание носит название болезнь фон Базедова (в отечественной и европейской литературе), болезнь Грейвса (в американской литературе).
Клиническая картина. Симптомами гипертиреоза являются субфебрильная температура (до 37,5°С, особенно к вечеру), нервное возбуждение, эмоциональная лабильность и нервозность (плаксивость), похудание, мышечная слабость, повышение аппетита, тахикардия, потливость, непереносимость жары, тремор, диарея.
54. Катехоламины. Синтез, депонирование и метаболизм катехоламинов. Механизм действия. Влияние на обмен веществ.
Подобно задней доле гипофиза, мозговой слой надпочечников - производное нервной ткани. Его можно рассматривать как продолжение симпатической нервной системы, так как преганглионарные волокна чревного нерва оканчиваются на хромаффинных клетках мозгового слоя надпочечников. При стимуляции преганглионарного нейрона хромаффинные клетки продуцируют катехоламины (они относятся к группе фенилалкиламинов) - адреналин (80%), норадреналин (20%), дофамин (менее1%). По химическому строению катехоламины - 3,4-дигидроксипроизводные фенилэтиламина. Непосредственным предшественником гормонов служит тирозин. Собственно гормоном можно назвать только адреналин, поскольку два других катехоламина играют в основном медиаторную роль: норадреналин – в симпатической нервной системе, дофамин – в центральной. Адреналин относят к медиаторам симпатической и центральной нервной системы, а также к стресс-гормонам.
С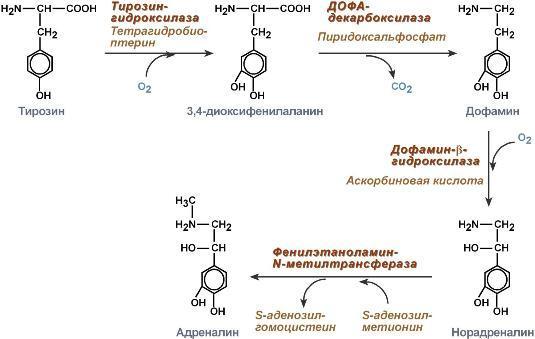 интез
катехоламинов происходит в цитоплазме
и гранулах клеток мозгового слоя
надпочечников. В гранулах происходит
также запасание катехоламинов.
Катехоламины поступают в гранулы путём
АТФ-зависимого транспорта и хранятся
в них в комплексе с АТФ в соотношении
4:1 (гормон-АТФ). Разные гранулы содержат
разные катехоламины: некоторые только
адреналин, другие - норадреналин, третьи
- оба гормона. Синтез осуществляется в
клетках мозгового слоя надпочечников
(80% всего адреналина), синтез норадреналина
(80%) происходит также в нервных синапсах.
Секреция гормонов из гранул происходит
путём экзоцитоза. Катехоламины и АТФ
освобождаются из гранул в том же
соотношении, в каком они сохраняются в
гранулах. В отличие от симпатических
нервов, клетки мозгового слоя надпочечников
лишены механизма обратного захвата
выделившихся катехоламинов.
интез
катехоламинов происходит в цитоплазме
и гранулах клеток мозгового слоя
надпочечников. В гранулах происходит
также запасание катехоламинов.
Катехоламины поступают в гранулы путём
АТФ-зависимого транспорта и хранятся
в них в комплексе с АТФ в соотношении
4:1 (гормон-АТФ). Разные гранулы содержат
разные катехоламины: некоторые только
адреналин, другие - норадреналин, третьи
- оба гормона. Синтез осуществляется в
клетках мозгового слоя надпочечников
(80% всего адреналина), синтез норадреналина
(80%) происходит также в нервных синапсах.
Секреция гормонов из гранул происходит
путём экзоцитоза. Катехоламины и АТФ
освобождаются из гранул в том же
соотношении, в каком они сохраняются в
гранулах. В отличие от симпатических
нервов, клетки мозгового слоя надпочечников
лишены механизма обратного захвата
выделившихся катехоламинов.
В плазме крови катехоламины образуют непрочный комплекс с альбумином. Адреналин транспортируется в основном к печени и скелетным мышцам. Норадреналин образуется в основном в органах, иннервируемых симпатическими нервами (80% от общего количества). Норадреналин лишь в незначительных количествах достигает периферических тканей. Основная часть катехоламинов быстро метаболизируется в различных тканях при участии специфических. Лишь небольшая часть адреналина (~ 5%) выделяется с мочой. Регуляция синтеза и секреции: Активируют: стимуляция чревного нерва, стресс. Уменьшают: гормоны щитовидной железы. Катехоламины действуют на клетки-мишени через рецепторы, локализованные в плазматической мембране. Механизм действия гормонов разный в зависимости от рецептора (R). Конечный эффект гормонов зависит от преобладания типа рецепторов на клетке и концентрации гормона в крови. Выделяют 2 главных класса таких рецепторов: α-адренергические и β-адренергические. Все рецепторы катехоламинов - гликопротеины, передают сигналы в клетки с помощью разных вторичных посредников. Это определяет характер их влияния на метаболизм клеток-мишеней. Адреналин взаимодействует как с α-R, так и с β-R; норадреналин в физиологических концентрациях главным образом взаимодействует с α-R. Аденилатциклазный механизм: а) при задействовании α2-адренорецепторов аденилатциклаза ингиб-ся,
б) при задействовании β1- и β2-адренорецепторов аденилатциклаза активируется. Кальций-фосфолипидный механизм: при возбуждении α1-адренорецепторов. Мишени и эффекты: 1)При возбуждении α1-адренорецепторов (печень, СС и мочеполовая системы): активация гликогенолиза, сокращение гладких мышц кровеносных сосудов и мочеполовой системы.2) При возбуждении α2-адренорецепторов (жировая ткань, поджелудка, почки):подавление липолиза (уменьшение стимуляции ТАГ-липазы), подавление секреции инсулина и секреции ренина. 3) При возбуждении β1-адренорецепторов (есть во всех тк): активация липолиза, увеличение силы и ЧСС миокарда. 4)При возбуждении β2-адренорецепторов (есть во всех тк): стимуляция гликогенолиза в печени и мышцах, и глюконеогенеза в печени, расслабление гладких мышц бронхов, кровеносных сосудов, мочеполовой системы и ЖКТ. В целом катехоламины отвечают за биохимические реакции адаптации к острым стрессам, связанным с мышечной активностью – "борьба или бегство": -усиление липолиза и продукция жирных кислот в жировой ткани для мышечной активности, -гипергликемия за счет глюконеогенеза и гликогенолиза в печени для повышения устойчивости ЦНС, -стимуляция гликогенолиза в мышцах, -активация протеолиза в лимфоидной ткани для обеспечения глюконеогенеза субстратом (АК), -снижение анаболических процессов через уменьшение секреции инсулина.
Адаптация также прослеживается в физиологических реакциях: -мозг – усиление кровотока и стимуляция обмена глюкозы,
-мышцы – усиление сократимости, -ССС – увеличение силы и ЧСС миокарда, -легкие – расширение бронхов, улучшение вентиляции и потребления О2, -кожа – снижение кровотока. Удаление катехоламинов из синаптич. щели происходит путем обратного захвата в пресинаптич. окончания. Этот активный транспорт происходит с использованием энергии градиента Na+ на мембране. Часть катехоламинов диффундирует из синапса в межклеточное пространство и затем поступает в кровь. Инактивируются катехоламины путем окислит, дезаминирования, катализируемого катехол-О-метилтрансферазой. Метаболиты катехоламинов удаляются из организма почками, поэтому их содержание в моче может указывать на активность симпатич. НС и мозгового слоя надпочечников.
Основная патология мозгового вещества надпочечников - феохромоцитома, опухоль, образованная хромаффинными клетками и продуцирующая катехоламины. Клинически феохромоцитома проявляется повторяющимися приступами головной боли, сердцебиения, потливости, повышением АД и сопровождается характерными изменениями метаболизма.
