
Zn (тв.) ZnSo4 (р-р) kCl CuSo4 (р-р) Cu (тв.)
В разомкнутом обратимом гальваническом элементе на фазовых границах образуется двойной электрический слой и устанавливается равновесие, которому соответствует равновесный скачок потенциала. Однак,о если замкнуть электроды проводником I рода (соединить металлической проволокой), равновесие нарушается.
Так как электрические потенциалы электродов неодинаковы, электроны с левого, более отрицательного электрода, перемещаются на правый, менее отрицательный. Это нарушает равновесие в двойном электрическом слое отрицательного электрода, на котором окажется меньше электронов, чем нужно для равновесия, и положительного электрода, где окажется больше электронов. Чтобы восстановить равновесие на границах фаз, пойдут реакции, в результате которых на левом (отрицательном) электроде должны освобождаться электроны, а на правом (положительном) – поглощаться.
Для элемента Zn (тв.) ZnSO4 (р-р) KCl CuSO4 (р-р) Cu (тв.):
– на отрицательном электроде Znº Zn2+ + 2е│2;
на положительном электроде Сu2+ + 2ē Cuº│2;
– суммарная токообразующая
реакция Znº + Сu2+ Zn2+ + Cuº.
Таким образом, за счет химической реакции вытеснение цинком ионов меди из раствора электроны непрерывно движутся по проволоке, соединяющей электроды, то есть совершается электрическая работа.
Реакция, за счет которой в гальваническом элементе совершается электрическая работа, называется потенциалобразующей (или токообразующей).
Электродвижущая сила (ЭДС) гальванического элемента вычисляется по формуле
Е= E1 – E2 , (7)
где Е1 – потенциал катода, Е2 – потенциал анода.
Е
= (E1º
+
![]() )
– (E2º
+
)
– (E2º
+![]() )
(8)
)
(8)
Если n1 = n2, то
Е
= E1º
– E2º
+
![]() ,
(9)
,
(9)
a = C, (10)
где – коэффициенты активности металлов в растворе, который можно найти в справочнике.
Различают гальванические элементы химические, у которых ЭДС возникает вследствие различной химической природы электродов, и концентрационные, которые составлены из двух качественно одинаковых полуэлементов – электродов любого рода, различающихся активностью ионов или веществ, участвующих в потенциалобразующем процессе.
Например, для элемента
![]()
(с1 и с2 – концентрации нитрата серебра в полуэлементах, с1 с2 ) на отрицательном электроде протекает окислительный процесс, а на положительном – восстановительный:
() Ag – e Ag+ (лев)
(+) Ag+(пр) + е Ag
Ag+(пр) Ag+(лев).
При
суммировании уравнений электродных
реакций получаем уравнение процесса,
протекающего в гальваническом элементе,
из которого ясно, что в концентрационном
элементе химическая реакция не протекает.
Электрическая работа совершается за
счет процесса выравнивания концентраций
потенциалобразующих ионов. Стандартная
ЭДС концентрационного элемента равна
нулю (![]() ),
тогда в соответствии с уравнением
Нернста для данного элемента имеем
),
тогда в соответствии с уравнением
Нернста для данного элемента имеем
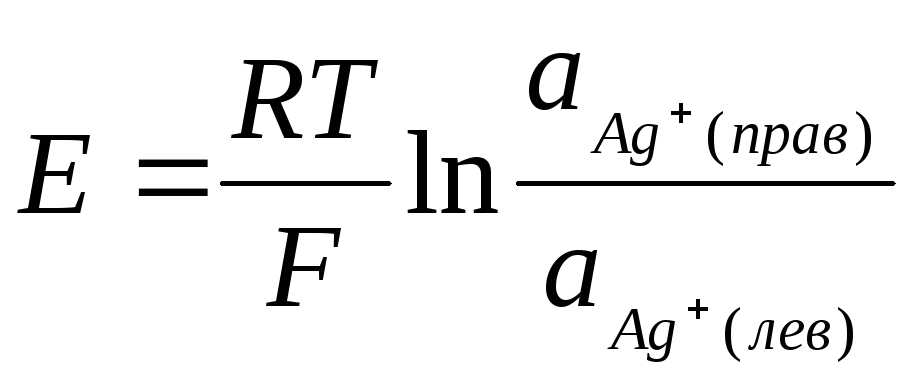 .
(11)
.
(11)
Концентрационные гальванические элементы можно составить из амальгамных электродов, отличающихся концентрацией вещества в амальгаме, или газовых с различными давлениями реагирующего газа.
Таким образом, задача данной работы заключается в измерении ЭДС гальванических элементов при разных концентрациях электролитов:
