
gidroliz_soley
.pdf
Гидролиз солей.
Среда водных растворов: кислая, нейтральная, щелочная
Водородный показатель pH
Индикаторы
Суть гидролиза
Типы солей
Алгоритм составления уравнений гидролиза солей
Гидролиз солей различных типов
Способы подавления и усиления гидролиза

Водородный показатель pH
•Водородный показатель, pH — мера концентрации ионов водорода в растворе, по первым буквам латинских слов potentia hydrogeni — сила водорода
•Вычисляется как отрицательный десятичный логарифм концентрации водородных ионов, выраженной в моль/л:
•В чистой воде при 25 °C концентрации ионов водорода [H+] и гидроксид-ионов [OH−] одинаковы и составляют 10−7 моль/л.
•Когда концентрации обоих видов ионов в растворе одинаковы, раствор имеет нейтральную реакцию.
При добавлении к воде кислоты концентрация ионов водорода увеличивается, а концентрация гидроксид-ионов соответственно уменьшается.
При добавлении основания — наоборот, повышается содержание гидроксид-ионов, а концентрация ионов водорода падает.
Когда [H+] > [OH−] раствор является кислым, а при
[OH−] > [H+] — щелочным.
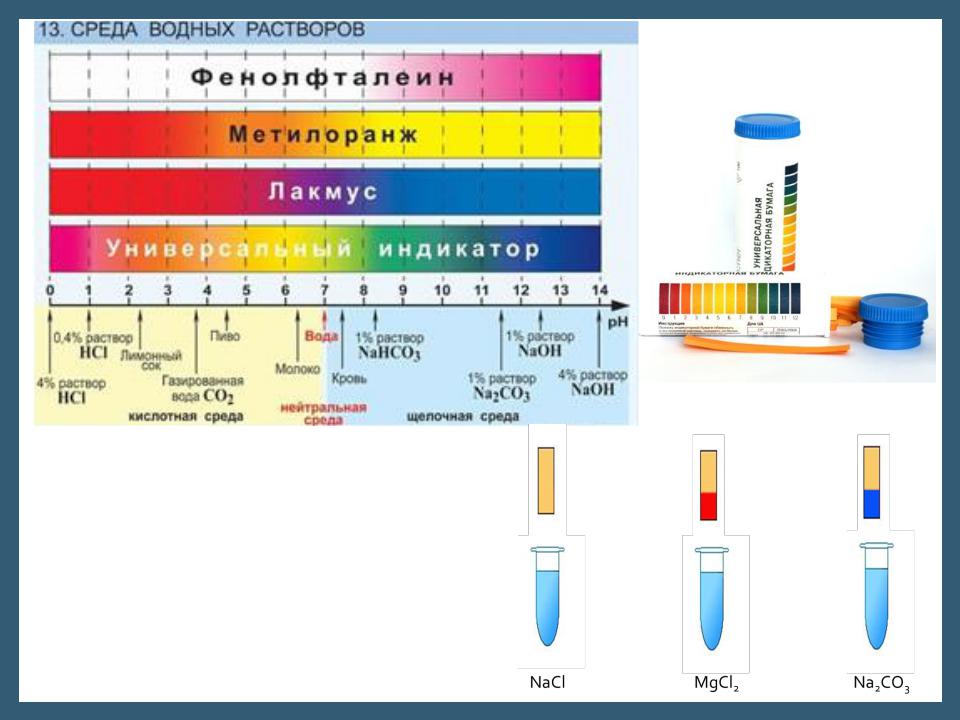
Исследуем действие универсального индикатора на растворы некоторых солей. Среда первого раствора — нейтральная (рН=7), второго — кислая (рН < 7 ), третьего щелочная (рН > 7). Чем это можно объяснить?

Гидролиз солей - это химическое взаимодействие ионов соли с ионами воды, приводящее к образованию слабого электролита - кислоты (или кислой соли), или основания (или основной соли).
Слово «гидролиз» означает разложение водой («гидро»-вода, «лизис» - разложение).
Суть гидролиза солей заключается в том, что происходит смещение равновесия диссоциации воды вследствие связывания одного из ее ионов с образованием малодиссоциированного, труднорастворимого или летучего продукта.
Возможно три типа гидролиза:
гидролиз по катиону (в реакцию с водой вступает только катион); гидролиз по аниону (в реакцию с водой вступает только анион);
совместный гидролиз - гидролиз по катиону и по аниону (в реакцию с водой вступает и катион, и анион).
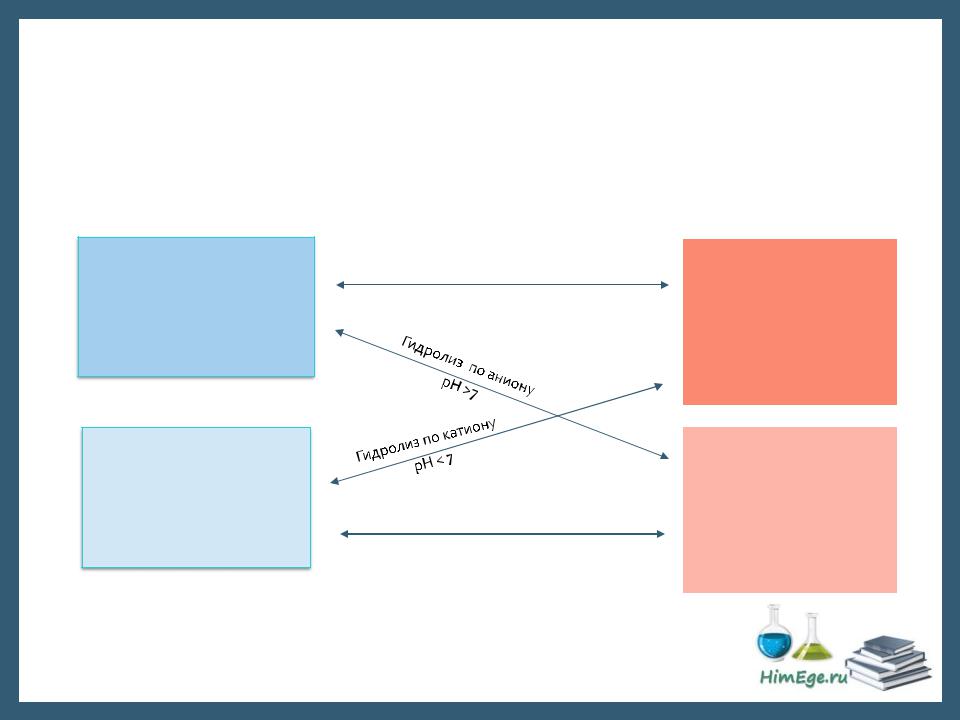
Любую соль можно рассматривать как продукт, образованный взаимодействием основания и кислоты:
Сильные основания:
NaOH
KOH Sr(OH)2 Ba(OH)2
Слабые основания:
NH4OH
Al(OH)3
Zn(OH)2
(все нерастворимые)
Соли
Гидролизу не подвергаются рН = 7
Гидролиз по катиону и аниону рН ~ 7, среда слабокислая или слабощелочная
Сильные кислоты: HCl,
HBr
HI
HNO3,
H2SO4
Слабые кислоты: HF,
H2S, H2CO3, H2SiO3 CH3COOH
Алгоритм составления уравнений гидролиза солей
1.Рассмотреть состав соли, определить к какому типу солей по составу она относится.
2.Записать уравнение диссоциации соли (распада на ионы)
3.Записать уравнение гидролиза иона, соответствующего слабому основанию или слабой кислоте.
4.Определить среду раствора (рН)
5.Записать уравнение гидролиза в молекулярной форме.

1. Соль образована сильным основанием и слабой кислотой
КOH - сильное основание
KNО2
HNO2 - слабая кислота
KNО2 ↔ K+ + NО2-
NО - + Н+ОН- ↔ HNО |
|
+ OH- |
щелочная среда, рН 7 |
||
2 |
|
2 |
|
|
|
|
|
|
|||
|
|
|
|
|
|
KNО2 + H2O ↔ HNО2 +KOH

Если слабая кислота многоосновна:
NaOH - сильное основание
Na2S
H2S - слабая кислота
Na2S ↔ 2Na+ + S2-
S2- + H+OH- ↔ HS- + OH- щелочная среда, рН > 7
Na2S + H2O ↔ NaHS + NaOH
В случае, если соль образованна слабой многоосновной кислотой, гидролиз
протекает ступенчато.
2 ступень: HS- + H+OH-↔ H2S + ОН-
! Гидролиз средних солей многоосновных кислот приводит к кислых солей.

2. Соль образована слабым основанием и сильной кислотой
NH4OH – слабое основание
NH4Cl
HCl – сильная кислота
NH |
Cl ↔ NH + + Cl- |
|
|
|||
4 |
4 |
|
|
|||
NH |
+ + H+OH- ↔ NH |
OH + H+ |
среда кислая, рН < 7 |
|||
4 |
|
|
4 |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
NH4Cl + H2O ↔ NH4OH + HCl

Если слабое основание многокислотное
Zn(OH)2↓ – слабое основание
Zn(NO3)2
HNO3 – сильная кислота
Zn(NO3)2 ↔ Zn2+ + 2NO3- |
|
||
Zn2+ + Н+ОН- ↔ ZnОН+ + Н+ |
кислая среда, рН < 7 |
||
|
|
|
|
Zn(NO3)2 + Н2О ↔ ZnОНNO3 |
+ HNO3 |
||
В случае, если соль образованна слабым многокислотным основанием, гидролиз
протекает ступенчато.
2 ступень: ZnОН+ + Н+ОН- ↔ Zn(ОН)2 + Н+
! Гидролиз средних солей многокислотных оснований приводит к образованию основных солей.
