
Лекции / Лекции (Павлова) / L16
.docЛекция №16.
Э
мольные
доли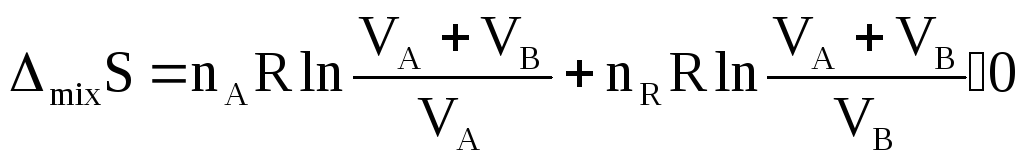 нтропия
смешения:
нтропия
смешения:
К
 огда:
pA=pB
огда:
pA=pB
∆mixS=-R(nAlnXA+nBlnXB)0
Если 1 моль газа, то можно записать
∆mixS=-R(XAlnXA+XBlnXB)0.
∆mixS не зависит от природы смешиваемых газов, а зависит от их количества.
Докажем это утверждение:
S=ncVlnT+nRlnV+S0 – определяем энтропию системы, состоящей из двух газов, до смешивания и после смешивания.
Возьмем 1 моль газа А и 1 моль газа В
а) общий случай
Т огда
энтропия исходной системы определится
выражением
огда
энтропия исходной системы определится
выражением
S
const
интегрирования
 исх=SА,исх+
SВ,исх=R(nAlnVA+nBlnVB)+(T)+SAO+SBO
исх=SА,исх+
SВ,исх=R(nAlnVA+nBlnVB)+(T)+SAO+SBO
т
 .к.
изотермический процесс смешения
.к.
изотермический процесс смешения
слагаемое cVlnT обозначим через (Т)
Sкон=SА,кон+SВ,кон=R(nAlnV+nBlnV)+(T)+SA1O+SB1O.
б) Пусть теперь nA=nB=1 моль если pA=pB VA=VB=Vo
Sисх=2RlnVo S1кон=2RlnV=2Rln2Vo
∆Smix=Sкон-Sисх=2Rln2.
Следовательно при смешение газа энтропия не определяется природой, а определяется их количеством.
Если энтропия смешения не зависит от природного газа, то можно поставить опыт, когда в байде находиться однородный газ.
С физической точки зрения при смешение
однородного газа ∆S=0,
а по парадоксу Гиббса ∆mixS=2Rln2?
физической точки зрения при смешение
однородного газа ∆S=0,
а по парадоксу Гиббса ∆mixS=2Rln2?
∆mixS=-nARlnXA-nBRlnXB – если газ однородный образовавшийся в системе после снятия перегородки (XA=nA/(nA+ nA), если однород. XA=1).
С физической точки зрения при смешивание однородных газов энтропия не до. изменяется, т.к. при снятие перегородки в системе в системе с двумя порциями одного и гоже газа – никакого смешения не происходит. В чем ошибка, когда мы приходим к результату ∆S0, здесь мы сталкиваемся как будто с противоречием представляющим парадокс Гиббса: формулировка: энтропия смеси идеального газа равна сумме энтропий отдельных газов, когда каждый из них занимает весь объем.
Разрешение парадокса Гиббса: смешение двух идеальных газов нельзя рассматривать как предельный случай смешения двух различных газов; при переходе от …. Сколько угодно близких по свойствам газов, которые разделены в этой смеси, к смеси одинаковых газов энтропия смешения испытывает скачок – это и есть парадокс Гиббса. Разделить nТиб значит установить физическое значение скачка величины изменения энтропии при переходе от смеси сколько угодно близких газов к смеси одинаковых газов.
В литературе известна точка зрения (Вестхард, Шредингер, Кедров) – химические различия между газами непрерывной величиной, которая постепенно сходила бы на нет. Есть только два предельных случая: или различие существует или его совсем нет.
Физическим основанием П.Г. – невозможность разделения на первоначальные порции смеси тождественных газов (мы не можем разделить одинаковые газы на одинаковые порции).
В отличия термодинамика допускает разделение смеси сколь угодно мало отличающихся газов на отдельные части.
Смеси тождественных газов и отличие смеси разных газов при переходе от сколь угодно близких газов к смешиванию тождественных газов ∆S.
Необратимые смешивания газов (при T=const).
Смоделируем процесс смешивания:
С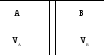 истема
в термостате производим смешивание
газов А и В убирая газа, потом произойдет
самопроизвольное смешивание газа
процесс необратимый; т.к. T=const
изменение внутренней энергии равно 0,
газы идеальны,; на систему не действовали
внешние силы
система не производит работы.
истема
в термостате производим смешивание
газов А и В убирая газа, потом произойдет
самопроизвольное смешивание газа
процесс необратимый; т.к. T=const
изменение внутренней энергии равно 0,
газы идеальны,; на систему не действовали
внешние силы
система не производит работы.
Q=∆U+A ∆U=0 A=0 Q=0,
т.е. процесс самопроизвольного смешивания при T=const не будет сопровождаться выделением или поглощением теплоты. Исходное состояние системы такое же, как при обратимом изотермическом процессе, поэтому для расчета энтропии можно воспользоваться ранее полученными формулами.
∆mixS=-R(nAlnXA+ nBlnXB)0, т.к. XА(В)1.
Энтропия термостата не изменится, а энтропия изолированной системы (прибор + термостат) увеличится вследствие протекания процесса
∆Sизол0.
Выводы: из уравнения (1) и (2) вытекает:
-
энтропия смешения не зависит от температуры, что учитывается при рассмотрении начала термодинамики.
-
смешение газов сопровождается ростом энтропии, т.е. смешение газов – самопроизвольный процесс, его движущая сила – увеличение энтропии, т.к. теплота при смешивании идеальных газов отсутствует.
Представление об аддитивности свойств.
Т.к. энтропия – аддитивное свойство; запишем энтропию газов до смешения и после смешения:
Sисх=S1,исх+S2,исх
Sкон=S1,исх+S2,исх+∆mixS – конечное состояние можно определить еще так:
Sкон=S1,кон+S2,кон поэтому эти формулы наглядно показывают нам, чем энтропия идеальных газов отличается от других свойств например внутренний энергии и энтальпии.
Для внутренней энергии: Uисх=U1,исх+U2,исх.
Uкон=U1,кон+U2,кон ∆mixU=0.
Адиабатическое смешивание газов.
Рассмотрим случай, когда смешивание газов происходит в приборе адиабатической оболочкой.
Е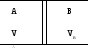 сли
процесс смешивания проводится обратимо,
то изменение энтропии должно быть равно
0. При адиабатическом смешивании каждый
из газов испытывает расширение и его
температура понижается, поэтому этот
вклад в энтропию системы определяется
слагаемым:
сли
процесс смешивания проводится обратимо,
то изменение энтропии должно быть равно
0. При адиабатическом смешивании каждый
из газов испытывает расширение и его
температура понижается, поэтому этот
вклад в энтропию системы определяется
слагаемым:
∆S=(nA+nB)cpln(T2/T1)+(вклад связанный с увеличением)+∆mixS=0.
(nA+nB)cpln(T2/T1)0; ∆mixS0; T2>T1.
Увеличение беспорядка в системе, связанного с процессом смешения газа компенсируется за счет менее интенсивного теплообмена, т.к. газы охлаждаются.
Расчет
 Кристаллизация
охлажденной жидкости оценить ∆S
воды при кристаллизации при to=-10oC.
Кристаллизация
охлажденной жидкости оценить ∆S
воды при кристаллизации при to=-10oC.
![]()
Т.к. изменение энтропии не зависит от пути перехода от истинного состояния к конечному надо рассмотреть такой путь перехода по которому процесс может протекать через ряд обратимых стадий. Здесь мы рассматриваем замерзание воды меньше ее точки равновесного замерзания.
, но переход H2O из переохлажденного жидкого состояния в твердое можно провести обратимо через следующие стадии:
-
обратимое нагревание воды от –10оС до 0оС.
![]() H2O(ж,t=-10oC)
H2O(ж,0оС).
H2O(ж,t=-10oC)
H2O(ж,0оС).
-
обратимое замерзание H2O при 0оС.
![]() H2O(ж,t=0oC)
H2O(лед,t=0оС)
- процесс изотермический
H2O(ж,t=0oC)
H2O(лед,t=0оС)
- процесс изотермический
-
обратимое охлаждение льда от 0оС до –10оС.
![]() H2O(тв,t=0oC)
H2O(тв,t=-10оС).
H2O(тв,t=0oC)
H2O(тв,t=-10оС).
