
- •Федеральное агентство по образованию
- •Гладской в.М., Дмитриева в.Ф., Калугина л.И.,
- •Оглавление
- •Глава 8. Физические основы молекулярной физики
- •Статистический (молекулярно-кинетический) и термодинамический методы исследования
- •Основное уравнение молекулярно-кинетической теории газов
- •Кинетическая энергия и скорость поступательного движения молекулы. Давление
- •Среднее число столкновений и средняя длина свободного пробега молекул в газе
- •Явления переноса в газах. Законы диффузии, теплопроводности и внутреннего трения
- •Контрольные вопросы
- •Пример решения задач
- •Глава 9. Статистические распределения Закон распределения энергии по степеням свободы молекулы
- •И энергиям теплового движения Максвелла
- •Распределение Больцмана
- •Контрольные вопросы
- •Пример решения задач
- •Глава 10. Основы термодинамики Внутренняя энергия идеального газа
- •Работа газа при расширении
- •Количество теплоты. Теплоемкость газов. Уравнение Майера
- •Адиабатный процесс
- •Цикл Карно и его кпд для идеального газа
- •Энтропия идеального газа. Второй закон термодинамики. Теорема Нернста
- •Энтропия и вероятность
- •Контрольные вопросы
- •Пример решения задач
- •Глава 11. Реальные газы
- •Взаимодействие молекул реального газа
- •Уравнение Ван-дер-Ваальса. Изотермы Ван-дер-Ваальса
- •Внутренняя энергия реального газа
- •Контрольные вопросы
- •Пример решения задач
- •Дополнительные контрольные вопросы к главам 8 - 10
- •Глава 8. 1.А); 2.А); 3.В); 4.Д); 5.Б).
Энтропия идеального газа. Второй закон термодинамики. Теорема Нернста
Формулу КПД обратимого цикла Карно можно переписать в виде
![]()
Преобразуем это равенство к другому виду
![]() (1)
(1)
Величину, равную отношению теплоты, полученной телом при изотермическом процессе, к температуре, при которой происходит теплопередача, называют приведенной теплотой. В последнем равенстве Qозначает теплоту, переданную телу нагревателем, имеющим температуру Т,Q0– теплоту, отданную холодильнику, имеющему температуру Т0. Если условно считать, что холодильник тоже отдает телу теплоту, но теплоту со знаком “минус“ (Q0 < 0), то последнее равенство можно переписать в виде
![]()
т.е. алгебраическая сумма приведенных теплот для обратимого цикла Карно равна нулю.
Любой процесс, в общем случае, можно
представить как результат бесконечно
большого числа бесконечно малых
процессов, в течение каждого из которых
передача теплоты ΔQ(если
процесс не адиабатный) происходит при
постоянной температуре Т. Для каждого
такого элементарного процесса приведенная
теплота равна![]() ,
а для цикла сумма приведенных теплот
будет равна нулю:
,
а для цикла сумма приведенных теплот
будет равна нулю:
![]()
В пределе эта сумма представляет собой интеграл по замкнутому контуру, который равен нулю.
![]() ∮
∮![]() .
.
Такой интеграл равен нулю в том случае, если подынтегральное выражение является полным дифференциалом dSнекоторой функцииS, которая называется энтропией, причемdS= δQ/T.
Основное свойство энтропии – она (подобно внутренней энергии) является однозначной функцией состояния, т.е. каждому состоянию тела соответствует одно определенное значение энтропии. Если система в процессе изменения состояния перешла из состояния 1 в состояние 2, то изменение энтропии ΔS, будет равно
![]()
Очевидно, что для кругового процесса, когда начальное 1 и конечное 2 состояния совпадают, S2 =S1и ΔS= 0, т.е. в круговом процессе энтропия системы не изменяется.
Для необратимого процесса
![]() и после преобразования аналогичного
преобразованию (1), получим
и после преобразования аналогичного
преобразованию (1), получим Объединяя
эти выражения для обратимого и необратимого
процессов, можно записать
Объединяя
эти выражения для обратимого и необратимого
процессов, можно записать
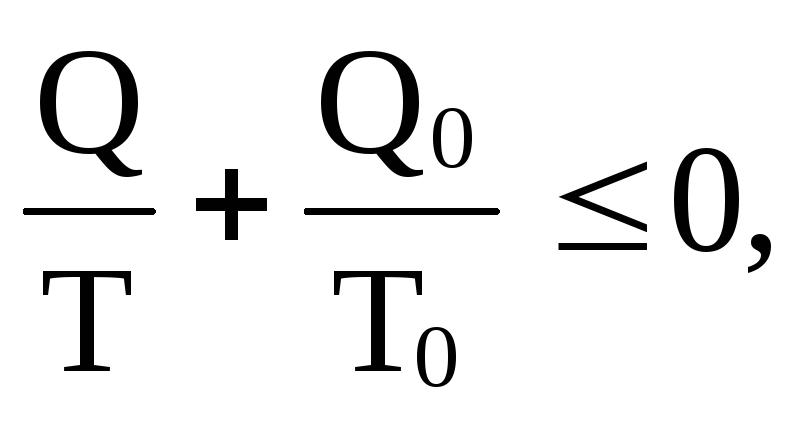
т.е. сумма приведенных теплот для любого цикла не может быть больше нуля (неравенство Клаузиуса). Обобщая неравенство на любой круговой процесс (обратимый и необратимый), можно записать
![]() ∮
∮![]() =∮dS≤ 0.
=∮dS≤ 0.
Знак “=” относится к обратимым процессам, а знак “< “ – к необратимым.
Поскольку для необратимого процесса в замкнутой системе (теплота в нее не поступает и из нее не уходит, т.е. δQ= 0 ) выполняется неравенство
![]()
то
![]() ,
а это значит, чтоS2>S1.
,
а это значит, чтоS2>S1.
Таким
образом, при необратимых процессах в
замкнутой (изолированной) системе
энтропия возрастает. Для произвольного
(обратимого и необратимого) процесса в
изолированной системе
![]() ,
т.е. энтропия изолированной системы при
любых происходящих в ней изменениях не
может убывать.
,
т.е. энтропия изолированной системы при
любых происходящих в ней изменениях не
может убывать.
Первый закон термодинамики, как известно, является законом сохранения энергии в тепловых процессах и дает количественные соотношения теплоты, внутренней энергии и работы, не говоря ничего о направлении протекания процессов. Второй закон термодинамики определяет направление протекания процессов. С введением понятия энтропии о направлениях протекания процессов можно судить по ее изменениям. Изменение энтропии изолированной системы выражается так
S2–S1≥ 0,
Таким образом, при обратимом процессе энтропия не изменяется (S2–S1= 0), а при необратимом она возрастает (S2–S1> 0). Все реальные тепловые процессы, протекающие в замкнутой системе, необратимы, т.е. часть энергии при протекании этих процессов рассеивается, вследствие чего энтропия системы возрастает.
Из сказанного можно сделать заключение:
Изменение энтропии замкнутой системы при необратимых процессах может служить мерой рассеяния энергии в таких процессах.
По изменению энтропии можно судить о направлении протекания процессов.
Второй закон термодинамики определяет направление процессов. В частности, все естественные процессы протекают в сторону возрастания энтропии.
Существует несколько формулировок 2-го закона термодинамики. Ниже приведены две из них.
Невозможен процесс, единственным результатом которого является превращение всей теплоты, полученной от некоторого тела, в эквивалентную ей работу.
Невозможен процесс, единственным результатом которого является передача энергии в форме теплоты от тела менее нагретого к телу более нагретому.
Из второго закона термодинамики вытекает вывод о невозможности построения вечного двигателя второго рода, действующего за счет охлаждения одного источника теплоты (например, путем отбора внутренней энергии у мирового океана или из больших водоемов).
Теорема
Нернста позволяет определить значение
энтропии в каждом состоянии. Поскольку
в пределе при Т→ 0 значение энтропии
равно нулю
![]() ,
то значение энтропии системы при
температуре
,
то значение энтропии системы при
температуре![]() ,
если известна ее теплоемкость,
определяется интегралом
,
если известна ее теплоемкость,
определяется интегралом
![]()
